Campath
Les Informations Présentées Sur Ce Site Ne Constituent Pas Un Avis Médical. Nous Ne Vendons Rien. L'Exactitude De La Traduction N'Est Pas Garantie. Clause De Non-Responsabilité
Résumé
Qu'est-ce que Campath?
Campath (Alemtuzumab) est un anticorps fabriqué à partir d'ADN animal utilisé pour traiter la leucémie lymphocytaire chronique. Campath est généralement donné après que d'autres médicaments ont été essayés sans traitement réussi.
Quels sont les effets secondaires de Campath?
Campath peut provoquer de graves effets secondaires, notamment:
- urticaire
- difficulté à respirer
- gonflement de ton visage lèvres langue ou gorge
- fièvre
- frissons
- nausée
- étourdissement
- éruption cutanée
- respiration sifflante
- douleur thoracique
- Problèmes de vision de la pensée de la parole ou de mouvement musculaire
- ecchymoses faciles
- saignement inhabituel
- taches violettes ou rouges sous votre peau
- plaies de la bouche
- plaies de la peau
- mal de gorge
- toux
- peau pâle ou jaunie
- Urine de couleur foncée
- confusion
- faiblesse inhabituelle
- essoufflement
- mains et pieds froids
- gonflement dans les jambes inférieures
- prise de poids
- perte d'appétit
- Douleur soudaine dans votre estomac ou votre dos et
- urine qui a l'air brune rose ou mousseuse
Obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires courants de Campath comprennent:
- fièvre
- frissons
- vertiges
- raideur musculaire
- Douleurs articulaires ou musculaires
- nausée
- vomissement
- perte d'appétit
- douleurs abdominales
- mal de tête
- diarrhée
- éruption cutanée or itching
- urticaire
- fatigue
- Problèmes de sommeil (insomnie)
- anxiété
- fatigue
- toux
- transpiration ou
- difficulté à respirer pendant ou après la perfusion.
Ces effets secondaires se produisent plus souvent au cours de la première semaine de traitement avec Campath. Dites à votre médecin si vous avez des effets secondaires graves de Campath, notamment:
- essoufflement
- changements mentaux / d'humeur (comme l'anxiété de dépression)
- os ou maux de dos
- spasme musculaire
- faiblesse inhabituelle
- les chevilles ou les pieds gonflants
- Jaunotrice de la peau ou des yeux
- Changements dans la quantité d'urine
- miction douloureuse
- urine rose ou sanglante
- engourdissement ou picotement des bras ou des jambes ou
- Douleur / rougeur / gonflement des bras / jambes / site d'injection.
Cherchez des soins médicaux ou appelez le 911 à la fois si vous avez les effets secondaires graves suivants:
- Des symptômes oculaires graves tels que la perte de vision soudaine floue du tunnel de vision de la vision de la vision des yeux ou de l'enflure ou de voir des halos autour des lumières;
- Symptômes cardiaques graves tels que les battements cardiaques rapides ou battants; flotter dans votre poitrine; essoufflement; et des étourdissements soudains étourdisseurs ou s'évanouissant;
- Maux de tête sévères Confusion Slurred Speech Bras ou Ligne Proulitude Trouble de la merde Perte de coordination Sentiment des muscles très rigides très rigides Fièvre élevée Propice ou des tremblements.
Ce document ne contient pas tous les effets secondaires possibles et d'autres peuvent survenir. Vérifiez auprès de votre médecin des informations supplémentaires sur les effets secondaires.
Dosage pour Campath
Le médicament Campath est donné par voie intraveineuse sous la supervision des médecins, généralement plus de 2 heures. Le dosage est basé sur la réponse du patient au traitement. Les patients sont généralement démarrés à faible dose de médicament et la dose peut être lentement augmentée.
Quelles substances ou suppléments de médicaments interagissent avec Campath?
D'autres médicaments peuvent affecter Campath. Parlez à votre médecin de tous les médicaments sur ordonnance et en vente libre que vous utilisez. Cela comprend les vitamines minéraux, produits à base de plantes et médicaments prescrits par d'autres médecins. Ne commencez pas à utiliser un nouveau médicament sans le dire à votre médecin.
À quoi sert le lisinopril?
Campath pendant la grossesse et l'allaitement
Pendant la grossesse, le campath ne doit être utilisé que lorsqu'il est prescrit. Il est recommandé que les hommes et les femmes qui reçoivent ce médicament utilisent au moins 2 formes de contraception (par exemple, les pilules contraceptives des préservatifs) pendant le traitement avec ce médicament et pendant au moins 6 mois après. On ne sait pas si ce médicament passe dans le lait maternel. En raison du risque possible pour l'allaitement maternel du nourrisson, alors que l'utilisation de ce médicament n'est pas recommandée pendant le traitement avec ce médicament et pendant au moins 3 mois après.
Informations Complémentaires
Notre centre de médicaments à effets secondaires Campath (Alemtuzumab) offre une vue complète des informations sur les médicaments disponibles sur les effets secondaires potentiels lors de la prise de ce médicament.
Informations sur les médicaments de la FDA
- Description de la drogue
- Indications
- Effets secondaires
- Avertissements
- Surdosage
- Pharmacologie clinique
- Guide des médicaments
AVERTISSEMENT
Réactions et infections à perfusion de cytopénies
Cytopénies
Grave, y compris la pancytopénie mortelle / hypoplasie de la moelle, la thrombocytopénie idiopathique auto-immune et l'anémie hémolytique auto-immune peuvent survenir chez des patients recevant Campath. Des doses uniques de Campath supérieures à 30 mg ou des doses cumulées supérieures à 90 mg par semaine augmentent l'incidence de la pancytopénie [voir avertissements et PRÉCAUTIONS ].
Réactions de perfusion
L'administration de Campath peut entraîner de graves réactions mortelles de perfusion. Surveiller soigneusement les patients pendant les perfusions et retenir Campath pour les réactions de perfusion de grade 3 ou 4. Dégénèrent progressivement Campath à la dose recommandée lors de l'initiation de la thérapie et après l'interruption de la thérapie pendant 7 jours ou plus [voir Posologie et administration et avertissements et PRÉCAUTIONS ].
Infections
Des infections aux champignons et protozoaires viraux bactériens mortels peuvent survenir chez les patients recevant Campath. Administrer la prophylaxie contre la pneumonie Pneumocystis Jiroveci (PCP) et les infections au virus de l'herpès [voir Posologie et administration et avertissements et PRÉCAUTIONS ].
Description de Campath
Campath (Alemtuzumab) est un anticorps monoclonal humanisé dérivé de l'ADN recombinant (Campath-1H) dirigé contre la glycoprotéine de surface cellulaire de 21 à 28 kD CD52. Campath-1h est un anticorps Kappa IgG1 avec un cadre variable humain et des régions constantes et des régions de complémentarité éternent un anticorps monoclonal murin (rat) (Campath-1G). L'anticorps Campath-1h a un poids moléculaire approximatif de 150 kD. Campath est produit dans la culture de suspension des cellules mammifères (ovaire de hamster chinois) dans un milieu contenant de la néomycine. La néomycine n'est pas détectable dans le produit final.
Campath est une solution isotonique stérile claire incolore (pH 6,8–7,4) pour l'injection. Chaque flacon à usage unique de Campath contient 30 mg d'aliémtuzumab 8,0 mg de chlorure de sodium 1,44 mg de dibasique phosphate de sodium 0,2 mg de chlorure de potassium 0,2 mg de phosphate de potassium monobasique 0,1 mg de polydrate de polydrat 80 et 0,0187 mg de disodium. Aucun conservateur n'est ajouté.
Utilisations pour Campath
Campath est indiqué comme un seul agent pour le traitement de la leucémie lymphocytaire chronique des cellules B (B-CLL).
Dosage pour Campath
Calendrier et administration de dosage
- Administrer comme une perfusion intraveineuse sur 2 heures. N'administrez pas comme poussée ou bolus intraveineux.
- Régime de dosage recommandé
- Dégénèrent progressivement à la dose unique maximale recommandée de 30 mg. Une escalade est nécessaire au début du dosage ou si le dosage est conservé ≥ 7 jours pendant le traitement. L'escalade à 30 mg peut normalement être accomplie en 3 à 7 jours.
- Stratégie d'escalade
- Administrer 3 mg par jour jusqu'à ce que les réactions liées à la perfusion soient ≤ grade 2 [voir Effets indésirables ].
- Ensuite, administrez 10 mg par jour jusqu'à ce que les réactions liées à la perfusion soient ≤ grade 2.
- Ensuite, administrez 30 mg / jour trois fois par semaine les jours alternatifs (par exemple, le lundi-FRI). La durée totale du traitement, y compris l'escalade de dose, est de 12 semaines.
- Des doses uniques de plus de 30 mg ou des doses cumulatives supérieures à 90 mg par semaine augmentent l'incidence de la pancytopénie.
Médicaments concomitants recommandés
- Prémédica avec la diphenhydramine (50 mg) et l'acétaminophène (500-1000 mg) 30 minutes avant la première perfusion et chaque escalade de dose. Instituer une gestion médicale appropriée (par exemple les glucocorticoïdes épinéphrine meéridine) pour les réactions liées à la perfusion au besoin [voir AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
- Administrer le triméthoprime / sulfaméthoxazole Double résistance (DS) deux fois par jour 3 fois par semaine (ou équivalent) en tant que prophylaxie de pneumocystis jirovecii (PCP).
- Administrer FAMCICLOVER 250 mg Offre ou équivalent comme prophylaxie herpétique.
Continuez la prophylaxie virale PCP et l'herpès pendant au moins 2 mois après la fin de Campath ou jusqu'à ce que le nombre de CD4 soit ≥200 cellules / μl de ce qui se produit plus tard [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Modification de la dose
- Rester Campath lors d'une infection grave ou d'autres effets indésirables graves jusqu'à la résolution.
- Arrêtez Campath pour l'anémie auto-immune ou la thrombocytopénie auto-immune.
- Il n'y a aucune modification de dose recommandée pour la lymphopénie.
Modification de la dose pour la neutropénie ou la thrombocytopénie [voir avertissements et précautions]
| Valeurs hématologiques | Modification de la dose* |
| Anc <250/μL et/or platelet count ≤25000/μL | |
| Pour la première occurrence: | Rester la thérapie Campath. Reprendre Campath à 30 mg lorsque ANC ≥500 / μL et le nombre de plaquettes ≥50000 / μl. |
| Pour la seconde occurrence: | Rester la thérapie Campath. Reprendre Campath à 10 mg lorsque ANC ≥500 / μL et le nombre de plaquettes ≥ 50000 / μl. |
| Pour la troisième occurrence: | Arrêter la thérapie Campath. |
| > 50% de diminution de la ligne de base chez les patients initiant un traitement avec un ANC de base ≤250 / μl et / ou un nombre de plaquettes de base ≤ 25000 / μl | |
| Pour la première occurrence: | Rester la thérapie Campath. Reprendre Campath à 30 mg à retour à la valeur de base. |
| Pour la seconde occurrence: | Rester la thérapie Campath. Reprendre Campath à 10 mg à retour à la valeur de référence. |
| Pour la troisième occurrence: | Arrêter la thérapie Campath. |
| * Si le délai entre le dosage est de ≥ 7 jours d'initier une thérapie à Campath 3 mg et augmente à 10 mg puis à 30 mg comme toléré [voir Posologie et administration ]. |
Préparation et administration
Les médicaments parentéraux doivent être inspectés visuellement pour les particules et la décoloration avant l'administration. Si des particules sont présentes ou si la solution est décolorée, jetez le flacon. Ne secouez pas le flacon.
Utilisez la technique aseptique pendant la préparation et l'administration de Campath. Retirez le montant nécessaire de Campath du flacon dans une seringue.
- Pour préparer la dose de 3 mg, retirer 0,1 ml dans une seringue de 1 ml calibrée par incréments de 0,01 ml.
- Pour préparer la dose de 10 mg, retirer 0,33 ml dans une seringue de 1 ml calibrée par incréments de 0,01 ml.
- Pour préparer la dose de 30 mg, retirer 1 ml dans une seringue de 1 ml ou 3 ml calibrée par incréments de 0,1 ml.
Injecter le contenu de la seringue dans 100 ml de chlorure de sodium stérile à 0,9% ou à 5% de dextrose dans l'USP d'eau. Inversez doucement le sac pour mélanger la solution. Jeter la seringue.
Le flacon ne contient aucun conservateur et est destiné à un usage unique. Jetez le flacon, y compris toute partie inutilisée après le retrait de la dose.
Utiliser dans les 8 heures suivant la dilution. Conserver Campath dilué à température ambiante entre 15 ° C et 30 ° C (59 ° F à 86 ° F) ou réfrigéré à 2 ° C à 8 ° C (36 ° F à 46 ° F). Protéger de la lumière.
Incompatibilités
Campath est compatible avec les sacs de polyvinylchlorure (PVC) et les ensembles d'administration en PVC ou en PVC recordés en polyéthylène. N'ajoutez pas ou n'infusez pas simultanément d'autres substances médicamenteuses par la même ligne intraveineuse.
Comment fourni
Formes et forces posologiques
Injection : 30 mg / 1 ml en tant que solution incolore claire dans du flacon à dose unique
Stockage et manipulation
Campath (Alemtuzumab) est fourni dans du flacon à dose unique en verre transparent contenant 30 mg d'alemtuzumab dans 1 ml de solution. Chaque carton contient trois flacons Campath ( NDC 58468â0357-3) ou un flacon Campath ( NDC 58468-0357-1).
Stockez Campath à 2 ° C à 8 ° C (36 ° F à 46 ° F). Ne congelez pas. S'il est congelé accidentellement, décongelez 2 ° C à 8 ° C avant l'administration. Protéger de la lumière directe du soleil.
Fabriqué et distribué par: Genzyme Corporation Cambridge MA 02142 Numéro de licence américaine: 1596. Révisé: avril 2023
Effets secondaires pour Campath
Les effets indésirables cliniquement significatifs suivants sont discutés plus en détail dans d'autres sections de l'étiquette:
- Cytopénies [see AVERTISSEMENTS AND PRÉCAUTIONS ]
- Réactions liées à la perfusion [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Immunosuppression / infections [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions de réaction indésirables très variables observées dans les essais cliniques d'un médicament ne peuvent pas être directement comparées aux taux dans les essais cliniques d'un autre médicament et ne peuvent pas refléter les taux observés dans la pratique.
Les données ci-dessous reflètent l'exposition à Campath chez 296 patients atteints de LLC dont 147 étaient auparavant non traités et 149 ont reçu au moins 2 schémas de chimiothérapie antérieurs. La durée médiane de l'exposition était de 11,7 semaines pour les patients non traités auparavant et 8 semaines pour les patients précédemment traités.
Les réactions indésirables les plus courantes avec Campath sont les suivantes: réactions liées à la perfusion (pyrexie frissons hypotension urticaire nausée nausea tachycardie dyspnée) cytopénies (neutropénie lymphopénie thrombocytopée anémie) infection (infection des naumea cmv (infection autre infection) symptômes neurologiques (anxiété d'insomnie). Les réactions indésirables graves les plus courantes sont les réactions liées à la perfusion de cytopénies et l'immunosuppression / les infections.
Lymphopénie
Une lymphopénie sévère et une diminution rapide et soutenue des sous-ensembles de lymphocytes se sont produites chez des patients précédemment non traités et traités précédemment après l'administration de Campath. Chez les patients non traités auparavant, le CD4 médian était de 0 cellules / μl à un mois après le traitement et 238 cellules / μl [25% -75% de plage interquartile de 115 à 418 cellules / μl à 6 mois après le traitement [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Neutropénie
Chez les patients non traités auparavant, l'incidence de la neutropénie de grade 3 ou 4 était de 42% avec un temps médian pour apparier 31 jours et une durée médiane de 37 jours. Chez les patients traités précédemment, l'incidence de la neutropénie de grade 3 ou 4 était de 64% avec une durée médiane de 28 jours. Dix pour cent des patients précédemment non traités et 17% des patients précédemment traités ont reçu des facteurs de stimulation des colonies de granulocytes.
acné onexon
Anémie
Chez les patients non traités auparavant, l'incidence de l'anémie de grade 3 ou 4 était de 12% avec un temps médian pour apparier 31 jours et une durée médiane de 8 jours. Chez les patients traités précédemment, l'incidence de l'anémie de grade 3 ou 4 était de 38%. Dix-sept pour cent des patients précédemment non traités et 66% des patients précédemment traités ont reçu soit des transfusions d'agents stimulant l'érythropoïèse, soit les deux.
Thrombocytopénie
Chez les patients non traités auparavant, l'incidence de la thrombocytopénie de grade 3 ou 4 était de 14% avec un délai médian de 9 jours et une durée médiane de 14 jours. Chez les patients traités précédemment, l'incidence de la thrombocytopénie de grade 3 ou 4 était de 52% avec une durée médiane de 21 jours. Une thrombocytopénie auto-immune a été signalée chez 2% des patients précédemment traités avec une mortel.
Réactions liées à la perfusion
Les réactions liées à la perfusion qui comprenaient des frissons de pyrexie hypotension urticaire et dyspnée étaient courantes. La pyrexie de grade 3 et 4 et / ou des frissons se sont produites chez environ 10% des patients précédemment non traités et chez environ 35% des patients précédemment traités. La survenue de réactions liées à la perfusion a été la plus grande au cours de la semaine initiale de traitement et a diminué avec des doses ultérieures de Campath. Tous les patients ont été prétraités avec des antipyrétiques et des antihistaminiques; De plus, 43% des patients précédemment non traités ont reçu un prétraitement des glucocorticoïdes.
Infections
Dans l'étude des patients précédemment non traités, les patients ont été testés chaque semaine pour CMV en utilisant un test PCR de l'initiation jusqu'à la fin du traitement et toutes les 2 semaines pendant les 2 premiers mois suivant le traitement. L'infection au CMV s'est produite dans 16% (23/147) des patients non traités auparavant; Environ un tiers de ces infections étaient graves ou mortelles. Dans les études de patients traités précédemment, dont la surveillance de CMV de routine n'était pas nécessaire à l'infection à CMV a été documentée dans 6% (9/149) des patients; Presque toutes ces infections étaient graves ou mortelles.
D'autres infections ont été rapportées chez environ 50% des patients de toutes les études. La septicémie de grade 3 à 5 variait de 3% à 10% entre les études et était plus élevée chez les patients traités précédemment. La neutropénie fébrile de grade 3 à 4 variait de 5% à 10% entre les études et était plus élevée chez les patients traités précédemment. Les décès liés aux infections se sont produits chez 2% des patients non traités auparavant et 16% des patients précédemment traités. Il y avait 198 épisodes d'autres infections chez 109 patients non traités auparavant; 16% étaient bactériens 7% étaient fongiques 4% étaient d'autres viraux et dans 73%, l'organisme n'a pas été identifié.
Cardiaque
Cardiaque dysrhythmias occurred in approximately 14% of previously untreated patients. The majority were tachycardias et were temporally associated with infusion; dysrhythmias were Grade 3 or 4 in 1% of patients.
Patients non traités auparavant
Le tableau 1 contient des réactions indésirables sélectionnées observées chez 294 patients randomisés (1: 1) pour recevoir Campath ou Chlorambucil comme traitement de première ligne pour B-CLL. Campath a été administré à une dose de 30 mg par voie intraveineuse trois fois par semaine jusqu'à 12 semaines. La durée médiane du traitement était de 11,7 semaines avec une dose hebdomadaire médiane de 82 mg (25% à 75% de plage interquartile: 6990 mg).
Tableau 1: Par incidence du patient des réactions indésirables sélectionnées dans le traitement des patients naïfs B-CLL
| Campath (n = 147) | Chlorambucil (n = 147) | ||||
| Toutes les notes †% | 3e à 4% | Tous les niveaux | 3e à 4% | ||
| Troubles du système sanguin et lymphatique | Lymphopénie | 97 | 97 | 9 | 1 |
| Neutropénie | 77 | 42 | 51 | 26 | |
| Anémie | 76 | 13 | 54 | 18 | |
| Thrombocytopénie | 71 | 13 | 70 | 14 | |
| Troubles généraux et conditions du site d'administration | Pyrexie | 69 | 10 | 11 | 1 |
| Frissons | 53 | 3 | 1 | 0 | |
| Infections et Infestations | CMV Viremia ‡ | 55 | 4 | 8 | 0 |
| Infection au CMV | 16 | 5 | 0 | 0 | |
| Autres infections | 74 | 21 | 65 | 10 | |
| Troubles de la peau et des tissus sous-cutanés | Urticaire | 16 | 2 | 1 | 0 |
| Éruption cutanée | 13 | 1 | 4 | 0 | |
| Érythème | 4 | 0 | 1 | 0 | |
| Troubles vasculaires | Hypotension | 16 | 1 | 0 | 0 |
| Hypertension | 14 | 5 | 2 | 1 | |
| Troubles du système nerveux | Mal de tête | 14 | 1 | 8 | 0 |
| Tremblement | 3 | 0 | 1 | 0 | |
| Troubles thoraciques et médiastinaux respiratoires | Dyspnée | 14 | 4 | 7 | 3 |
| Troubles gastro-intestinaux | Diarrhée | 10 | 1 | 4 | 0 |
| Troubles psychiatriques | Insomnie | 10 | 0 | 3 | 0 |
| Anxiété | 8 | 0 | 1 | 0 | |
| Cardiaque Disorders | Tachycardie | 10 | 0 | 1 | 0 |
| * Réactions indésirables se produisant à une fréquence relative plus élevée dans le bras Campath † NCI CTC version 2.0 pour les effets indésirables; NCI CTCAE Version 3.0 pour les valeurs de laboratoire ‡ La virémie CMV (sans preuve de symptômes) comprend les deux cas de résultats de test PCR positifs et de virémie CMV confirmée (≥ 2 occasions dans des échantillons consécutifs à 1 semaine d'intervalle). Pour ce dernier, le ganciclovir (ou équivalent) a été initié par protocole. |
Patients traités précédemment
Des informations de sécurité supplémentaires ont été obtenues à partir de 3 études à ARM unique de 149 patients précédemment traités avec la LLC administrée 30 mg Campath par voie intraveineuse trois fois par semaine pendant 4 à 12 semaines (dose cumulative médiane 673 mg [plage 2-1106 mg]; durée médiane du traitement 8,0 semaines). Les effets indésirables de ces études non énumérés dans le tableau 1 qui se sont produit à un taux d'incidence> 5% étaient la fatigue de nausées de nausées vomissement musculo-squelettique anorexie dysesthésie mucite et bronchospasme.
Immunogénicité
Comme pour toutes les protéines thérapeutiques, il existe un potentiel d'immunogénicité. L'incidence de la formation d'anticorps dépend fortement de la sensibilité et de la spécificité du test. De plus, l'incidence observée de l'anticorps (y compris les anticorps neutralisants) dans un test peut être influencée par plusieurs facteurs, notamment la méthodologie du test, le moment de la gestion des échantillons de médicaments concomitants de collecte d'échantillons et la maladie sous-jacente. Pour ces raisons, la comparaison de l'incidence des anticorps avec l'incidence des anticorps avec d'autres produits d'alemtuzumab peut être trompeuse.
En utilisant un test ELISA, des anticorps anti-humains (HAHA) ont été détectés chez 11 des 133 (8,3%) de patients non traités auparavant. De plus, deux patients étaient faiblement positifs pour la neutralisation de l'activité. Des données limitées suggèrent que les anticorps anti-campathes n'ont pas affecté négativement la réponse tumorale. Quatre des 211 (1,9%) patients traités précédemment se sont avérés avoir des anticorps contre Campath après le traitement.
Expérience de commercialisation de la poste
Campath
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Campath. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Troubles généraux et conditions du site d'administration: Réactions mortelles liées à la perfusion.
Troubles cardiovasculaires: La cardiomyopathie de l'insuffisance cardiaque congestive a diminué la fraction d'éjection (certains patients avaient déjà été traités avec des agents cardiotoxiques).
Troubles cérébrovasculaires: AVC de dissection artérielle cervicocephale, y compris les AVC hémorragiques et ischémiques.
Troubles gastro-intestinaux: Cholécystite acalculeuse aiguë.
Troubles du système immunitaire: Syndrome de Goodpasture Anemie aplasique Anémie Guillain-Barré Syndrome chronique inflammatoire inflammatoire Polyradiculoneuropathie Sénuté du sérum Terfusion mortelle du greffon associé à la maladie de l'hôte Lymphohistiocytose de la maladie hémophagocytaire (HLH).
Infections: Infection par le virus d'Epstein-Barr (EBV) Infection à leucoencéphalopathie multifocale progressive (PML) Réactivation des virus latents.
Métabolisme et troubles nutritionnels: Syndrome de lyse tumorale.
Néoplasmes: Trouble lymphoprolifératif associé à l'EBV.
Troubles du système nerveux: Neuropathie optique.
Troubles rénaux et urinaires: Néphropathies glomérulaires.
Autres produits Alemtuzumab
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation d'un autre produit Alemtuzumab. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Troubles endocriniens: Hypothyroïdie hyperthyroïdie et thyroïdite.
Troubles du système nerveux: Encéphalite auto-immune.
Interactions médicamenteuses pour Campath
Aucune étude officielle d'interaction médicamenteuse n'a été réalisée avec Campath.
Avertissements pour Campath
Inclus dans le cadre du PRÉCAUTIONS section.
Précautions pour Campath
Cytopénies
Une anémie auto-immune mortelle et une thrombocytopénie et une myélosuppression prolongée ont été signalées chez les patients recevant Campath.
De plus, l'anémie hémolytique pure aplasie de la moelle osseuse de l'aplasie et de l'hypoplasie ont été signalées après un traitement avec Campath à la dose recommandée. Les doses uniques de Campath supérieures à 30 mg ou des doses cumulatives supérieures à 90 mg par semaine augmentent l'incidence de la pancytopénie.
Rester Campath pour les cytopénies sévères (sauf la lymphopénie). Arrêter les cytopénies auto-immunes ou les cytopénies sévères récurrentes / persistantes (sauf la lymphopénie) [voir Posologie et administration ]. No data exist on the safety of Campath resumption in patients with autoimmune cytopenias or marrow aplasia [see Effets indésirables ].
Obtenez des numéros sanguins complets (CBC) à des intervalles hebdomadaires pendant la thérapie Campath et plus fréquemment si l'aggravation de l'anémie neutropénie ou thrombocytopénie se produit. Évaluer le nombre de CD4 après le traitement jusqu'à la récupération à ≥ 200 cellules / μl [voir Posologie et administration et Effets indésirables ].
Quel est un autre nom pour Seroquel
Réactions liées à la perfusion
Les effets indésirables survenant pendant ou peu de temps après la perfusion de campath comprennent les frissons / rigueurs de pyrexie nausée hypotension urticaire dyspnée vomissement éruption cutanée et bronchospasme [voir Effets indésirables ]. In clinical trials the frequency of infusion-related reactions was highest in the first week of treatment. Monitor for the signs et symptoms listed above et withhold infusion for Grade 3 or 4 infusion-related reactions.
Le grave suivant, y compris les réactions mortelles liés à la perfusion, a été identifiée dans les rapports post-commercialisation: Syncope Pulmonary Infiltrates Syndrome de détresse respiratoire aiguë (SDRA) Arrythmies cardiaques respiratoires Infarctus du myocarde aiguë Angioémat de l'arrestation cardiaque et anaphylactoïde.
Initier Campath en fonction du système d'escalade de dose recommandé [voir Posologie et administration ]. Premedicate patients with an antihistamine et acetaminophen prior to each dose. Institute appropriate medical management (e.g. glucocorticoids epinephrine meperidine) for infusion-related reactions as needed [see Posologie et administration ]. If therapy is interrupted for 7 or more days reinstitute Campath with gradual dose escalation [see Posologie et administration ].
Immunosuppression / infections
Campath treatment results in severe et prolonged lymphopenia with a concomitant increased incidence of opportunistic infections [see Effets indésirables ]. Administer PCP et herpes viral prophylaxis during treatment with Campath et for a minimum of 2 months after completion of Campath or until the CD4+ count is ≥200 cells/μL whichever occurs later [see Posologie et administration ]. Prophylaxis does not eliminate these infections.
Surveillez régulièrement les patients pour l'infection à CMV pendant le traitement par Campath et pendant au moins 2 mois après la fin de Campath. Rester Campath pour des infections graves et pendant le traitement antiviral pour l'infection par le CMV ou la virémie CMV confirmée (définie comme une réaction en chaîne par polymérase [PCR] CMV positif dans ≥ 2 échantillons consécutifs obtenus à 1 semaine d'intervalle). Initier le ganciclovir thérapeutique (ou équivalent) pour l'infection par le CMV ou la virémie CMV confirmée.
L'infection par le virus d'Epstein-Barr (EBV), y compris une hépatite sévère et mortelle associée à l'EBV, a été signalée chez des patients qui ont reçu Campath.
Surveiller les signes et les symptômes des infections à l'EBV. Rester Campath pour la réactivation de l'EBV ou une infection sévère.
Administrer uniquement les produits sanguins irradiés pour éviter la transfusion du greffon associé par rapport à la maladie de l'hôte (TAGVHD) à moins que des circonstances émergentes ne dictent une transfusion immédiate.
Chez les patients qui ont reçu CAMPATH, car le traitement initial du traitement de CD4 compte à ≥ 200 cellules / μl s'est produit d'ici 6 mois après la fin de Campath; Cependant, à 2 mois après le traitement, la médiane était de 183 cellules / μl. Chez les patients traités précédemment qui ont reçu Campath, le temps médian de récupération du nombre de CD4 à ≥ 200 cellules / μl était de 2 mois; Cependant, la récupération complète (à la base de référence) des dénombrements CD4 et CD8 peut prendre plus de 12 mois [voir Effets indésirables ].
Immunisation
La sécurité de l'immunisation avec des vaccins viraux vivants après la thérapie CAMPATH n'a pas été étudié. N'administrez pas les vaccins viraux vivants aux patients ou aux nourrissons nés de patients recevant Campath. La capacité de générer une réponse immunitaire à tout vaccin après le traitement Campath n'a pas été étudiée.
Toxicologie non clinique
Carcinogenèse Mutagenèse A trouble de la fertilité
Des études pour évaluer le potentiel cancérigène ou génotoxique de Campath n'ont pas été menées.
Dans les études de fertilité, l'alemtuzumab (3 ou 10 mg / kg par voie intraveineuse) a été administré à des souris mâles transgéniques HUCD52 pendant 5 jours consécutifs avant la cohabitation avec des femelles de type sauvage non traitées. Aucun effet sur la fertilité ou les performances de reproduction n'a été observée. Cependant, les effets néfastes sur les paramètres du sperme (y compris la morphologie anormale [détachés / sans tête] et la réduction du nombre total et de la motilité) ont été observés aux deux doses testées.
Lorsque l'alemtuzumab (3 ou 10 mg / kg par voie intraveineuse) a été administré à des souris femelles transgéniques HUCD52 pendant 5 jours consécutifs avant la cohabitation avec des mâles de type sauvage non traités, il y a eu une diminution du nombre moyen de sites de division de la lutéa et d'une augmentation de la perte postale.
Utiliser dans des populations spécifiques
Grossesse
Résumé des risques
Sur la base des résultats des études animales, Campath peut causer des dommages fœtaux lorsqu'il est administré à une femme enceinte. Les données disponibles des études de cohorte publiées chez les femmes enceintes sont insuffisantes pour établir un risque associé à CAMPATH de malformations congénitales majeures ou les résultats défavorables maternels ou fœtaux. L'alemtuzumab était embryolethal chez les souris transgéniques HUCD52 enceintes lorsqu'il était administré pendant l'organogenèse (voir Données ). Les anticorps IgG humains sont connus pour traverser la barrière placentaire; Par conséquent, Campath peut être transmis de la mère au fœtus en développement. Conseiller les femmes du risque potentiel pour le fœtus. Les nourrissons nés de femmes enceintes traitées avec Campath peuvent être à risque accru d'infection (voir Considérations cliniques ).
Le risque de fond de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnue. Toutes les grossesses présentent un risque de fond de perte de maltraitance natale ou d'autres résultats indésirables. Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est respectivement de 2% à 4% et 15% à 20%.
Considérations cliniques
Réactions indésirables fœtales / néonatales
Les anticorps monoclonaux sont transportés à travers le placenta à mesure que la grossesse progresse avec la plus grande quantité transférée au cours du troisième trimestre. Considérez les risques et les avantages de l'administration de vaccins en direct ou atténués aux nourrissons exposés à Campath in utero [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Données
Données sur les animaux
Lorsque l'alemtuzumab a été administré à des souris transgéniques HUCD52 enceintes pendant l'organogenèse (jours de gestation [GD] 6-10 ou GD 11-15) à des doses intraveineuses de 3 ou 10 mg / kg, aucun effet tératogène n'a été observé. Cependant, il y a eu une augmentation de l'embryolethalité (augmentation de la perte post-implantation et le nombre de barrages avec tous les fœtus morts ou résorbés) chez les animaux enceintes dosés pendant GD 11-15. Dans une étude distincte dans l'administration de souris transgéniques HUCD52 enceinte d'allemtuzumab pendant l'organogenèse (GD 6-10 ou GD 11-15) à des doses intraveineuses de 3 ou 10 mg / kg, des diminutions des lymphocytes B et des populations de lychocytes T ont été observées dans les deux doses.
Chez les souris transgéniques enceintes HUCD52, a administré de l'aliémtuzumab à des doses intraveineuses de 3 ou 10 mg / kg / jour tout au long de la gestation et de la lactation, il y a eu une augmentation des décès de chiots pendant la période de lactation à 10 mg / kg. Des diminutions des populations de lymphocytes T et de lymphocytes B et dans la réponse des anticorps ont été observées chez la progéniture aux deux doses testées.
Lactation
Résumé des risques
Il n'y a pas de données sur la présence d'alemtuzumab dans les effets du lait maternel sur la production de lait ou l'enfant allaité. Les effets de l'exposition gastro-intestinale locale et de l'exposition systémique limitée chez le nourrisson allaité à l'alemtuzumab sont inconnus. L'allemtuzumab a été détecté dans le lait de souris transgéniques HUCD52 allaitée administrée d'altuzumab (voir Données ). Maternal IgG is known to be present in human milk et when a drug is present in animal milk it is likely that the drug will be present in human milk.
En raison du potentiel de réactions indésirables graves de Campath chez un enfant allaité, notamment le nombre de lymphocytes réduits, conseille aux femmes allaitées de ne pas allaiter pendant le traitement avec Campath et pendant au moins 3 mois après la dernière dose.
Données
L'allemtuzumab a été détecté dans le lait de souris transgéniques HUCD52 allaitant après l'administration intraveineuse d'alemtuzumab à une dose de 10 mg / kg les jours post-partum 8-12. Les taux sériques d'alemtuzumab étaient similaires chez les souris allaitantes et la progéniture le jour 13 post-partum et étaient associés à des preuves d'activité pharmacologique (diminution du nombre de lymphocytes) chez la progéniture.
Femmes et mâles de potentiel reproducteur
Campath may cause embryo-fetal harm when administered to pregnant women [see Utiliser dans des populations spécifiques ].
Grossesse Testing
Grossesse testing is recommended for females of reproductive potential prior to initiating Campath therapy.
Contraception
Femelles
Conseiller les patientes femelles de potentiel reproducteur pour utiliser une contraception efficace pendant le traitement avec Campath et pendant au moins 3 mois après la dernière dose.
Infertilité
Sur la base des résultats des études animales, l'alemtuzumab peut nuire à la fertilité chez les femmes et les hommes de potentiel reproductif [voir Toxicologie non clinique ]. The reversibility of the effect on fertility is unknown.
Quel type de laxatif est Senna
Usage pédiatrique
La sécurité et l'efficacité de Campath n'ont pas été établies chez les patients pédiatriques.
Utilisation gériatrique
Sur 147 patients B-CLL non traités auparavant traités par Campath, 35% étaient ≥ 65 ans et 4% étaient ≥ 75 ans. Sur 149 patients précédemment traités avec B-CLL, 44% étaient âgés de ≥65 ans et 10% avaient ≥ 75 ans. Les études cliniques de Campath ne comprenaient pas un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. D'autres expériences cliniques signalées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes.
Informations sur la surdose pour Campath
Dans toute l'expérience clinique, la dose maximale signalée reçue était de 90 mg. Les infections à l'aplasie de la moelle osseuse ou des réactions liées à la perfusion sévères se sont produites chez les patients qui ont reçu une dose plus élevée que recommandée.
Un patient qui a reçu une dose de 80 mg a connu une toux de bronchospasme aigu et une dyspnée, suivie de l'anurie et de la mort. Un autre patient a reçu deux doses de 90 mg par voie intraveineuse à un jour d'intervalle au cours de la deuxième semaine de traitement et a connu un début rapide de l'apasie de la moelle osseuse.
Il n'y a pas d'antidote spécifique connu pour le surdosage Campath. Arrêtez Campath et fournissez une thérapie de soutien.
Contre-indications pour Campath
Aucun.
Pharmacologie clinique for Campath
Mécanisme d'action
Campath binds to CD52 an antigen present on the surface of B et T lymphocytes a majority of monocytes macrophages NK cells et a subpopulation of granulocytes. A proportion of bone marrow cells including some CD34+ cells express variable levels of CD52. The proposed mechanism of action is antibody-dependent cellular-mediated lysis following cell surface binding of Campath to the leukemic cells.
Pharmacodynamique
Cardiaque Electrophysiology
L'effet de doses multiples d'alemtuzumab (12 mg / jour pendant 5 jours) sur l'intervalle QTC a été évalué dans une étude à bras unique chez 53 patients sans tumeurs malignes. Aucun changement important dans l'intervalle QTC moyen (c'est-à-dire> 20 ms) n'a été détecté dans l'étude. Une augmentation moyenne de la fréquence cardiaque de 22 à 26 battements / min a été observée pendant au moins 2 heures après la perfusion initiale d'alemtuzumab. Cette augmentation de la fréquence cardiaque n'a pas été observée avec des doses ultérieures.
Les effets secondaires les plus courants de Zoloft
Pharmacocinétique
Campath pharmacokinetics were characterized in a study of 30 previously treated B-CLL patients in whom Campath was administered at the recommended dose et schedule. After 12 weeks of dosing patients exhibited a 7-fold increase in mean AUC.
Distribution
Après la dernière dose de 30 mg, le volume moyen de distribution à l'état d'équilibre était de 0,18 L / kg (plage de 0,1 à 0,4 L / kg).
Élimination
Campath pharmacokinetics displayed nonlinear elimination kinetics. Systemic clearance decreased with repeated administration due to decreased receptor-mediated clearance (i.e. loss of CD52 receptors in the periphery). Mean half-life was 11 hours (range 2 to 32 hours) after the first 30 mg dose et was 6 days (range 1 to 14 days) after the last 30 mg dose.
Populations spécifiques
Les effets des troubles rénaux ou hépatiques sur la pharmacocinétique de Campath n'ont pas été étudiés.
Études cliniques
Patients B-CLL non traités auparavant
Campath was evaluated in an open-label retomized (1:1) active-controlled study in previously untreated patients with B-CLL Rai Stage I-IV with evidence of progressive disease requiring therapy. Patients received either Campath 30 mg intravenously 3 times per week for a maximum of 12 weeks or chlorambucil 40 mg/m² orally once every 28 days for a maximum of 12 cycles.
Sur les 297 patients randomisés, l'âge médian était de 60 ans, 72% étaient des hommes 99% étaient du Caucasien 96% avaient un statut de performance de l'OMS 0-1 23% avait un diamètre de ganglions lymphatiques maximum ≥ 5 cm 34% étaient RAI de stade III / IV et 8% ont été traités aux États-Unis.
Les patients randomisés pour recevoir Campath ont connu une survie sans progression plus longue (PFS) par rapport à celles randomisées pour recevoir du chlorambucil (PFS médiane 14,6 mois contre 11,7 mois respectivement). Les taux de réponse globaux étaient de 83% et 55% (P <0.0001) et the complete response rates were 24% et 2% (p <0.0001) for Campath et chlorambucil arms respectively. The Kaplan-Meier curve for PFS is shown in Figure 1.
Figure 1: survie libre de progression chez les patients B-CLL non traités précédemment *
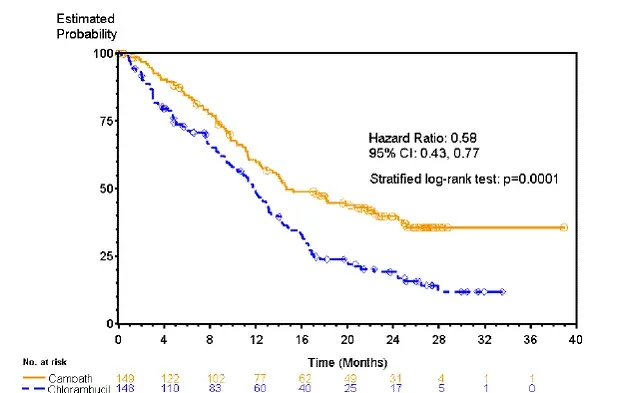 |
* Test de log-rank ajusté pour le stade RAI (I-II vs III-IV).
Patients B-CLL traités précédemment
Campath was evaluated in three multicenter open-label single-arm studies of 149 patients with B-CLL previously treated with alkylating agents fludarabine or other chemotherapies. Patients were treated with the recommended dose of Campath 30 mg intravenously 3 times per week for up to 12 weeks. Partial response rates of 21% to 31% et complete response rates of 0% to 2% were observed.
Informations sur les patients pour Campath
Cytopénies
Conseiller aux patients de signaler tout signe ou symptôme tel que saigner des ecchymoses faciles de Petechiae ou de la faiblesse ou de la fatigue de la pâleur [voir [voir AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
Réactions liées à la perfusion
Conseiller les patients des signes et symptômes des réactions liées à la perfusion et de la nécessité de prendre des prémédifications comme prescrit [voir AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
Immunosuppression / infections
Conseiller aux patients de signaler immédiatement les symptômes de l'infection (par exemple la pyrexie) et de prendre des anti-infectives prophylactiques pour le PCP (triméthoprime / sulfaméthoxazole DS ou équivalent) et pour le virus de l'herpès (famciclovir ou équivalent) comme prescrit [voir AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
Conseiller les patients que l'irradiation des produits sanguins est nécessaire [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Immunisation
Conseillez les patients qu'ils ne devraient pas être immunisés avec des vaccins viraux vivants s'ils ont récemment été traités avec Campath. Conseiller les femmes avec des nourrissons exposés à Campath in Utero pour informer le pédiatre de l'exposition [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Toxicité embryo-fœtale
Conseiller les femmes enceintes et les femmes du potentiel reproducteur du risque potentiel pour un fœtus. Conseiller aux femmes d'informer leur fournisseur de soins de santé d'une grossesse connue ou suspectée [voir Utiliser dans des populations spécifiques ].
Conseiller les patientes féminines de potentiel reproducteur pour utiliser une contraception efficace pendant le traitement avec Campath et pendant 3 mois après la dose finale [voir Utiliser dans des populations spécifiques ].
Lactation
Conseiller les femmes de ne pas allaiter pendant le traitement avec Campath et pendant 3 mois après la dose finale [voir Utiliser dans des populations spécifiques ].
Infertilité
Conseiller les femmes et les hommes de potentiel reproducteur que Campath peut nuire à la fertilité [voir Utiliser dans des populations spécifiques et Toxicologie non clinique ].
Néphropathies glomérulaires
Conseiller les patients sur les signes et symptômes de néphropathies glomérulaires qui peuvent survenir des mois à des années après avoir reçu Campath [voir Effets indésirables ].