Tezspire
Les Informations Présentées Sur Ce Site Ne Constituent Pas Un Avis Médical. Nous Ne Vendons Rien. L'Exactitude De La Traduction N'Est Pas Garantie. Clause De Non-Responsabilité
Résumé
Qu'est-ce que Tezspire?
Tezspire (tezepelumab-ekko) est un bloqueur thymique stromal de lymphopoïétine (TSLP) humain anticorps monoclonal (IgG2λ) indiqué pour le traitement d'entretien complémentaire des patients adultes et pédiatriques âgés de 12 ans et plus avec sévère asthme
Quels sont les effets secondaires de Tezspire?
Tezspire
- urticaire
- difficulté à respirer
- gonflement de ton visage lèvres langue ou gorge
- étourdissements sévères
- éruption cutanée et
- Red irrité ou démangeaisons les yeux
Obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires de Tezspire comprennent:
- mal de gorge
- douleurs articulaires
- maux de dos et
- Réactions du site d'injection (gonflement de la rougeur et douleur).
Cherchez des soins médicaux ou appelez le 911 à la fois si vous avez les effets secondaires graves suivants:
- Des symptômes oculaires graves tels que la perte de vision soudaine floue du tunnel de vision de la vision de la vision des yeux ou de l'enflure ou de voir des halos autour des lumières;
- Symptômes cardiaques graves tels que les battements cardiaques rapides ou battants; flotter dans votre poitrine; essoufflement; Et des étourdissements soudains étourdissement ou s'évanouir;
- Maux de tête sévères Confusion Slurred Speech Bras ou Ligne Proulitude Trouble de la merde Perte de coordination Sentiment des muscles très rigides très rigides Fièvre élevée Propice ou des tremblements.
Ce document ne contient pas tous les effets secondaires possibles et d'autres peuvent survenir. Vérifiez auprès de votre médecin des informations supplémentaires sur les effets secondaires.
Dosage pour Tezspire
La dose recommandée de Tezspire est administrée de 210 mg une fois toutes les 4 semaines.
Tezspire chez les enfants
La sécurité et l'efficacité de TezSpire pour le traitement d'entretien complémentaire de l'asthme grave ont été établies chez des patients pédiatriques âgés de 12 ans et plus.
La sécurité et l'efficacité de TezSpire chez les patients de moins de 12 ans n'ont pas été établies.
Quelles substances ou suppléments de médicaments interagissent avec Tezspire?
Tezspire peut interagir avec d'autres médicaments.
Dites à votre médecin tous les médicaments et suppléments que vous utilisez.
Tezspire pendant la grossesse et l'allaitement
Dites à votre médecin si vous êtes enceinte ou prévoyez de tomber enceinte avant d'utiliser Tezspire; On ne sait pas si cela affecterait un fœtus. On ne sait pas si Tezspire passe dans le lait maternel. Tezspire est un anticorps monoclonal humain immunoglobuline G2λ (IgG2λ) et l'immunoglobuline G (IgG) sont présents dans le lait maternel en petites quantités. Consultez votre médecin avant l'allaitement.
Informations Complémentaires
Notre injection Tezspire (Tezepelumab-Ekko) pour un centre de médicaments à effet secondaire à usage sous-cutané offre une vue complète des informations sur les médicaments disponibles sur les effets secondaires potentiels lors de la prise de ce médicament.
Informations sur les médicaments de la FDA
- Description de la drogue
- Indications
- Effets secondaires
- Avertissements
- Surdosage
- Pharmacologie clinique
- Guide des médicaments
Description de Tezspire
Tezepelumab-ekko Un bloqueur thymique stromal de la lymphopoïétine (TSLP) est un immunoglobuline G2λ (IgG2λ) en anticorps monoclonal humain produit dans les cellules d'ovaire du hamster chinois (CHO) par la technologie d'ADN recombinant. Tezepelumab-ekko a un poids moléculaire d'environ 147 kDa.
L'injection de Tezspire (Tezepelumab-Ekko) est une solution stérile sans conservateur transparent à opalescent à une solution jaune clair pour l'injection sous-cutanée fournie dans une seringue pré-remplie de flacon ou à dose unique.
Chaque seringue de flacon ou pré-remplie à dose unique délivre 1,91 ml contenant 210 mg d'acide glaciaire de tézepelumab-ekko (2,8 mg) de la L-proline (48 mg) polysorbate 80 (0,19 mg) d'hydroxyde de sodium et d'eau pour l'injection. Le pH est de 5,2.
Utilisations pour TezSpire
Tezspire est indiqué pour le traitement d'entretien complémentaire des patients adultes et pédiatriques âgés de 12 ans et plus souffrant d'asthme sévère.
Limitations d'utilisation
Tezspire n'est pas indiqué pour le soulagement du bronchospasme aigu ou du statut asthmaticus.
Dosage pour Tezspire
Dosage recommandé
La dose recommandée de Tezspire est administrée de 210 mg par voie sous-cutanée une fois toutes les 4 semaines.
Informations de dose manquées
Si une dose est manquée, administrez la dose dès que possible. Par la suite, le patient peut continuer (reprendre) le dosage le jour de l'administration habituel. Si la dose suivante est déjà due, administrez comme prévu.
Instructions de préparation et d'administration
Le flacon Tezspire et la seringue pré-remplie sont destinés à l'administration par un fournisseur de soins de santé.
Le stylo pré-rempli Tezspire peut être administré par des patients / soignants ou des prestataires de soins de santé. Les patients / soignants peuvent administrer un stylo pré-rempli Tezspire après une formation appropriée en technique d'injection sous-cutanée et après que le fournisseur de soins de santé le juge approprié.
Chaque seringue pré-remplie de flacon et stylo pré-rempli contiennent une seule dose de Tezspire.
- Avant l'administration, retirez Tezspire du réfrigérateur et laissez-le atteindre la température ambiante. Cela prend généralement 60 minutes. Ne pas exposer à la chaleur et ne pas secouer. N'utilisez pas si le sceau de sécurité sur le carton a été brisé. Ne remettez pas dans le réfrigérateur une fois que Tezspire a atteint la température ambiante.
- Inspectez visuellement Tezspire pour les particules et la décoloration avant l'administration. Tezspire est une solution claire à opalescent incolore à jaune clair. N'utilisez pas Tezspire si le liquide est décoloré ou s'il contient de grandes particules ou des particules étrangères. N'utilisez pas si la seringue pré-remplie du flacon ou le stylo pré-rempli a été abandonné ou endommagé ou si la date d'expiration s'est écoulée.
- Injectez Tezspire 210 mg (contenu d'une seringue pré-remplie de flacon ou d'un stylo pré-rempli comme décrit ci-dessous) par voie sous-cutanée dans la cuisse ou l'abdomen à l'exception des 2 pouces (5 cm) autour du nombril. Si un fournisseur de soins de santé ou un soignant administre l'injection, le bras supérieur peut également être utilisé. Un patient ne doit pas s'auto-injecter dans le haut du bras. Tezspire ne doit pas être injecté dans les zones où la peau est érythémateuse ou durcie Il est recommandé de faire tourner le site d'injection à chaque injection.
Instructions d'administration pour une seringue pré-remplie à dose
Reportez-vous à la figure 1 pour identifier les composants de seringue pré-remplis à utiliser dans les étapes d'administration. Ne retirez pas le couvercle de l'aiguille avant l'étape 2 de ces instructions lorsque vous êtes prêt à injecter Tezspire. Ne touchez pas les clips d'activation de la garde d'aiguille pour empêcher l'activation prématurée du garde de la sécurité des aiguilles.
Figure 1: composants de seringue pré-rempli Tezspire
Avant utilisation
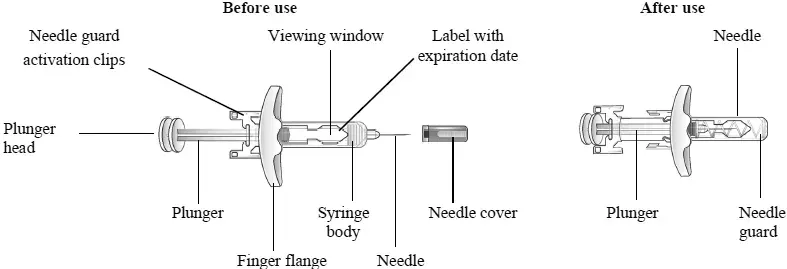 |
Après utilisation
 |
La seringue pré-remplie peut contenir de petites bulles d'air; C'est normal. N'expulsez pas les bulles d'air avant l'administration.
 |
 |
 |
 |
- Saisissez le corps de la seringue pour éliminer la seringue pré-remplie de son plateau. Ne prenez pas la seringue pré-remplie par le piston.
- Ne retirez pas le couvercle de l'aiguille avant l'injection. Tenez le corps de la seringue et retirez le couvercle de l'aiguille en retirant directement. Ne tenez pas la tête de piston ou de piston tout en retirant le couvercle de l'aiguille. Vous pouvez voir une goutte de liquide au bout de l'aiguille. C'est normal.
- Pincez doucement la peau et administrez par voie sous-cutanée à environ 45 ° d'angle dans le site d'injection recommandé (c'est-à-dire la cuisse ou l'abdomen du bras supérieur).
- Injectez tous les médicaments en poussant le piston jusqu'à ce que la tête de piston soit complètement entre les clips d'activation du garde d'aiguille. Ceci est nécessaire pour activer le garde d'aiguille.
- Après l'injection, maintenez la pression sur la tête du piston et retirez l'aiguille de la peau. Libérez la pression sur la tête du piston pour permettre au gardien d'aiguille de couvrir l'aiguille. Ne pas redéfinir la seringue pré-remplie.
- Jeter la seringue utilisée dans un conteneur des objets tranchants.
Instructions d'administration pour un stylo pré-rempli à dose
Ces instructions d'administration sont destinées aux prestataires de soins de santé uniquement. Les patients et les soignants doivent se référer au stylo pré-rempli Tezspire «Instructions pour une utilisation» pour des instructions plus détaillées sur la préparation et l'administration du stylo pré-rempli Tezspire [voir Instructions pour une utilisation ].
Les patients / soignants peuvent injecter après une formation appropriée dans la technique d'injection sous-cutanée en fonction des «instructions d'utilisation» et après que le prestataire de soins de santé le juge approprié.
Reportez-vous à la figure 2 pour identifier les composants du stylo pré-remplis à utiliser dans les étapes d'administration.
Ne supprimez pas le capuchon tant que vous n'êtes pas prêt à injecter TezSpire.
Figure 2 Composants du stylo pré-rempli Tezspire
Avant utilisation
 |
Après utilisation
 |
Le stylo pré-rempli peut contenir de petites bulles d'air; C'est normal. N'expulsez pas les bulles d'air avant l'administration.
Injectez Tezspire en suivant les étapes du site d'injection recommandé (c'est-à-dire la cuisse ou l'abdomen du bras supérieur).
Lors de l'injection, vous entendrez le premier clic qui vous indique que l'injection a commencé. Appuyez et maintenez le stylo pré-rempli pendant 15 secondes jusqu'à ce que vous entendiez le deuxième clic. Ne modifiez pas la position du stylo pré-rempli après le début de l'injection.
- Prenez le milieu du corps du stylo pré-rempli pour retirer le stylo pré-rempli de son plateau.
- Ne retirez pas le capuchon avant l'injection. Tenez le corps du stylo pré-rempli avec 1 main et retirez soigneusement le capuchon droit avec votre autre main. Ne touchez pas l'aiguille et ne poussez pas le garde d'aiguille orange avec votre doigt. Ne remettez pas le capuchon sur le stylo pré-rempli. Vous pouvez faire en sorte que l'injection se produise trop tôt ou endommager l'aiguille.
- Pincez doucement la peau sur le site d'injection ou donnez l'injection sans pincer la peau.
- Positionner le stylo pré-rempli. Placer le garde d'aiguille orange à plat contre la peau (angle à 90 degrés). Assurez-vous que vous pouvez voir la fenêtre de visualisation.
- Appuyez fermement jusqu'à ce que vous ne puissiez pas voir le garde d'aiguille orange. Vous entendrez le premier «cliquez», ce qui vous indique que l'injection a commencé. Le piston orange se déplacera dans la fenêtre de visualisation pendant l'injection.
- Tenez fermement pendant environ 15 secondes. Vous entendrez un deuxième «cliquez», ce qui vous indique que l'injection est terminée. Le piston orange remplira la fenêtre de visualisation.
- Après avoir terminé l'injection, soulevez le stylo pré-rempli tout droit. Le garde d'aiguille orange glissera vers le bas et se verrouille en place sur l'aiguille.
- Jeter le stylo pré-rempli utilisé dans un conteneur des objets tranchants.
Comment fourni
Formes et forces posologiques
Injection : Une solution claire à opalescent incolore à jaune clair disponible comme:
- 210 mg / 1,91 ml (110 mg / ml) dans un flacon de verre à dose unique.
- 210 mg / 1,91 ml (110 mg / ml) dans une seringue pré-remplie à dose unique.
- 210 mg / 1,91 ml (110 mg / ml) dans un stylo pré-rempli à dose unique.
Tezspire (Tezepelumab-ekko) L'injection est une solution stérile sans conservateur transparent à opalescent à une solution jaune claire fournie comme une seringue pré-remplie de flacon à dose unique avec une aiguille fixe 27 de calibre ½ pouce avec un couvercle à aiguille ou une boîte à pré-remplie à dose avec une aiguille de ½ pouce à aiguille fixe avec une couverture d'aiguille. La seringue pré-remplie du flacon et le stylo pré-rempli, y compris le couvercle et le bouchon à l'aiguille, ne sont pas faits avec du latex en caoutchouc naturel.
Tezspire est disponible comme:
- Flacon à dose unique: le carton contient un flacon de verre de 210 mg / 1,91 ml (110 mg / ml) ( NDC 55513-100-01)
- Syringe pré-remplie à dose: Carton contient une seringue pré-remplie de 210 mg / 1,91 ml (110 mg / ml) ( NDC 55513-112-01)
- Pen pré-remplie à dose: Carton contient un stylo pré-rempli de 210 mg / 1,91 ml (110 mg / ml) ( NDC 55513-12301)
Stockage et manipulation
Conserver le réfrigérateur entre 36 ° F à 46 ° F (2 ° C à 8 ° C). Si nécessaire, Tezspire peut être maintenu à température ambiante entre 68 ° F à 77 ° F (20 ° C à 25 ° C) pendant un maximum de 30 jours. Ne remettez pas dans le réfrigérateur une fois que Tezspire a atteint la température ambiante. Après le retrait du réfrigérateur, Tezspire doit être utilisé dans les 30 jours ou jeté.
Stockez Tezspire dans le carton d'origine pour protéger de la lumière jusqu'au temps d'utilisation.
Ne congelez pas. Ne secouez pas. N'exposez pas à la chaleur.
Fabriqué par: AstraZeneca AB Sodentalje Suède. Révisé: mai 2023
Effets secondaires pour Tezspire
Les effets indésirables cliniquement significatifs suivants sont décrits ailleurs dans l'étiquetage:
- Réactions d'hypersensibilité [voir Avertissements et précautions ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions de réaction indésirables très variables observées dans les essais cliniques d'un médicament ne peuvent pas être directement comparées aux taux dans les essais cliniques d'un autre médicament et ne peuvent pas refléter les taux observés dans la pratique.
La sécurité de Tezspire était basée sur la population de sécurité regroupée de Pathway et Navigator qui se compose de 665 patients adultes et pédiatriques de 12 ans et plus avec un asthme grave qui a reçu au moins une dose de Tezspire 210 mg par voie sous-cutanée une fois toutes les 4 semaines. Les deux essais cliniques contrôlés par placebo étaient de 52 semaines. De plus, un profil de sécurité similaire a été observé dans un essai qui a inscrit 150 patients adultes souffrant d'asthme grave qui avait besoin d'un traitement avec des corticostéroïdes oraux quotidiens [voir Études cliniques ].
Les réactions indésirables qui se sont produites à une incidence supérieure ou égale à 3% et plus courantes que dans le groupe placebo de la population de sécurité regroupée (voie et navigateur) sont présentées dans le tableau 1.
Tableau 1 Réactions indésirables avec TezSpire avec une incidence supérieure ou égale à 3% et plus courante que le placebo chez les patients souffrant d'asthme sévère dans la population de sécurité groupée (voie et navigateur)
| Réaction indésirable | Tezspire N = 665 % | Placebo N = 669 % |
| Pharyngite* | 4 | 3 |
| Arthralgie | 4 | 3 |
| Maux de dos | 4 | 3 |
| * Pharyngite (y compris la pharyngite pharyngite pharyngite bactérienne pharyngite streptococcique et virale) |
Réactions indésirables spécifiques
Événements cardiovasculaires
Dans un essai d'extension à long terme randomisé à long terme, les patients de 12 ans et plus souffrant d'asthme sévère de l'essai Navigator et de l'essai supplémentaire [voir Études cliniques ] a reçu Tezspire 210 mg par voie sous-cutanée toutes les 4 semaines ou un placebo pendant 104 semaines. Dans l'essai, les taux d'incidence (IR) pour 100 patients-années (PY) pour les événements indésirables cardiaques graves chez les patients traités avec TezSpire ou le placebo étaient respectivement de 1,08 et 0,21 avec une différence de taux d'incidence (IRD) de 0,88 (IC à 95%: 0,24 1,53). Les types d'événements indésirables cardiaques graves étaient hétérogènes. Dans l'essai, l'IR pour 100 py pour les événements cardiovasculaires indésirables majeurs jugés (mace définis comme des décès cardiovasculaires des infarctus du myocarde non mortel et des traits non mortels) chez les patients traités avec Tezspire ou un placebo étaient respectivement de 0,60 et 0,42 avec un IRD de 0,18 (ICI 95%: 0,51 0,75).
Injection Site Reactions
Dans la population de sécurité regroupée (voie et navigateur) dans laquelle Tezspire ou placebo a été administré en utilisant le flacon par un site d'injection de prestataires de soins de santé (par exemple, le site d'injection du site d'érythème gonflant le site d'injection du site d'injection) s'est produit à un taux de 3,3% chez les patients traités avec TEZSpire comparés à 2,7% chez les patients traités avec PlaceBo.
Dans un essai ouvert de 216 patients souffrant d'asthme dans lesquels TezSpire a été administré par des prestataires de soins de santé et des patients ou des soignants en utilisant le stylo pré-rempli ou des réactions de site d'injection de seringue préfiplue (par exemple, le site d'injection du site d'injection érythème en utilisant le site d'injection gonflable) a été observée chez 5,7% de patients en utilisant le fil pré-plié et 0% en utilisant le site préfabriqué du Syring. Cependant, l'essai n'a pas été conçu pour comparer les réactions du site d'injection entre les patients qui ont reçu TezSpire par le stylo pré-rempli par rapport à la seringue pré-remplie.
Expérience de commercialisation de la poste
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Tezspire. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Réactions d'hypersensibilité: anaphylaxie
Interactions médicamenteuses pour Tezspire
Aucune étude formelle d'interaction médicamenteuse n'a été réalisée avec Tezspire.
Avertissements pour Tezspire
Inclus dans le cadre du 'PRÉCAUTIONS' Section
Précautions pour Tezspire
Réactions d'hypersensibilité
Des réactions d'hypersensibilité ont été observées dans les essais cliniques (par exemple, éruption cutanée et conjonctivite allergique) après l'administration de TezSpire. Des cas d'anaphylaxie postale ont également été signalés [voir Contre-indications et Effets indésirables ]. These reactions can occur within hours of administration but in some instances have a delayed onset (i.e. days). In the event of a hypersensitivity reaction consider the benefits et risks for the individual patient to determine whether to continue or discontinue treatment with Tezspire.
Symptômes aigus de l'asthme ou détérioration de la maladie
Tezspire should not be used to treat acute asthme symptoms or acute exacerbations. Ne pas use Tezspire to treat acute bronchospasm or status asthmeticus. Patients should seek medical advice if their asthme remains uncontrolled or worsens after initiation of treatment with Tezspire.
Risque associé à une réduction brutale de la dose de corticostéroïdes
N'arrêtez pas brusquement les corticostéroïdes systémiques ou inhalés lors de l'initiation de la thérapie avec Tezspire. Les réductions de la dose de corticostéroïdes, le cas échéant, doivent être progressives et effectuées sous la supervision directe d'un médecin. La réduction de la dose de corticostéroïdes peut être associée à des symptômes de sevrage systémique et / ou à des conditions de démasquer précédemment supprimées par la corticothérapie systémique.
Infection parasite (helminthe)
La lympoïétine stromale thymique (TSLP) peut être impliquée dans la réponse immunologique à certaines infections aux helminthes. Les patients présentant des infections connues d'helminthe ont été exclus de la participation à des essais cliniques. On ne sait pas si Tezspire influencera la réponse d'un patient contre les infections aux helminthes.
Traitez les patients atteints d'infections d'hélminthes préexistantes avant de lancer un traitement avec TezSpire. Si les patients deviennent infectés lors de la réception du traitement par Tezspire et ne répondent pas au traitement anti-helminthe arrêtent le traitement avec TezSpire jusqu'à ce que l'infection ne résout.
Vaccins atténués en direct
L'utilisation concomitante des vaccins TezSpire et Live atténué n'a pas été évaluée. L'utilisation de vaccins atténués vivants doit être évité chez les patients recevant Tezspire.
Informations de conseil des patients
Conseillez au patient et / ou au soignant de lire l'étiquetage des patients approuvé par la FDA ( Informations sur les patients et Instructions pour une utilisation ).
Réactions d'hypersensibilité
Informer les patients que les réactions d'hypersensibilité (par exemple une éruption cutanée d'anaphylaxie et une conjonctivite allergique) peuvent survenir après l'administration de TezSpire [voir Contre-indications et Effets indésirables ]. These reactions can occur within hours of administration but in some instances have a delayed onset (i.e. days). Instruct patients to contact their healthcare provider if they experience symptoms of an allergic reaction [see Avertissements et précautions ].
Pas pour des symptômes aigus ou une détérioration de la maladie
Informez les patients que Tezspire ne traite pas les symptômes d'asthme aigus ou les exacerbations aiguës. Informer les patients pour consulter un médecin si leur asthme reste incontrôlé ou s'aggrave après le début du traitement avec Tezspire [voir Avertissements et précautions ].
Risque associé à une réduction brutale de la dose de corticostéroïdes
Informer les patients de ne pas interrompre les corticostéroïdes systémiques ou inhalés, sauf sous la supervision directe d'un fournisseur de soins de santé. Informer les patients que la réduction de la dose de corticostéroïdes peut être associée à des symptômes de sevrage systémique et / ou à des conditions de démasquer précédemment supprimées par la corticothérapie systémique [voir Avertissements et précautions ].
Administration des vaccins
Demandez aux patients d'informer le fournisseur de soins de santé qu'ils prennent Tezspire avant une vaccination potentielle [voir Avertissements et précautions ].
Stockage et élimination appropriés
Conseiller aux patients de réfrigérer TezSpire à 36 ° F à 46 ° F (2 ° C à 8 ° C). Tezspire peut être maintenu à température ambiante entre 68 ° F à 77 ° F (20 ° C à 25 ° C) pendant un maximum de 30 jours [voir Comment fourni ]. Inform patients et caregivers of the need for proper disposal of the pre-filled pen after use including the use of a récipient d'élimination des oblexes.
Toxicologie non clinique
Carcinogenèse Mutagenèse A trouble de la fertilité
Les études animales n'ont pas été menées pour évaluer le potentiel cancérigène de Tezepelumab-Ekko. Le risque de malignité chez l'homme d'un anticorps qui bloque le ligand TSLP tel que Tezepelumab-Ekko est actuellement inconnu.
La fertilité masculine et féminine n'a pas été affectée sur la base de non-résultats histopathologiques défavorables observés dans les organes reproducteurs et aucun changement dans le cycle menstruel ou l'analyse du sperme dans des singes de cynomolgus sexuellement matures qui ont reçu le tezepelumab-ekko pendant 26 semaines à des doses sous-cutanées jusqu'à 300 mg / kg / semaine (approximativement 134 fois la MRHD sur un AUC).
Utiliser dans des populations spécifiques
Grossesse
Résumé des risques
Il n'y a pas de données disponibles sur l'utilisation de TezSpire chez les femmes enceintes pour évaluer tout risque associé aux médicaments de malformations congénitales majeures ou d'autres résultats défavorables maternels ou fœtaux. Le transfert placentaire des anticorps monoclonaux tels que Tezepelumab-Ekko est plus élevé au cours du troisième trimestre de la grossesse; Par conséquent, les effets potentiels sur un fœtus sont susceptibles d'être plus élevés au cours du troisième trimestre de la grossesse. Dans une étude améliorée de développement pré-et postnatal (EPPND) mené dans le transport placentaire de singes cynomolgus de tezepelumab-ekko a été observé, mais il n'y avait aucune preuve de dommages fœtaux après l'administration intraveineuse de tezepelumab-ekko tout au long administré par voie sous-cutanée (voir Données ).
Le risque de fond estimé des principaux malformations congénitales et fausses couches pour la population indiquée est inconnue. Toutes les grossesses présentent un risque de fond de perte de maltraitance natale ou d'autres résultats indésirables. Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est respectivement de 2% à 4% et 15% à 20%.
Considérations cliniques
Risque maternel et / ou embryonnaire / fœtal associé à la maladie:
Chez les femmes présentant des preuves d'asthme mal ou modérément contrôlées, démontre qu'il existe un risque accru de prééclampsie chez la mère et de prématurité faible poids à la naissance et petit pour l'âge gestationnel chez le nouveau-né. Le niveau de contrôle de l'asthme doit être étroitement surveillé chez les femmes enceintes et le traitement ajusté comme nécessaire pour maintenir un contrôle optimal.
Données
Données sur les animaux
Dans l'étude EPPND, les singes Cynomolgus enceintes ont reçu le tezepelumab-ekko de GD20 à GD22 (en fonction de la détermination de la grossesse) au début de l'organogenèse et une fois tous les 7 jours jusqu'à la fin de la gestation à des doses qui ont produit des expositions allant jusqu'à 168 fois les DOS de MRH (sur une semaine. Il n'y avait pas d'effets indésirables liés à Tezepelumab-Ekko sur les résultats de la grossesse en santé maternelle pour le développement des embryons-foetal ou la croissance et le développement néonatals jusqu'à 6,5 mois. Tezepelumab-Ekko a traversé le placenta dans les singes de Cynomolgus et les concentrations sériques de Tezepelumab-Ekko étaient de 0,5 à 6,7 fois chez les nourrissons par rapport aux animaux maternels.
Lactation
Résumé des risques
Il n'y a aucune information concernant la présence de tezepelumab-ekko dans le lait maternel ses effets sur le nourrisson allaité ou ses effets sur la production de lait. Cependant, Tezepelumab-Ekko est un anticorps monoclonal humain immunoglobuline G2λ (IgG2λ) et l'immunoglobuline G (IgG) est présente dans le lait maternel en petites quantités. Tezepelumab-ekko était présent dans le lait des singes Cynomolgus post-partum après le dosage pendant la grossesse (voir Données ). The developmental et health benefits of breastfeeding should be considered along with the mother's clinical need for Tezspire et any potential adverse effects on the breastfed infant from Tezspire or from the underlying maternal condition.
Données
Données sur les animaux
Dans une étude de développement prénatal et postnatal dans Cynomolgus Monkeys Tzepelumab-Ekko dans le lait représentait jusqu'à 0,5% des concentrations de sérum maternel après l'administration intraveineuse de tezepelumab-ekko jusqu'à 300 mg / kg / semaine (168 fois les expositions basées sur l'AUC ont eu la MRHD). La concentration de tezepelumab-ekko dans le lait animal ne prédit pas nécessairement la concentration de médicament dans le lait maternel.
Usage pédiatrique
La sécurité et l'efficacité de Tezspire pour le traitement d'entretien complémentaire de l'asthme sévère ont été établies chez des patients pédiatriques âgés de 12 ans et plus [voir Effets indésirables et Études cliniques ]. Use of Tezspire for this indication is supported by evidence from a total of 82 pediatric patients aged 12 to 17 years enrolled in NAVIGATEUR et received treatment with Tezspire 210 mg subcutaneously every 4 weeks (n=41) or placebo (n=41). Compared with placebo improvements in annualized asthme exacerbation (rate ratio 0.70; 95% CI 0.34 1.46) et FEV1 (Changement moyen LS versus placebo 0,17 L; IC à 95% -0,01 0,35) ont été observés chez les patients pédiatriques traités par TezSpire. Le profil de sécurité et les réponses pharmacodynamiques chez les patients pédiatriques étaient généralement similaires à la population globale de l'étude.
La sécurité et l'efficacité des patients de moins de 12 ans n'ont pas été établies.
Utilisation gériatrique
Sur les 665 patients souffrant d'asthme traités avec TezSpire dans des essais cliniques (voie et navigateur) pour l'asthme sévère 119 patients (18%) étaient de 65 ans ou plus. Aucune différence globale de sécurité ou d'efficacité de Tezspire n'a été observée entre les patients de 65 ans et les patients plus âgés et les plus jeunes [voir Effets indésirables et Études cliniques ].
Informations sur la surdose pour Tezspire
Aucune information fournie
Contre-indications pour Tezspire
Tezspire is contraindicated in patients who have known hypersensitivity to tezepelumab-ekko or any of its excipients [see Avertissements et précautions ].
Pharmacologie clinique for Tezspire
Mécanisme d'action
Tezepelumab-ekko est un bloqueur thymique de la lympoïétine stromale (TSLP) anticorps monoclonal humain IgG2λ qui se lie au TSLP humain avec une constante de dissociation de 15,8 pm et bloque son interaction avec le récepteur hétérodimère du TSLP. Le TSLP est une cytokine principalement dérivée des cellules épithéliales et occupe une position en amont dans la cascade inflammatoire de l'asthme.
L'inflammation des voies respiratoires est un élément important de la pathogenèse de l'asthme. Les types de cellules multiples (par exemple les mastocytes d'éosinophiles neutrophiles macrophages lymphocytes ILC2 cellules) et les médiateurs (par exemple les cytokines des eicosanoïdes histamines leucotriènes) sont impliquées dans l'inflammation des voies respiratoires. Le blocage du TSLP avec Tezepelumab-Ekko réduit les biomarqueurs et les cytokines associés à une inflammation, notamment les éosinophiles sanguins, les éosinophiles sous-muqueux Ige Feno IL-5 et IL-13; Cependant, le mécanisme de l'action Tezepelumab-Ekko dans l'asthme n'a pas été définitivement établi.
Pharmacodynamique
Dans l'administration de navigateur de Tezspire 210 mg par voie sous-cutanée toutes les 4 semaines (n = 528), les éosinophiles sanguins réduits comptent la concentration de FENO IL-5 et la concentration d'IL-13 par rapport à la ligne de base par rapport au placebo (n = 531) avec un début de l'effet 2 semaines après l'initiation du traitement et une réduction soutenue sur le traitement à 52 semaines. Tezspire a provoqué une réduction lente mais progressive de la concentration totale d'IgE sérique tout au long de 52 semaines de traitement. Des effets similaires ont été observés dans la voie.
Pharmacocinétique
La pharmacocinétique de Tezepelumab-Ekko était proportionnelle à la dose après l'administration d'une dose sous-cutanée unique sur une dose de 2,1 mg à 420 mg (0,01 à 2 fois la dose recommandée). Avec un régime de dosage toutes les 4 semaines, Tezepelumab-Ekko atteint l'état d'équilibre après 12 semaines et le rapport d'accumulation pour Ctrough est de 1,86 fois.
Absorption
Après l'administration sous-cutanée, la concentration sérique maximale a été atteinte dans environ 3 à 10 jours. Sur la base de l'analyse pharmacocinétique de la population, la biodisponibilité absolue estimée était d'environ 77%. Il n'y avait pas de différence cliniquement pertinente de biodisponibilité lorsqu'il était administré à différents sites d'injection (cuisse de l'abdomen ou haut du bras).
Distribution
Sur la base de l'analyse pharmacocinétique de la population, le volume central et périphérique de distribution de tezepelumab-ekko était respectivement de 3,9 L et 2,2 L pour un individu de 70 kg.
Élimination
En tant qu'anticorps monoclonal humain, Tezepelumab-Ekko est éliminé par le catabolisme intracellulaire et il n'y a aucune preuve de clairance à médiation cible dans la plage de dose étudiée. Sur la base de l'analyse pharmacocinétique de la population, la clairance estimée pour Tezepelumab-Ekko était de 0,17 L / J pour un individu de 70 kg. La demi-vie d'élimination était d'environ 26 jours.
Métabolisme
Tezepelumab-Ekko est un anticorps monoclonal humain (IgG2λ) qui est dégradé par des enzymes protéolytiques largement distribuées dans le corps et non métabolisées par des enzymes hépatiques.
Populations spécifiques
Race sexuelle d'âge
Sur la base de l'analyse pharmacocinétique de la population, l'âge (12 à 80 ans) sexe et race (Noir blanc autre) n'a eu aucun effet cliniquement significatif sur la pharmacocinétique de Tezepelumab-Ekko.
Poids corporel
Sur la base de l'analyse pharmacocinétique de la population, un poids corporel plus élevé était associé à une plus faible exposition. Cependant, l'effet du poids corporel sur l'exposition n'a eu aucun impact significatif sur l'efficacité ou la sécurité et ne nécessite pas d'ajustement de la dose.
Patients souffrant de troubles rénaux
Aucune étude clinique formelle n'a été menée pour étudier l'effet de la déficience rénale sur Tezepelumab-Ekko. L'analyse pharmacocinétique de la population comprenait 320 (23%) sujets présentant une insuffisance rénale légère et 38 (3%) sujets présentant une insuffisance rénale modérée. La clairance de Tezepelumab-Ekko était similaire chez les patients présentant une insuffisance rénale légère (autorisation de créatinine estimée de 60 à 89 ml / min) une insuffisance rénale modérée (autorisation estimée de créatinine 30 à 59 ml / min) et celles ayant une fonction rénale normale (autorisation estimée de créatinine ≥ 90 ml / min). Tezepelumab-ekko n'a pas été étudié chez des patients atteints de troubles rénaux sévères (autorisation de créatinine estimée <30 mL/min).
Patients souffrant de déficience hépatique
Aucune étude clinique formelle n'a été menée pour étudier l'effet de la déficience hépatique sur Tezepelumab-Ekko. Étant donné que le tezepelumab-ekko est dégradé par des enzymes protéolytiques largement réparties dans le corps et non métabolisées par le changement des enzymes spécifiques hépatiques dans la fonction hépatique ne devrait pas influencer la clairance de Tezepelumab-Ekko.
Études d'interaction médicamenteuse
Aucune étude formelle d'interaction médicamenteuse n'a été menée avec Tezepelumab-Ekko. Sur la base de l'analyse pharmacocinétique de la population, des médicaments d'asthme à l'asthme (antagoniste des récepteurs leucotriènes de la théophylline / aminophylline orale et du corticostéroïde inhalé) n'ont eu aucun effet cliniquement significatif sur la clairance du tezepelumab-ekko.
Immunogénicité
L'incidence observée des anticorps anti-drogue dépend fortement de la sensibilité et de la spécificité du test. Les différences dans les méthodes de test empêchent des comparaisons significatives de l'incidence des anticorps anti-drogue dans les études décrites ci-dessous avec l'incidence des anticorps anti-drogue dans d'autres études, y compris celles de Tezepelumab-Ekko ou d'autres produits Tezepelumab.
Dans Navigator et un essai supplémentaire anticorps anti-drogue (ADA) ont été détectés à tout moment dans 29 (5%) sur 601 patients qui ont reçu TezSpire au régime de dosage recommandé au cours de la période d'étude de 48 à 52 semaines. Sur ces 29 patients, 11 patients (2% des patients traités par TezSpire) ont développé des anticorps émergents au traitement et 1 patient (<1% of patients treated with Tezspire) developed neutralizing antibodies. ADA titers were generally low et often transient. No evidence of ADA impact on pharmacokinetics pharmacodynamics efficacy or safety was observed.
Études cliniques
L'efficacité de TezSpire a été évaluée dans deux essais cliniques contrôlés parallèles en double aveugle randomisés (Pathway [NCT02054130] et Navigator [NCT03347279]) de 52 semaines. Les deux essais ont recruté un total de 1609 patients âgés de 12 ans et plus souffrant d'asthme sévère.
Pathway était un essai d'exacerbation de 52 semaines qui a inscrit 550 patients adultes souffrant d'asthme sévère qui ont reçu un traitement avec Tezepelumab-Ekko 70 mg par voie subcutanée toutes les 4 semaines Tezspire 210 mg par voie subcutanée toutes les 4 semaines Tezepelumab-Ekko 280 mg sous-cutanée toutes les 2 semaines ou placebo-sous-cutanée. Les patients devaient avoir des antécédents de 2 exacerbations d'asthme ou plus nécessitant un traitement corticostéroïde oral ou injectable ou 1 exacerbation d'asthme entraînant une hospitalisation au cours des 12 derniers mois.
Navigator était un essai d'exacerbation de 52 semaines qui a inscrit 1061 patients (patients adultes et pédiatriques âgés de 12 ans et plus) atteints d'asthme sévère qui ont reçu un traitement avec Tezspire 210 mg par voie sous-cutanée toutes les 4 semaines ou un placebo par voie sous-cutanée toutes les 4 semaines. Les patients devaient avoir des antécédents de 2 exacerbations d'asthme ou plus nécessitant un traitement corticostéroïde oral ou injectable ou entraînant une hospitalisation au cours des 12 derniers mois.
Dans la voie des voies et des patients Navigator, devaient avoir un score de questionnaire 6 (ACQ-6) (ACQ-6) de 1,5 ou plus au dépistage et réduit la fonction pulmonaire au départ [pré-bronchodilatateur forcé le volume expiratoire en 1 seconde (FEV FEV1) En moins de 80%, prévu chez les adultes et inférieur à 90% prévu chez les adolescents]. Les patients devaient être sous traitement régulier avec des corticostéroïdes inhalés à dose moyenne ou élevée (CI) et au moins un contrôleur d'asthme supplémentaire avec ou sans corticostéroïdes oraux (OC). Les patients ont continué le traitement de l'asthme tout au long de la durée des essais. Dans les deux essais, les patients ont été inscrits sans nécessiter un niveau de base minimum d'éosinophiles sanguins ou de FENO.
La démographie et les caractéristiques de base de la voie et du navigateur sont fournies dans le tableau 2 ci-dessous.
Tableau 2 Démographie et caractéristiques de base des patients dans la voie et le navigateur
| CHEMIN N = 550 | NAVIGATEUR N = 1059 | |
| Âge moyen (année) (SD) | 52 (12) | 50 (16) |
| Femelle (%) | 66 | 64 |
| Blanc (%) | 92 | 62 |
| Noir ou afro-américain (%) | 3 | 6 |
| Asiatique (%) | 3 | 28 |
| Hispanique ou Latino (%) | 1 | 15 |
| Jamais fumé (%) | 81 | 80 |
| Utilisation de CI à forte dose (%) | 49 | 75 |
| Utilisation des OC (%) | 9 | 9 |
| Nombre moyen d'exacerbations l'année précédente (SD) | 2.4 (1.2) | 2.8 (1.4) |
| Durée moyenne de l'asthme (années) (SD) | 17 (12) | 22 (16) |
| Le% de référence moyen prévu FEV1 (SD) | 60 (13) | 63 (18) |
| Moyen post-bronchodilatateur FEV1 réversibilité (%) (SD) | 23 (20) | 15 (15) |
| Nombre d'EOS de sang de base moyen (cellules / μL) (SD) | 371 (353) | 340 (403) |
| IgE spécifique au sérum positif à tout allergène pérenne (%) * | 46 | 64 |
| Fellow Mean (PPB) (SD) | 35 (39) | 44 (41) |
| * Dans le panneau Feia Eos eosinophiles; Immunodosage enzymatique fluorescent FEIA; Feno fractionnaire exhalé oxyde nitrique; FEV1 Volume expiratoire forcé en une seconde; Immunoglobuline IgE corticostéroïde inhalée ICS; OCS corticostéroïde oral; pièces PPB par milliard; Écart type SD. |
Les résultats résumés ci-dessous sont pour le Tezspire recommandé 210 mg par voie sous-cutanée toutes les 4 semaines de dose.
Exacerbations
Le critère d'évaluation principal pour la voie et le navigateur était le taux d'exacerbations cliniquement significatifs de l'asthme mesurés sur 52 semaines. Les exacerbations cliniquement significatives de l'asthme ont été définies comme une aggravation de l'asthme nécessitant l'utilisation ou l'augmentation des corticostéroïdes oraux ou injectables pendant au moins 3 jours ou une seule dépo-injection de corticostéroïdes et / ou d'hospitalisation nécessitant une utilisation par voie orale ou injectable de corticostéroïdes et / ou d'hospitalisation.
Dans la voie des voies et des patients Navigator recevant Tezspire, des réductions significatives du taux annualisé des exacerbations de l'asthme par rapport au placebo. Il y avait également moins d'exacerbations nécessitant des visites aux urgences et / ou une hospitalisation chez les patients traités par Tezspire par rapport au placebo (tableau 3).
Tableau 3 Taux d'exacerbations cliniquement significatives sur 52 semaines dans la voie et le navigateur
| Procès | Traitement | Exacerbations per year | |
| Taux | Taux Ratio (95% CI) | ||
| Taux d'exacerbation annulalisé de l'asthme | |||
| CHEMIN | Tezspire (N=137) | 0.20 | 0,29 (0,16 0,51) |
| Placebo (N=138) | 0.72 | ||
| NAVIGATEUR | Tezspire (N=528) | 0.93 | 0,44 (0,37 0,53) |
| Placebo (N=531) | 2.10 | ||
| Exacerbations requiring emergency room visit/hospitalization | |||
| CHEMIN | Tezspire (N=137) | 0.03 | 0,15 (0,04 0,58) |
| Placebo (N=138) | 0.18 | ||
| NAVIGATEUR | Tezspire (N=528) | 0.06 | 0,21 (0,12 0,37) |
| Placebo (N=531) | 0.28 | ||
| Exacerbations requiring hospitalization | |||
| CHEMIN | Tezspire (N=137) | 0.02 | 0,14 (0,03 0,71) |
| Placebo (N=138) | 0.14 | ||
| NAVIGATEUR | Tezspire (N=528) | 0.03 | 0,15 (0,07 0,22) |
| Placebo (N=531) | 0.19 |
Chez Navigator, les patients recevant Tezspire ont connu moins d'exacerbations que celles recevant un placebo, quels que soient les niveaux de base d'éosinophiles sanguins ou de FENO (figure 3). Des résultats similaires ont été observés dans la voie.
Figure 3 Ratio de taux d'exacerbation d'asthme annualisé sur 52 semaines dans différents biomarqueurs de base de Navigator
Le délai de première exacerbation était plus long pour les patients recevant TezSpire par rapport au placebo dans le navigateur (figure 4). Des résultats similaires ont été observés dans la voie.
Figure 4 Courbes d'incidence cumulative de Kaplan-Meier pour le temps pour la première exacerbation dans Navigator
Fonction pulmonaire
Changement de la ligne de base en FEV1 a été évalué comme critère d'évaluation secondaire dans Pathway et Navigator. Par rapport au placebo Tezspire a fourni des améliorations cliniquement significatives dans le changement moyen par rapport à la ligne de base en FEV1 dans les deux essais (tableau 4).
Tableau 4 Changement moyen par rapport à la référence dans le FEV pré-bronchodilatateur1 À la fin du procès dans Pathway et Navigator *
| Procès | Traitement | LS MANGE CHANGE DE LA VOIE (L) | Différence par rapport au placebo (IC à 95%) |
| CHEMIN | Tezspire (N=133)† | 0.08 | 0,13 (0,03 0,23) |
| Placebo (N=138)† | -0.06 | ||
| NAVIGATEUR | Tezspire (N=527)† | 0.23 | 0,13 (0,08 0,18) |
| Placebo (N=531)† | 0.10 | ||
| * Semaine 52 dans la semaine de la semaine 52 à Navigator †Nombre de patients contribuant à l'analyse complète (FA) avec au moins 1 changement par rapport à la valeur de base |
Dans l'amélioration du navigateur en FEV1 a été vu dès 2 semaines après le début du traitement et a été maintenu pendant la semaine 52 (figure 5).
Figure 5 Changement moyen (IC à 95%) de la ligne de base dans le FEV pré-bronchodilator1 (L) dans Navigator
Résultats du patient signalé
Les changements par rapport à la référence dans le questionnaire de contrôle de l'asthme 6 (ACQ-6) et le questionnaire standardisé de la qualité de vie de l'asthme pour les 12 ans et plus [aqlq (s) 12] ont également été évalués comme des critères d'évaluation secondaires dans Pathway et Navigator. Dans les deux essais, plus de patients traités par TezSpire par rapport au placebo ont connu une amélioration cliniquement significative de l'ACQ-6 et de l'AQLQ (s) 12. Une amélioration cliniquement significative (taux de répondeur) pour les deux mesures a été définie comme une amélioration du score de 0,5 ou plus à la fin de l'essai. Dans Navigator, le taux de répondeur ACQ-6 pour TezSpire était de 86% contre 77% pour le placebo (OR = 1,99; IC à 95% 1,43 2,76) et le taux de répondeur AQLQ (S) 12 pour TezSpire était 78% par rapport à 72% pour le placebo (OR = 1,36; 95% IC 1,02 1,82). Des résultats similaires ont été observés dans la voie.
Essai supplémentaire
Dans un essai clinique randomisé en double aveugle parallèle contrôlé par placebo, l'effet de TezSpire (210 mg par voie sous-cutanée toutes les 4 semaines) sur la réduction de l'utilisation des OC de maintenance a été évalué. L'essai a inscrit 150 patients adultes souffrant d'asthme sévère qui a eu besoin d'un traitement avec des OC quotidiens (7,5 mg à 30 mg par jour) en plus de l'utilisation régulière de CI à haute dose et d'une longueur bêta-agoniste avec ou sans contrôleur (s) supplémentaire (s). Le critère d'évaluation principal a été classé en pourcentage de réduction par rapport à la référence de la dose finale OCS à la semaine 48 (réduction ≥90% ≥ 75% à <90% reduction ≥50% pour <75% reduction>0% pour <50 reduction et no change or no decrease in OCS) while maintaining asthme control. Tezspire did not demonstrate a statistically significant reduction in maintenance OCS dose compared with placebo (cumulative OR=1.28; 95% CI 0.69 2.35).
Informations sur les patients pour Tezspire
Tezspire®
(Tez-Spy-is)
(tezepelumab-ekko) Injection pour une utilisation sous-cutanée
Qu'est-ce que Tezspire?
Tezspire is a prescription medicine used with other asthme medicines for the maintenance treatment of severe asthme in people 12 years of age et older whose asthme is not controlled with their current asthme medicine.
Tezspire helps prevent severe asthme attacks (exacerbations) et can improve your breathing.
Tezspire is not used to treat sudden problèmes de respiration. Tell your healthcare provider if your asthme does not get better or if it gets worse after you start treatment with Tezspire.
On ne sait pas si Tezspire est sûr et efficace chez les enfants de moins de 12 ans.
N'utilisez pas Tezspire si vous:
- sont allergiques à Tezepelumab-Ekko ou à l'un des ingrédients de Tezspire. Voir la fin de cette notice d'information du patient pour une liste complète des ingrédients dans Tezspire.
Avant d'utiliser Tezspire, dites à votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous:
- ont déjà eu une réaction allergique sévère (hypersensibilité).
- avoir une infection parasite (helminthe).
- ont récemment reçu ou devraient recevoir des vaccinations atténuées en direct. Les personnes qui reçoivent Tezspire ne devraient pas recevoir de vaccins atténués en direct.
- sont enceintes pensent que vous pourriez être enceinte ou que vous prévoyez de devenir enceinte. On ne sait pas si Tezspire peut nuire à votre bébé à naître.
- allaitent ou prévoient d'allaiter. On ne sait pas si Tezspire passe dans votre lait maternel. Parlez à votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé si vous utilisez Tezspire.
Parlez à votre fournisseur de soins de santé de tous les médicaments que vous prenez y compris les médicaments sur ordonnance et en vente libre des vitamines et des suppléments à base de plantes.
Ne pas Changez ou arrêtez vos médicaments corticostéroïdes ou autres médicaments contre l'asthme à moins que votre professionnel de la santé ne vous le dise.
Comment dois-je utiliser Tezspire?
- Voir les instructions détaillées pour une utilisation fournies avec un stylo pré-rempli Tezspire pour des informations sur la façon de préparer et d'injecter Tezspire.
- Utilisez TezSpire exactement comme prescrit par votre fournisseur de soins de santé.
- Tezspire is injected under your skin (subcutaneously) 1 time every 4 weeks.
- Tezspire comes in a single-dose vial in a single-dose pre-filled syringe et in a single-dose pre-filled pen.
- Votre fournisseur de soins de santé peut vous injecter avec TezSpire dans un cadre de soins de santé.
- Si votre fournisseur de soins de santé décide que vous ou un soignant pouvez donner les injections de Tezspire, vous ou votre soignant, vous devez recevoir une formation sur la bonne façon de préparer et d'injecter le stylo pré-rempli à dose unique de Tezspire.
- Ne pas Essayez d'injecter Tezspire jusqu'à ce que vous ayez montré de la bonne manière par votre fournisseur de soins de santé.
- Si vous manquez une dose, injectez une dose dès que possible. Après cela, vous pouvez continuer à utiliser Tezspire le jour de l'injection habituel. Si vous n'avez pas remarqué que vous avez manqué une dose tant qu'il n'est pas temps pour votre prochaine dose prévue, sautez la dose manquée et injectez la prochaine dose prévue comme prévu. Ne pas Injectez plus d'une dose en une journée. Si vous avez des questions sur quand injecter Tezspire, contactez votre fournisseur de soins de santé.
Quels sont les effets secondaires possibles de Tezspire?
Tezspire may cause serious side effects including:
- Réactions allergiques (hypersensibilité), y compris l'anaphylaxie. Des réactions allergiques graves peuvent se produire après avoir obtenu votre injection Tezspire. Les réactions allergiques peuvent parfois se produire des heures ou des jours après avoir obtenu une dose de Tezspire. Appelez votre fournisseur de soins de santé ou obtenez des soins médicaux d'urgence si vous obtenez l'un des symptômes suivants de réaction allergique:
- éruption cutanée
- urticaire
- gonflement de votre visage bouche et langue
- problèmes de respiration
- Des démangeaisons rouges gonflées ou enflammées
- évanouissement les étourdissements se sentant étourdis
Les effets secondaires les plus courants de Tezspire comprennent:
- mal de gorge (pharyngite)
- douleurs articulaires (arthralgia)
- maux de dos
Ce ne sont pas tous les effets secondaires possibles de Tezspire.
Appelez votre médecin pour des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Informations générales sur l'utilisation sûre et efficace de Tezspire
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une brochure d'information du patient. N'utilisez pas Tezspire pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas Tezspire à d'autres personnes même s'ils présentent les mêmes symptômes que vous. Cela peut leur faire du mal. Vous pouvez demander à votre pharmacien ou fournisseur de soins de santé pour des informations sur Tezspire qui sont écrits pour les professionnels de la santé.
Quels sont les ingrédients de Tezspire?
Ingrédient actif: Tezepelumab-Echo.
Ingrédients inactifs: Acide glaciaire Acide acétique L polysorbate de sodium 80 Hydroxyde de sodium et eau pour l'injection.
Instructions pour une utilisation
Tezspire®
(Tez-Spy-is)
(Tezepelumab-écho)
injection pour une utilisation sous-cutanée
Stylo à dose unique Ces instructions d'utilisation contient des informations sur la façon d'injecter TezSpire.
Avant d'utiliser votre stylo pré-rempli Tezspire, votre fournisseur de soins de santé devrait vous montrer, vous ou votre soignant, comment l'utiliser de la bonne façon.
Lisez ces instructions à utiliser avant de commencer à utiliser votre stylo pré-rempli Tezspire et chaque fois que vous obtenez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne doivent pas remplacer la parole à votre fournisseur de soins de santé de votre état de santé et de votre traitement.
Si vous ou votre soignant avez des questions, parlez à votre fournisseur de soins de santé.
Informations importantes que vous devez savoir avant d'injecter Tezspire
Conservez Tezspire dans un réfrigérateur entre 36 ° F et 46 ° F (2 ° C à 8 ° C) dans son carton d'origine jusqu'à ce que vous soyez prêt à l'utiliser.
Tezspire may be kept at room temperature between 68°F to 77°F (20°C to 25°C) for a maximum of 30 days.
Stockez Tezspire dans le carton d'origine pour le protéger de la lumière.
Quand Tezspire a atteint la température ambiante ne pas Remettez-le dans le réfrigérateur.
Jeter (éliminer) Tezspire qui a été stocké à température ambiante pendant plus de 30 jours.
Ne pas Utilisez votre stylo pré-rempli Tezspire si:
- il a été gelé
- il a été abandonné ou endommagé
- Le sceau de sécurité sur le carton a été brisé
- La date d'expiration (EXP) est passée
Ne pas:
- congelez votre stylo pré-rempli ou exposez-le à la chaleur
- Secouez votre stylo pré-rempli
- Partagez ou utilisez votre stylo pré-rempli plus d'une fois
Si l'un des éléments ci-dessus se produit, jetez le stylo pré-rempli dans un conteneur résistant à la ponction (tranchants) et utilisez un nouveau stylo pré-rempli Tezspire.
Chaque stylo pré-rempli Tezspire contient 1 dose de Tezspire qui ne peut être utilisée que seulement.
Tezspire is given only as an injection under the skin (subcutaneous).
Gardez le stylo pré-rempli Tezspire et tous les médicaments hors de la vue et de la portée des enfants.
Votre stylo pré-rempli Tezspire
Ne pas Retirez le capuchon jusqu'à l'étape 6 de ces instructions lorsque vous êtes prêt à injecter Tezspire.
Avant utilisation
Après utilisation
Se préparer à injecter Tezspire
Étape 1 - Rassemblez les fournitures
- 1 stylo pré-rempli Tezspire du réfrigérateur
- 1 essuyage d'alcool
- 1 boule de coton ou gaze
- 1 petit bandage (facultatif)
- 1 conteneur d'élimination résistant à la perforation (objets tranchants). Voir l'étape 10 pour des instructions sur la façon de jeter (éliminer) le stylo pré-rempli Tezspire utilisé en toute sécurité.
Étape 2 - Préparez-vous à utiliser votre stylo pré-rempli Tezspire
Laissez Tezspire à température ambiante entre 68 ° F à 77 ° F (20 ° C à 25 ° C) pendant environ 60 minutes avant de donner l'injection.
Gardez le stylo pré-rempli dans son carton d'origine pour le protéger de la lumière.
Ne pas réchauffer le stylo pré-rempli d'une autre manière. Par exemple, ne le réchauffez pas au micro-ondes ou à l'eau chaude en lumière directe du soleil ou à proximité d'autres sources de chaleur.
Ne pas Remettez Tezspire au réfrigérateur après avoir atteint la température ambiante. Jeter (éliminer) Tezspire qui a été stocké à température ambiante pendant plus de 30 jours.
Ne pas Retirez le capuchon jusqu'à l'étape 6.
Étape 3 - Retirez et vérifiez le stylo pré-rempli
Prenez le milieu du corps du stylo pré-rempli pour retirer le stylo pré-rempli de son plateau.
Vérifiez le stylo pré-rempli pour les dommages. Ne pas Utilisez le stylo pré-rempli si le stylo pré-rempli est endommagé.
Vérifiez la date d'expiration sur le stylo pré-rempli. Ne pas Utilisez le stylo pré-rempli si la date d'expiration est passée.
Regardez le liquide à travers la fenêtre de visualisation. Le liquide doit être clair et incolore à jaune clair.
Ne pas Injectez TezSpire si le liquide est décoloré ou contient de grandes particules.
Vous pouvez voir de petites bulles d'air dans le liquide. C'est normal. Vous n'avez rien à faire.
Injectant Tezspire
Étape 4 - Choisissez un site d'injection
Si vous vous donnez l'injection Site d'injection recommandé est le devant de votre cuisse ou la partie inférieure de votre estomac (abdomen). Ne pas Injectez-vous dans le bras.
Un soignant peut vous injecter dans la cuisse ou l'abdomen du bras supérieur.
Pour chaque injection, choisissez un site différent qui est à au moins 1 pouce (3 cm) de l'endroit où vous avez injecté pour la dernière fois.
Ne pas injecter:
- Dans la zone de 2 pouces (5 cm) autour de votre nombril
- où la peau est tendre et écailleuse ou dure
- en cicatrices ou peau endommagée
- à travers les vêtements
Étape 5 - Lavez-vous les mains et nettoyez le site d'injection
Lavez-vous bien les mains avec du savon et de l'eau.
Nettoyez le site d'injection avec un essuyage d'alcool dans un mouvement circulaire. Laissez-le sécher à l'air.
Ne pas Touchez la zone nettoyée avant d'injecter.
Ne pas ventilateur ou souffler sur la zone nettoyée.
Étape 6 - retirer le capuchon
Ne pas Retirez le capuchon jusqu'à ce que vous soyez prêt à injecter.
Tenez le corps du stylo pré-rempli avec 1 main et retirez soigneusement le capuchon droit avec votre autre main.
Mettez le capuchon sur le côté et jetez-le plus tard.
Le garde d'aiguille orange est maintenant exposé. Le garde d'aiguille orange est là pour vous empêcher de toucher l'aiguille.
Ne pas Appuyez sur l'aiguille ou poussez sur la garde d'aiguille orange avec votre doigt.
Ne pas Remettez le capuchon sur le stylo pré-rempli. Vous pouvez faire en sorte que l'injection se produise trop tôt ou endommager l'aiguille.
Étape 7 - Injecter Tezspire
Suivez les instructions de votre fournisseur de soins de santé sur la façon d'injecter. Vous pouvez soit pincer doucement la peau sur le site d'injection ou donner l'injection sans pincer la peau.
Injecter TezSpire en suivant les étapes des chiffres A B C et d.
Lors de l'injection, vous entendrez le premier clic qui vous indique que l'injection a commencé. Appuyez et maintenez le stylo pré-rempli pendant 15 secondes jusqu'à ce que vous entendiez le deuxième clic.
Ne pas Modifiez la position du stylo pré-rempli après le début de l'injection.
Positionner le stylo pré-rempli.
- Placez le garde d'aiguille orange à plat contre votre peau (angle à 90 degrés).
- Assurez-vous que vous pouvez voir la fenêtre de visualisation.
Appuyez fermement jusqu'à ce que vous ne puissiez pas voir le garde d'aiguille orange.
- Vous entendrez le Premier «clic» Cela vous indique que l'injection a commencé.
- Le piston orange se déplacera dans la fenêtre de visualisation pendant l'injection.
Tenez fermement pendant environ 15 secondes.
- Vous entendrez un Deuxième «clic» Cela vous indique que l'injection s'est terminée.
- Le piston orange remplira la fenêtre de visualisation.
Après avoir terminé votre injection, soulevez le stylo pré-rempli tout droit.
- Le garde d'aiguille orange glissera vers le bas et se verrouille en place sur l'aiguille.
Étape 8 - Vérifiez la fenêtre d'affichage
Vérifiez la fenêtre de visualisation pour vous assurer que tous les médicaments ont été injectés.
Si la tige du piston orange ne remplit pas la fenêtre de visualisation, vous n'avez peut-être pas reçu la dose complète.
Si cela se produit ou si vous avez d'autres préoccupations, contactez votre fournisseur de soins de santé.
Étape 9 - Vérifiez le site d'injection
Il peut y avoir une petite quantité de sang ou de liquide où vous avez injecté. C'est normal.
Maintenez doucement la pression sur votre peau avec une boule de coton ou une gaze jusqu'à ce que le saignement s'arrête.
Ne pas Frottez le site d'injection. Si nécessaire, couvrez le site d'injection avec un petit bandage.
Élimination de Tezspire
Étape 10 - Effacer le stylo pré-rempli utilisé en toute sécurité
Chaque stylo pré-rempli contient une seule dose de Tezspire et ne peut pas être utilisé à nouveau. Ne pas Remettez le capuchon sur le stylo pré-rempli.
Mettez votre stylo et le capuchon pré-remplis d'occasion dans un récipient d'élimination des oblexes tout de suite après utilisation. Mettez d'autres fournitures d'occasion dans les ordures de votre ménage.
Ne pas Jetez le stylo pré-rempli dans les ordures de votre ménage.
Lancer les directives (élimination)
Si vous n'avez pas de conteneur d'élimination des objets tranchants approuvé par la FDA, vous pouvez utiliser un conteneur domestique qui est:
- fait d'un plastique robuste
- peut être fermé avec un couvercle résistant à la perforation serrée sans que les objets tranchants ne puissent sortir
- droit et stable pendant l'utilisation
- résistant à la fuite et
- correctement étiqueté pour avertir des déchets dangereux à l'intérieur du récipient.
Lorsque votre conteneur d'élimination des objets tranchants est presque plein, vous devrez suivre vos directives communautaires pour la bonne façon de disposer de votre conteneur d'élimination des objets tranchants. Il peut y avoir des lois étatiques ou locales sur la façon dont vous devez jeter les aiguilles et les seringues d'occasion. Pour plus d'informations sur l'élimination des objets tranchants sûrs et pour des informations spécifiques sur l'élimination des objets tranchants dans la région dans laquelle vous vivez, allez sur le site Web de la FDA à: https://www.fda.gov/safesharpsdisposition.
Ne pas Jetez votre conteneur d'élimination des objets tranchants d'occasion dans vos déchets ménagers, sauf si vos directives communautaires le permettent.
Ne pas Recyclez votre conteneur d'élimination des objets tranchants d'occasion.
Ces instructions pour une utilisation ont été approuvées par la Food and Drug Administration des États-Unis.