Remicade
Les Informations Présentées Sur Ce Site Ne Constituent Pas Un Avis Médical. Nous Ne Vendons Rien. L'Exactitude De La Traduction N'Est Pas Garantie. Clause De Non-Responsabilité
Résumé
Qu'est-ce que Remicade?
Remicade (infliximab) est un IgG1k chimérique anticorps monoclonal utilisé pour traiter polyarthrite rhumatoïde arthrite psoriatique rectocolite hémorragique La maladie de Crohn et spondylarthrite ankylosante . Remicade est également utilisé pour traiter sévère ou invalidante psoriasis en plaques (Écaillant argenté de la peau). Remicade est souvent utilisé lorsque d'autres médicaments n'ont pas été efficaces. Remicade bloque l'action d'une protéine de votre corps appelée facteur de nécrose tumorale -Alpha (tnf-alpha).
Quels sont les effets secondaires de Remicade?
Remicade peut provoquer des effets secondaires graves, notamment:
- vertiges
- nausée
- étourdi
- démangeaisons ou picotements
- essoufflement
- mal de tête
- fièvre
- frissons
- Douleurs musculaires ou articulaires
- douleur ou étanchéité dans votre gorge
- douleur thoracique
- Problème avalé
- fatigue extrême
- symptômes de la grippe
- toux
- symptômes de la peau (chaleur de douleur ou rougeur)
- Changements de peau
- Nouvelles croissances cutanées
- peau pâle
- ecchymoses ou saignements faciles
- gonflement dans votre visage ou vos mains
- Douleurs d'estomac (côté supérieur droit)
- fatigue
- urine sombre
- jaunissement de la peau ou des yeux (jaunisse)
- Éruption cutanée sur vos joues ou vos bras (s'aggrave au soleil)
- engourdissement ou picotement
- problèmes de vision
- faiblesse dans vos bras ou vos jambes
- Convulsions (crise)
- Redness de la peau ou patchs écailleux
- bosses surélevées remplies de pus
- gonflement de vos chevilles ou pieds
- gain de poids rapide
- sueurs nocturnes
- perte de poids
- Douleurs ou gonflements de l'estomac
- toux et
- Glanches gonflées dans les aisselles du cou ou l'aine
Obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires courants de la remicade comprennent:
- mal de tête
- douleurs à l'estomac
- nausée
- nez encombré
- sinus douleur
- éruption cutanée ou
- rinçage (rougeur de chaleur ou sentiment de piqûre).
Dites à votre médecin si vous ressentez des effets secondaires sérieux de Remicade, notamment:
- douleur or swelling at injection site
- Douleurs articulaires ou musculaires
- gonflement des chevilles ou des pieds
- ecchymoses ou saignements faciles
- changements de vision
- crises
- confusion
- faiblesse musculaire
- engourdissement et picotement des bras ou des jambes
- éruption du visage en forme de papillon
- douleur thoracique
- douleur/redness/swelling of arms or legs
- essoufflement or
- rythme cardiaque rapide / lent / irrégulier.
Cherchez des soins médicaux ou appelez le 911 à la fois si vous avez les effets secondaires graves suivants:
- Des symptômes oculaires graves tels que la perte de vision soudaine floue du tunnel de vision de la vision de la vision des yeux ou de l'enflure ou de voir des halos autour des lumières;
- Symptômes cardiaques graves tels que les battements cardiaques rapides ou battants; flotter dans votre poitrine; essoufflement; et des étourdissements soudains étourdisseurs ou s'évanouissant;
- Maux de tête sévères Confusion Slurred Speech Bras ou Ligne Proulitude Trouble de la merde Perte de coordination Sentiment des muscles très rigides très rigides Fièvre élevée Propice ou des tremblements.
Ce document ne contient pas tous les effets secondaires possibles et d'autres peuvent survenir. Vérifiez auprès de votre médecin des informations supplémentaires sur les effets secondaires.
Dosage pour la remicade
Le dosage de Remicade varie et dépend de la condition traitée.
Quelles substances ou suppléments de médicaments interagissent avec Remicade?
D'autres médicaments peuvent interagir avec Remicade. Dites à votre médecin tous les médicaments et suppléments en vente libre et en vente libre que vous utilisez.
Remicade pendant la grossesse et l'allaitement
Pendant la grossesse, la remicade ne doit être utilisée que lors de la prescription. On ne sait pas si ce médicament passe dans le lait maternel. Il est peu probable qu'il nuise à un nourrisson infirmier. Consultez votre médecin avant l'allaitement.
Informations Complémentaires
Notre centre de médicaments à effets secondaires Remicade (infliximab) offre une vue complète des informations sur les médicaments disponibles sur les effets secondaires potentiels lors de la prise de ce médicament.
Informations sur les médicaments de la FDA
- Description de la drogue
- Indications
- Dosage
- Effets secondaires
- Interactions médicamenteuses
- Avertissements
- Surdosage
- Pharmacologie clinique
- Guide des médicaments
AVERTISSEMENT
Infections graves et tumeurs malignes
Infections graves
Patients traités par remicade® sont à risque accru de développer des infections graves qui peuvent entraîner une hospitalisation ou une mort [voir AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ]. La plupart des patients qui ont développé ces infections prenaient des immunosuppresseurs concomitants tels que le méthotrexate ou les corticostéroïdes.
La remicade doit être interrompue si un patient développe une infection grave ou une septicémie.
Les infections signalées comprennent:
- Tuberculose active comprenant la réactivation de la tuberculose latente. Les patients atteints de tuberculose ont fréquemment présenté une maladie disséminée ou extrapulmonaire. Les patients doivent être testés pour la tuberculose latente avant l'utilisation de la remicade et pendant le traitement.12 Le traitement de l'infection latente doit être initié avant l'utilisation de la remicade.
- Infections fongiques invasives, y compris l'histoplasmose, la coccidioïdomycose candidose aspergillose blastomycose et pneumocystose. Les patients atteints d'histoplasmose ou d'autres infections fongiques invasives peuvent présenter une maladie disséminée plutôt que localisée. Les tests d'antigène et d'anticorps pour l'histoplasmose peuvent être négatifs chez certains patients atteints d'une infection active. Le traitement antifongique empirique doit être pris en compte chez les patients à risque d'infections fongiques invasives qui développent une maladie systémique grave.
- Infections virales et autres bactériennes dues à des agents pathogènes opportunistes, notamment Legionella et Listeria.
Les risques et les avantages du traitement par Remicade doivent être soigneusement pris en compte avant de lancer un traitement chez les patients atteints d'une infection chronique ou récurrente.
Les patients doivent être étroitement surveillés pour le développement de signes et symptômes d'infection pendant et après le traitement par Remicade, y compris le développement possible de la tuberculose chez les patients qui ont testé négatif pour l'infection à la tuberculose latente avant le début du traitement.
Malignité
Lymphome et autres tumeurs malignes. AVERTISSEMENTS AND PRÉCAUTIONS ].
Cas post-commercialisation de lymphome à cellules T hépatospléniques (HSTCL) Un type rare de lymphome à cellules T a été signalé chez les patients traités par des bloqueurs TNF, y compris Remicade. Ces cas ont eu une évolution de la maladie très agressive et ont été mortels. Presque tous les patients avaient reçu un traitement avec de l'azathioprine ou de la 6-mercaptopurine en même temps avec un bloqueur TNF à ou avant le diagnostic. La majorité des cas de remicade signalés se sont produits chez des patients atteints de maladie de Crohn ou de colite ulcéreuse et la plupart étaient chez les adolescents et les jeunes adultes.
Description de Remicade
L'infliximab L'ingrédient actif de Remicade est un anticorps monoclonal chimérique IgG1κ (composé de régions variables constantes et murines humaines) spécifiques du facteur de nécrose tumorale humaine-alpha (TNFα). Il a un poids moléculaire d'environ 149,1 kilodalts. L'infliximab est produit par une lignée cellulaire recombinante cultivée par perfusion continue et est purifiée par une série d'étapes qui comprend des mesures pour inactiver et éliminer les virus.
La remicade est fournie comme une poudre lyophilisée blanche stérile pour une perfusion intraveineuse. Après la reconstitution avec 10 ml d'eau stérile pour l'injection USP, le pH résultant est d'environ 7,2. Chaque flacon à dose unique contient 100 mg d'infliximab dibasique phosphate de sodium dihydraté (6,1 mg) monobasique phosphate de sodium monohydraté (2,2 mg) en polysorbate 80 (0,5 mg) et saccharose (500 mg). Aucun conservateur n'est présent.
Références
1. American Thoracic Society Centers for Disease Control and Prevention. Test de tuberculine ciblé et traitement du latent tuberculose infection. J'ai j breatar sur crit med 2000; 161: S221-S247.
2. Voir les derniers Centers for Disease Control Lignelines and Recommandations pour les tests de tuberculose chez les patients immunodéprimés.
Utilisations pour Remicade
La maladie de Crohn
L'infliximab est indiqué pour:
- Réduire les signes et symptômes et induire et maintenir une rémission clinique chez les patients adultes atteints de la maladie (CD) de Crohn modérément à gravement active qui ont eu une réponse inadéquate au traitement conventionnel.
- Réduire le nombre de fistules entérocutanées et rectovaginales drainantes et maintenir la fermeture de la fistule chez les patients adultes atteints de CD fistulant.
La maladie de Crohn pédiatrique
L'infliximab est indiqué pour réduire les signes et symptômes et induire et maintenir une rémission clinique chez les patients pédiatriques de 6 ans et plus avec un CD modérément à gravement actif qui a eu une réponse inadéquate à la thérapie conventionnelle.
Rectocolite hémorragique
L'infliximab est indiqué pour réduire les signes et symptômes inducteurs et maintenus la rémission clinique et la guérison muqueuse et l'élimination de l'utilisation des corticostéroïdes chez les patients adultes atteints de colite ulcéreuse modérément à sévère (UC) qui ont eu une réponse inadéquate à la thérapie conventionnelle.
Colite ulcéreuse pédiatrique
L'infliximab est indiqué pour réduire les signes et les symptômes et induire et maintenir une rémission clinique chez les patients pédiatriques de 6 ans et plus avec une CU modérément à gravement active qui a eu une réponse inadéquate à la thérapie conventionnelle.
Polyarthrite rhumatoïde
L'infliximab en combinaison avec le méthotrexate est indiqué pour réduire les signes et symptômes inhibant la progression des dommages structurels et améliorant polyarthrite rhumatoïde (Jour).
Spondylarthrite ankylosante
L'infliximab est indiqué pour réduire les signes et symptômes chez les patients adultes atteints de spondylarthrite ankylosante active (AS).
Arthrite psoriatique
L'infliximab est indiqué pour réduire les signes et symptômes de l'arthrite active inhibant la progression des dommages structurels et améliorant la fonction physique chez les patients adultes atteints d'arthrite psoriasique (PSA).
Psoriasis en plaques
L'infliximab est indiqué pour le traitement des patients adultes atteints de psoriasis de plaque sévère chronique (c'est-à-dire étendue et / ou invalidante) qui sont candidats à un traitement systémique et lorsque d'autres thérapies systémiques sont médicalement moins appropriées. L'infliximab ne doit être administré qu'aux patients qui seront étroitement surveillés et auront des visites de suivi régulières avec un médecin [voir Avertissement en boîte AVERTISSEMENTS AND PRÉCAUTIONS ].
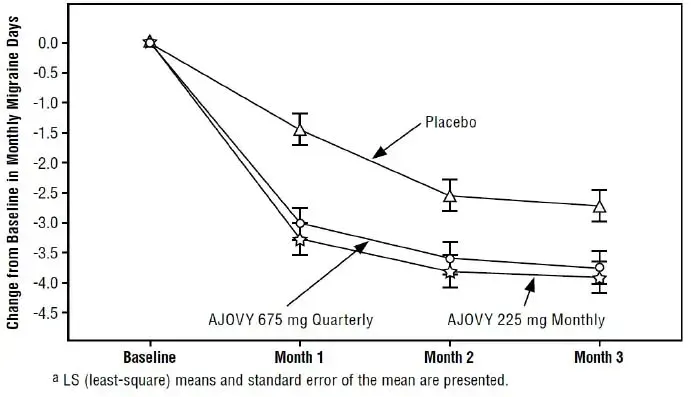
Dosage pour la remicade
Dosage In Adult La maladie de Crohn
La dose recommandée de l'infliximab est de 5 mg / kg donnée comme régime d'induction intraveineuse à 0 2 et 6 semaines suivie d'un régime d'entretien de 5 mg / kg toutes les 8 semaines par la suite pour le traitement des adultes atteints de CD ou de fistulation modérément à sévère actif. Pour les patients adultes qui réagissent et perdent ensuite leur considération de réponse, il peut être remis au traitement avec 10 mg / kg toutes les 8 semaines. Il est peu probable que les patients qui ne répondent pas à la semaine 14 répondent avec une possibilité de dosage et de considération continue doivent être remis pour interrompre l'infliximab chez ces patients.
Dosage In La maladie de Crohn pédiatrique
La dose recommandée de l'infliximab pour les patients pédiatriques de 6 ans et plus avec un CD modérément à gravement actif est de 5 mg / kg donné comme régime d'induction intraveineuse à 0 2 et 6 semaines suivi d'un régime d'entretien de 5 mg / kg toutes les 8 semaines.
Dosage In Colite ulcéreuse adulte
La dose recommandée de l'infliximab est de 5 mg / kg donnée comme régime d'induction intraveineuse à 0 2 et 6 semaines suivie d'un régime d'entretien de 5 mg / kg toutes les 8 semaines par la suite pour le traitement des patients adultes atteints de UC modérément à sévère.
Dosage In Colite ulcéreuse pédiatrique
La dose recommandée de l'infliximab pour les patients pédiatriques de 6 ans et plus avec une CU modérément à gravement active est de 5 mg / kg donnée comme un régime d'induction intraveineux à 0 2 et 6 semaines suivi d'un régime d'entretien de 5 mg / kg toutes les 8 semaines.
Dosage In Polyarthrite rhumatoïde
La dose recommandée de l'infliximab est de 3 mg / kg donnée comme régime d'induction intraveineuse à 0 2 et 6 semaines suivie d'un régime d'entretien de 3 mg / kg toutes les 8 semaines par la suite pour le traitement d'une PR modérément à sévère active. L'infliximab doit être donné en combinaison avec le méthotrexate. Pour les patients qui ont une considération de réponse incomplète, il peut être donné à l'ajustement de la dose jusqu'à 10 mg / kg toutes les 8 semaines ou à traiter aussi souvent que toutes les 4 semaines, en gardant à l'esprit que le risque d'infections graves est augmentée à des doses plus élevées par perfusion ou plus fréquentes [voir [voir Effets indésirables ].
Dosage In Spondylarthrite ankylosante
La dose recommandée de l'infliximab est de 5 mg / kg donnée comme régime d'induction intraveineuse à 0 2 et 6 semaines suivie d'un régime d'entretien de 5 mg / kg toutes les 6 semaines par la suite pour le traitement de l'AS actif.
Dosage In Arthrite psoriatique
La dose recommandée de l'infliximab est de 5 mg / kg donnée comme régime d'induction intraveineuse à 0 2 et 6 semaines suivie d'un régime d'entretien de 5 mg / kg toutes les 8 semaines par la suite pour le traitement du PSA. L'infliximab peut être utilisé avec ou sans méthotrexate.
Dosage In Psoriasis en plaques
La dose recommandée de l'infliximab chez les patients adultes est de 5 mg / kg donnée sous forme de schéma d'induction intraveineuse à 0 2 et 6 semaines suivie d'un régime d'entretien de 5 mg / kg toutes les 8 semaines par la suite pour le traitement de PS sévère chronique (c'est-à-dire étendu et / ou désactivé) ps.
Évaluation de la tuberculose latente et active
Avant de lancer l'infliximab et périodiquement pendant la thérapie, les patients doivent être évalués pour la tuberculose active et testé pour une infection latente [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Instructions d'administration concernant les réactions de perfusion
Avant le traitement, assurez-vous que le personnel et les médicaments appropriés sont disponibles pour traiter les réactions (par exemple l'hypersensibilité d'autres réactions) qui se produisent pendant la perfusion et peu de temps après la perfusion. Avant la perfusion avec des patients inflixiabe, les patients prémédiqués avec des antagonistes récepteurs de l'histamine-1 antagonistes des récepteurs de l'histamine-2 acétaminophène et / ou des corticostéroïdes [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Pour les réactions légères à modérées pendant la perfusion, envisagez de ralentir ou d'arrêter la perfusion. Lors de la résolution de ces réactions, peut réinitiier à un taux de perfusion plus faible et / ou avec des antagonistes des récepteurs de l'histamine-1 antagonistes des récepteurs de l'histamine-2 acétaminophène et / ou des corticostéroïdes. Arrêtez la perfusion si les réactions légères à modérées se reproduisent.
Arrêtez la perfusion si des réactions d'hypersensibilité graves se produisent pendant la perfusion.
Reconstitution des instructions de dilution et d'administration
L'infliximab est destiné à être utilisé sous la direction et la supervision d'un professionnel de la santé. La poudre lyophilisée fournie doit être reconstituée et diluée avant l'administration. La solution de perfusion doit être préparée et administrée par un professionnel de la santé formé utilisant la technique aseptique par la procédure suivante:
* Pour les volumes supérieurs à 250 ml, utilisez un sac de perfusion plus grand (par exemple 500 ml) ou plusieurs sacs de perfusion de 250 ml pour garantir que la concentration de la solution de perfusion ne dépasse pas 4 mg / ml.
- Calculez le volume total de dose de la solution d'infliximab reconstituée requise et le nombre de flacons d'infliximab nécessaire. Plus d'un flacon peut être nécessaire pour une dose complète.
- Reconstituer chaque flacon d'infliximab de 100 mg avec 10 ml d'eau stérile pour l'injection USP pour obtenir une concentration de 10 mg / ml en utilisant une seringue équipée d'une aiguille de calibre 21 ou plus petite comme suit:
- Retirez le revers du flacon et essuyez le dessus avec un écouvillonnage d'alcool.
- Insérez l'aiguille de seringue dans le flacon à travers le centre du bouchon en caoutchouc et dirigez le flux d'eau stérile pour l'injection USP à la paroi de verre du flacon. Tourbillonnant doucement la solution en faisant tourner le flacon pour dissoudre la poudre lyophilisée qui a un aspect en forme de gâteau. Évitez l'agitation prolongée ou vigoureuse. Ne secouez pas. Le moussage de la solution sur la reconstitution n'est pas inhabituel.
- Laissez la solution reconstituée pour se tenir debout pendant 5 minutes. Inspectez visuellement la solution reconstituée pour les particules et la décoloration. La solution reconstituée doit être incolore à jaune clair et opalescent et la solution peut développer quelques particules translucides car l'infliximab est une protéine. N'utilisez pas si la poudre lyophilisée n'a pas complètement dissous ou si une décoloration des particules opaques ou d'autres particules étrangères sont présentes. Ne stockez pas une solution d'infliximab reconstituée inutilisée.
- Diluer le volume total de la solution d'infliximab reconstituée à 250 ml * avec une injection de chlorure de sodium stérile à 0,9% de sodium (ne diluez pas avec un autre diluant) comme suit:
- Retirez un volume de la bouteille ou du sac ou sac à injection de chlorure de sodium à 0,9% USP 250 ml ou sac égal au volume total d'infliximab reconstitué requis pour une dose. Ajoutez lentement le volume total de la solution d'infliximab reconstituée de la ou des flacons à la bouteille ou du sac de perfusion de 250 ml.
- Jeter toute partie inutilisée de la solution d'infliximab reconstituée restant dans le (s) flacon (s).
- Inversez doucement le sac pour mélanger la solution. La concentration de perfusion résultante devrait varier entre 0,4 mg / ml (concentration minimale recommandée) et 4 mg / ml (concentration maximale recommandée) de l'infliximab.
- La perfusion de l'infliximab doit commencer dans les 3 heures suivant la reconstitution et la dilution. La perfusion doit être administrée par voie intraveineuse pendant au moins 2 heures avec un ensemble de perfusion avec un filtre stérile non pyrogénique stérile non pyrogénique de liaison aux protéines (taille des pores de 1,2 μm ou moins).
- Étant donné que les flacons ne contiennent pas de conservateurs antibactériens rejettent toute partie inutilisée de la solution de perfusion (ne stockez pas pour réutiliser).
Pas de physique biochimique Des études de compatibilité ont été menées pour évaluer la co-administration de l'infliximab avec d'autres agents. L'infliximab ne doit pas être infusé de manière concomitante dans la même ligne intraveineuse avec d'autres agents.
Comment fourni
Dosage Forms And Strengths
Pour injection : 100 mg d'infliximab comme poudre lyophilisée blanche dans un flacon à dose unique pour reconstitution et dilution.
Infliximab pour l'injection est fourni comme: 100 mg 20 ml de flacon individuellement emballé dans un carton ( NDC 57894-160-01).
Chaque flacon à dose unique contient 100 mg d'infliximab en tant que poudre lyophilisée blanche sans conservateur stérile pour reconstitution et dilution (plus d'un flacon peut être nécessaire pour une dose complète) [voir Posologie et administration ].
Stockage et manipulation
Conserver les flacons d'infliximab non ouverts dans un réfrigérateur à 2 ° C à 8 ° C (36 ° F à 46 ° F).
Si nécessaire, les flacons d'infliximab non ouverts peuvent être stockés à des températures d'espace jusqu'à un maximum de 30 ° C (86 ° F) pendant une seule période allant jusqu'à 6 mois mais ne dépassant pas la date d'expiration d'origine. La nouvelle date d'expiration doit être écrite dans l'espace fourni sur le carton. Une fois retiré du réfrigérateur, l'infliximab ne peut pas être retourné au réfrigérateur.
Pour les conditions de stockage du produit reconstitué et dilué pour l'administration, voir Posologie et administration .
Fabriqué par: Janssen Biotech Inc. Horsham PA 19044. Révisé: octobre 2021
Effets secondaires for Remicannoncee
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions de réaction indésirables très variables observées dans les essais cliniques d'un médicament ne peuvent pas être directement comparées aux taux dans les essais cliniques d'un autre médicament et ne peuvent pas refléter les taux observés dans la pratique.
Réactions indésirables chez les adultes
Les données décrites ici reflètent l'exposition à l'infliximab chez 4779 patients adultes (1304 patients atteints de PR 1106 patients atteints de CD 202 avec 293 avec PSA 484 avec UC 1373 avec PS et 17 patients atteints d'autres conditions) dont 2625 patients exposés au-delà de 30 semaines et 374 exposés au-delà de 1 an. [Pour plus d'informations sur les effets indésirables chez les patients pédiatriques, voir Effets indésirables ]. One of the most-common reasons for discontinuation of treatment was infusion-related reactions (e.g. dyspnea flushing mal de tête et éruption cutanée).
Réactions liées à la perfusion
Réactions indésirables pendant ou peu de temps après la perfusion
Une réaction de perfusion a été définie dans les essais cliniques comme tout événement indésirable se produisant lors d'une perfusion ou dans l'heure suivant une perfusion. Dans toutes les études cliniques, environ 20% des patients traités par l'infliximab ont connu une réaction de perfusion, contre 10% des patients traités par placebo. Des patients traités par l'infliximab qui ont eu une réaction de perfusion pendant la période d'induction 27% ont connu une réaction de perfusion pendant la période d'entretien. Des patients qui n'ont pas eu de réaction de perfusion pendant la période d'induction, 9% ont connu une réaction de perfusion pendant la période d'entretien.
Parmi toutes les perfusions de l'infliximab, 3% étaient accompagnés de symptômes non spécifiques tels que la fièvre ou les frissons 1% étaient accompagnés de réactions cardiopulmonaires (principalement des douleurs thoraciques hypotension hypertension ou dyspnée) et <1% were accompanied by pruritus urticaria or the combined symptoms of pruritus/urticaria et cardiopulmonary reactions. Serious infusion reactions occurred in <1% of patients et included anaphylaxis convulsions erythematous éruption cutanée et hypotension. Approximately 3% of patients discontinued Infliximab because of infusion reactions et all patients recovered with treatment et/or discontinuation of the infusion. Infliximab infusions beyond the initial infusion were not associated with a higher incidence of reactions. The infusion reaction rates remained stable in Ps through 1 year in Ps Study I. In psoriasis Study II the rates were variable over time et somewhat higher following the final infusion than after the initial infusion. Across the 3 Ps studies the percent of total infusions resulting in infusion reactions (i.e. an annonceverse event occurring within 1 hour) was 7% in the 3 mg / kg group 4% in the 5 mg / kg group et 1% in the placebo group.
Les patients qui sont devenus positifs pour les anticorps à l'infliximab étaient plus probables (environ deux à trois) pour avoir une réaction de perfusion que ceux qui étaient négatifs. L'utilisation d'agents d'immunosuppresseurs concomitants a semblé réduire la fréquence des deux anticorps avec les réactions de l'infliximab et de la perfusion [voir Effets indésirables et Interactions médicamenteuses ].
Réactions de perfusion après ré-administration
In a clinical trial of patients with moderate to severe Ps designed to assess the efficacy of long-term maintenance therapy versus re-treatment with an induction regimen of Infliximab following disease flare 4% (8/219) of patients in the re-treatment induction therapy arm experienced serious infusion reactions versus <1% (1/222) in the maintenance therapy arm. Patients enrolled in this trial did not receive any concomitant immunosuppressant thérapie. In this study the majority of serious infusion reactions occurred during the second infusion at Week 2. Symptoms included but were not limited to dyspnea urticaria facial edema et hypotension. In all cases Infliximab treatment was discontinued et/or other treatment instituted with complete resolution of signs et symptoms.
Réactions / réactions retardées après ré-administration
Dans les études PS, environ 1% des patients traités par l'infliximab ont connu une réaction d'hypersensibilité retardée possible généralement signalée comme une maladie sérique ou une combinaison d'arthralgie et / ou de myalgie avec fièvre et / ou éruption cutanée. Ces réactions se sont généralement produites dans les 2 semaines après la perfusion répétée.
Infections
Dans les études cliniques de l'infliximab, des infections traitées ont été signalées chez 36% des patients traités par l'infliximab (moyen de 51 semaines de suivi) et chez 25% des patients traités par placebo (moyenne de 37 semaines de suivi). Les infections les plus fréquemment rapportées étaient les infections des voies respiratoires (y compris la sinusite pharyngite et la bronchite) et les infections des voies urinaires. Parmi les patients traités par l'infliximab, les infections graves comprenaient la pneumonie de la cellulite abcès de l'ulcération cutanée et une infection bactérienne. Dans les essais cliniques, 7 infections opportunistes ont été signalées; 2 cas chacun de coccidiodomycose (1 cas était mortel) et d'histoplasmose (1 cas était mortel) et 1 cas chacun de nocardiose de pneumocystose et cytomégalovirus . La tuberculose (TB) a été signalée chez 14 patients dont 4 sont décédés en raison de la tuberculose miliaire. D'autres cas de tuberculose, y compris une tuberculose disséminée, ont également été signalés après le marché. La plupart de ces cas de tuberculose se sont produits au cours des 2 premiers mois suivant le début du traitement avec l'infliximab et peuvent refléter la recrudescence de la maladie latente [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. In the 1-year placebo-controlled studies RA I et RA II 5.3% of patients receiving Infliximab every 8 weeks with MTX developed serious infections as compared to 3.4% of placebo patients receiving MTX. Of 924 patients receiving Infliximab 1.7% developed pneumonia et 0.4% developed TB when compared to 0.3% et 0.0% in the placebo arm respectively. In a shorter (22-week) placebo-controlled study of 1082 RA patients retomized to receive placebo 3 mg / kg or 10 mg / kg Infliximab infusions at 0 2 et 6 weeks followed by every 8 weeks with MTX serious infections were more frequent in the 10 mg / kg Infliximab group (5.3%) than the 3 mg / kg or placebo groups (1.7% in both). During the 54-week Crohn's II Study 15% of patients with fistulizing CD developed a new fistula-related abscess.
Dans l'infliximab, des études cliniques chez des patients atteints d'infections de CUR traitées avec des antimicrobiens ont été signalées chez 27% des patients traités par l'infliximab (moyenne de 41 semaines de suivi) et chez 18% des patients traités par placebo (moyenne 32 semaines de suivi). Les types d'infections, y compris les infections graves rapportées chez les patients atteints de CU étaient similaires à celles rapportées dans d'autres études cliniques.
L'apparition d'infections graves peut être précédée de symptômes constitutionnels tels que la fièvre refroidit la perte de poids et la fatigue. La majorité des infections graves peuvent également être précédées de signes ou symptômes localisés sur le site de l'infection.
Auto-anticorps / syndrome de type lupus
Environ la moitié des patients traités par l'infliximab dans les essais cliniques qui étaient des anticorps antinucléaires (ANA) négatifs au départ ont développé une ANA positive pendant l'essai par rapport à environ un cinquième des patients traités par placebo. Les anticorps anti-ADDNm ont été nouvellement détectés chez environ un cinquième des patients traités par l'infliximab, contre 0% des patients traités par placebo. Signalation de lupus et lupus-like syndromes however remain uncommon.
Tumeurs malignes
Dans les essais contrôlés, plus de patients traités par l'infliximab ont développé des tumeurs malignes que les patients traités par placebo [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Dans un essai clinique contrôlé randomisé explorant l'utilisation de l'infliximab chez les patients atteints de MPOC modérée à sévère, soit des fumeurs actuels ou des ex-fumeurs, 157 patients ont été traités avec l'infliximab à des doses similaires à celles utilisées dans la PR et le CD. Parmi ces patients traités par l'infliximab, 9 ont développé une tumeur maligne comprenant 1 lymphome pour un taux de 7,67 cas pour 100 patients-années de suivi (durée médiane du suivi 0,8 ans; IC à 95% 3,51 - 14,56). Il y avait 1 tumeur maligne signalée chez 77 patients témoins pour un taux de 1,63 cas pour 100 années de suivi des patients (durée médiane du suivi 0,8 ans; IC à 95% 0,04 - 9,10). La majorité des tumeurs malignes se sont développées dans le poumon ou la tête et le cou [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Réactions indésirables chez les patients atteints d'insuffisance cardiaque NYHA classe III / IV
Dans une étude en double aveugle randomisée évaluant l'infliximab en modéré ou sévère insuffisance cardiaque (NYHA CLASSE III / IV; Fraction d'éjection ventriculaire gauche ≤35%) 150 patients ont été randomisés pour recevoir un traitement avec 3 infusions d'infliximab 10 mg / kg 5 mg / kg ou un placebo à 0 2 et 6 semaines. Des incidences plus élevées de mortalité et d'hospitalisation dues à l'aggravation d'insuffisance cardiaque ont été observées chez les patients recevant la dose d'infliximab de 10 mg / kg. À 1 an 8, les patients du groupe infliximab à 10 mg / kg étaient morts contre 4 décès chacun dans l'infliximab de 5 mg / kg et les groupes placebo. Il y avait des tendances à une augmentation de l'hypotension de la dyspnée et des étourdissements dans les groupes de traitement de l'infliximab à 10 mg / kg et 5 mg / kg par rapport au placebo. L'infliximab n'a pas été étudié chez les patients souffrant d'insuffisance cardiaque légère (NYHA classe I / II) [voir Contre-indications et AVERTISSEMENTS AND PRÉCAUTIONS ].
Hépatotoxicité
Des lésions hépatiques graves, notamment une insuffisance hépatique aiguë et une hépatite auto-immune ont été signalées chez les patients recevant de l'infliximab [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. Reactivation of hépatite B virus has occurred in patients receiving TNF blockers including Infliximab who are chronic carriers of this virus [see AVERTISSEMENTS AND PRÉCAUTIONS ].
Dans les essais cliniques dans la CD UC de PR comme des élévations PS et PSA des aminotransférases ont été observées (ALT plus courantes que AST) chez une plus grande proportion de patients recevant l'infliximab que dans les témoins (tableau 1) à la fois lorsque l'infliximab a été donné comme monothérapie et lorsqu'il a été utilisé en combinaison avec d'autres agents immunosuppants. Chez les patients généraux qui ont développé des élévations ALT et AST, étaient asymptomatiques et les anomalies ont diminué ou résolu avec la continuation ou l'arrêt de l'infliximab ou la modification des médicaments concomitants.
Tableau 1: Proportion de patients atteints d'ALT élevé dans les essais cliniques chez les adultes
| Proportion de patients atteints d'ALT élevé | ||||||
| > 1 à <3 x ULN | ≥3 x uln | ≥5 x uln | ||||
| Placebo | Infliximab | Placebo | Infliximab | Placebo | Infliximab | |
| Polyarthrite rhumatoïdea | 24% | 34% | 3% | 4% | <1% | <1% |
| Maladie de Crohnb | 34% | 39% | 4% | 5% | 0% | 2% |
| Rectocolite hémorragiquec | 12% | 17% | 1% | 2% | <1% | <1% |
| Spondylarthrite ankylosanted | 15% | 51% | 0% | 10% | 0% | 4% |
| Arthrite psoriatiquee | 16% | 50% | 0% | 7% | 0% | 2% |
| Psoriasis en plaquesf | 24% | 49% | <1% | 8% | 0% | 3% |
| a Placebo patients received methotrexate while Infliximab patients received both Infliximab et methotrexate. Médian follow-up was 58 weeks. b Placebo patients in the 2 Phase 3 trials in CD received an initial dose of 5 mg / kg Infliximab at study start et were on placebo in the maintenance phase. Patients who were retomized to the placebo maintenance group et then later crossed over to Infliximab are included in the Infliximab group in ALT analysis. Médian follow-up was 54 weeks. c Le suivi médian était de 30 semaines. Plus précisément, la durée médiane du suivi était de 30 semaines pour le placebo et de 31 semaines pour l'infliximab. d Le suivi médian était de 24 semaines pour le groupe placebo et 102 semaines pour le groupe Inflixiab. e Le suivi médian était de 39 semaines pour le groupe Infliximab et 18 semaines pour le groupe placebo. f Les valeurs d'ALT sont obtenues dans 2 études de phase 3 PS avec un suivi médian de 50 semaines pour l'infliximab et 16 semaines pour le placebo. |
Réactions indésirables dans les études de psoriasis
Au cours de la partie contrôlée par placebo à travers les 3 essais cliniques jusqu'à la semaine 16, la proportion de patients qui ont connu au moins 1 réaction indésirable grave (SAE; définie comme entraînant la mort de la vie nécessite une hospitalisation ou une invalidité / incapacité significative ou significative) était de 0,5% dans le groupe inflixiliabe de 3 mg / kg dans le groupe Placebo et 1,6% dans le groupe InflixIab Inflixiab 5 MG / KG.
Parmi les patients dans les 2 études de phase 3, 12,4% des patients recevant l'infliximab 5 mg / kg toutes les 8 semaines en 1 an de traitement d'entretien ont connu au moins 1 SAE dans l'étude I. Dans l'étude II 4,1% et 4,7% des patients recevant respectivement 1 an de traitement de l'infliximab ont subi au moins 1 SAE.
Un décès dû à une septicémie bactérienne s'est produit 25 jours après la deuxième perfusion d'infliximab de 5 mg / kg. Les infections graves comprenaient une septicémie et des abcès. Dans l'étude I, 2,7% des patients recevant de l'infliximab 5 mg / kg toutes les 8 semaines à 1 an de traitement d'entretien ont connu au moins 1 infection grave. Dans l'étude II, 1,0% et 1,3% des patients recevant un infliximab à 3 mg / kg et 5 mg / kg respectivement par un an de traitement ont connu au moins 1 infection grave. L'infection grave la plus courante (nécessitant une hospitalisation) était l'abcès (gorge de la peau et péri-rectale) signalée par 5 patients (0,7%) dans le groupe infliximab à 5 mg / kg. Deux cas actifs de tuberculose ont été signalés: 6 semaines et 34 semaines après le début de l'infliximab.
Dans la partie contrôlée par placebo des études PS, 7 des 1123 patients qui ont reçu l'infliximab à n'importe quelle dose ont été diagnostiqués avec au moins un NMSC contre 0 des 334 patients qui ont reçu un placebo.
Dans les études PS, 1% (15/1373) des patients ont connu une maladie sérique ou une combinaison de l'arthralgie et / ou de la myalgie avec de la fièvre et / ou des éruptions cutanées généralement au début de l'évolution du traitement. Parmi ces patients, 6 ont nécessité une hospitalisation en raison de la fièvre de la myalgie sévère arthralgie articulations gonflées et de l'immobilité.
Autres réactions indésirables chez les adultes
Les données de sécurité sont disponibles à partir de 4779 patients adultes traités à l'infliximab, dont 1304 avec RA 1106 avec CD 484 avec UC 202 avec 293 avec PSA 1373 avec PS et 17 avec d'autres conditions. [Pour plus d'informations sur d'autres effets indésirables chez les patients pédiatriques, voir Effets indésirables ]. Adverse reactions reported in ≥5% of all patients with RA receiving 4 or more infusions are in Table 2. The types et frequencies of annonceverse reactions observed were similar in Infliximab-treated RA AS PsA Ps et CD patients except for abdominal douleur which occurred in 26% of Infliximab-treated patients with CD. In the CD studies there were insufficient numbers et duration of follow-up for patients who never received Infliximab to provide meaningful comparisons.
Tableau 2: réactions indésirables qui se sont produites chez ≥ 5% des patients qui ont reçu ≥ 4 perfusions d'infliximab pour la PR
| Placebo (n = 350) | Infliximab (n = 1129) | |
| Des semaines moyennes de suivi | 59 semaines | 66 semaines |
| Infection des voies respiratoires supérieures | 25% | 32% |
| Nausée | 20% | 21% |
| Mal de tête | 14% | 18% |
| Sinusite | 8% | 14% |
| Diarrhée | 12% | 12% |
| Douleurs abdominales | 8% | 12% |
| Pharyngite | 8% | 12% |
| Toux | 8% | 12% |
| Bronchite | 9% | 10% |
| Éruption cutanée | 5% | 10% |
| Dyspepsie | 7% | 10% |
| Fatigue | 7% | 9% |
| Infection des voies urinaires | 6% | 8% |
| Douleur | 7% | 8% |
| Arthralgie | 7% | 8% |
| Prurit | 2% | 7% |
| Fièvre | 4% | 7% |
| Hypertension | 5% | 7% |
| Moniliase | 3% | 5% |
Les infections les plus courantes sont les infections aux indésirables graves observées dans les essais cliniques [voir Effets indésirables ]. Other serious medically relevant annonceverse reactions ≥0.2% or clinically significant annonceverse reactions by body system were as follows:
- Corps dans son ensemble: œdème de réaction allergique
- Sang: pancytopénie
- Cardiovasculaire: hypotension
- Gastro-intestinal: constipation obstruction intestinale
- Nerveux central et périphérique: vertiges
- Fréquence cardiaque et rythme: bradycardie
- Foie et biliaire: hépatite
- Métabolique et nutritionnel: déshydratation
- Saignement plaquettaire et coagulation: thrombocytopénie
- Néoplasmes: lymphome
- Globules rouges: anémie hémolytique anémie
- Mécanisme de résistance: Sarcoïdose de maladie du sérum de la cellulite
- Respiratoire: infection des voies respiratoires plus faibles (y compris pneumonie) œdème pulmonaire de la pleurésie
- Peau et appendices: Augmentation de la transpiration
- Vasculaire (extracardiaque): thrombophlebitis
- Cellule blanche et réticuloendothéliale: lymphadénopathie de leucopénie
Réactions indésirables chez les patients pédiatriques
Réactions indésirables chez les patients pédiatriques With La maladie de Crohn
Il y avait quelques différences dans les effets indésirables observés chez les patients pédiatriques recevant l'infliximab par rapport à ceux observés chez les adultes atteints de CD. Ces différences sont discutées dans les paragraphes suivants.
Les effets indésirables suivants ont été rapportés plus couramment chez 103 patients atteints de CD pédiatrique randomisés administrés par l'infliximab de 5 mg / kg à 54 semaines que chez 385 patients atteints de CD adulte recevant un schéma de traitement similaire: une infection virale (11%) (9%) (9%) infection (8%) (9%) (9%) (8%) (8%) (9%) (9%) (8%). neutropénie (7%) Fracture osseuse (7%) Infection bactérienne (6%) et réaction allergique des voies respiratoires (6%).
Infections were reported in 56% of retomized pediatric patients in Study Peds Crohn's et in 50% of annonceult patients in Study Crohn's I. In Study Peds Crohn's infections were reported more frequently for patients who received every 8-week as opposed to every 12-week infusions (74% et 38% respectively) while serious infections were reported for 3 patients in the every 8-week et 4 patients in the every 12-week maintenance treatment group. The most commonly reported infections were upper respiratory tract infection et pharyngitis et the most commonly reported serious infection was abscess. Pneumonia was reported for 3 patients (2 in the every 8-week et 1 in the every 12-week maintenance treatment groups). Herpes zoster was reported for 2 patients in the every 8-week maintenance treatment group.
Dans l'étude, les 18% des patients randomisés de Crohn ont connu 1 ou plus de réactions de perfusion sans différence notable entre les groupes de traitement. Sur les 112 patients de l'étude PEDS Crohn, il n'y a pas eu de réactions de perfusion graves et 2 patients ont eu des réactions anaphylactoïdes non sérieuses.
Des élévations d'ALT jusqu'à 3 fois la limite supérieure de la normale (ULN) ont été observées chez 18% des patients pédiatriques dans les essais cliniques de CD; 4% avaient des élévations ALT ≥3 × ULN et 1% avaient des élévations ≥5 × ULN. (Le suivi médian était de 53 semaines).
Réactions indésirables chez les patients pédiatriques With Rectocolite hémorragique
Dans l'ensemble, les effets indésirables rapportés dans l'essai pédiatrique UC et les études UC (étude UC I et UC II) étaient généralement cohérents. Dans un essai UC pédiatrique, les effets indésirables les plus courants étaient la pharyngite des voies respiratoires supérieures Pharyngite Fièvre de douleurs abdominales et les maux de tête.
Infections were reported in 31 (52%) of 60 treated patients in the pediatric UC trial et 22 (37%) required oral or parenteral antimicrobial treatment. The proportion of patients with infections in the pediatric UC trial was similar to that in the pediatric CD study (Study Peds Crohn's) but higher than the proportion in the annonceults' UC studies (Étudiez UC I et Étudiez UC II). The overall incidence of infections in the pediatric UC trial was 13/22 (59%) in the every 8 week maintenance treatment group. Infection des voies respiratoires supérieures (7/60 [12%]) et pharyngitis (5/60 [8%]) were the most frequently reported respiratory system infections. Serious infections were reported in 12% (7/60) of all treated patients.
Des élévations d'ALT jusqu'à 3 fois la limite supérieure de la normale (ULN) ont été observées dans 17% (10/60) des patients pédiatriques dans l'essai pédiatrique UC; 7% (4/60) avaient des altitudes ALT ≥3 × ULN et 2% (1/60) avaient des élévations ≥5 × ULN (le suivi médian était de 49 semaines).
Dans l'ensemble, 8 des 60 (13%) patients traités ont connu une ou plusieurs réactions de perfusion, dont 4 des 22 (18%) patients dans le groupe d'entretien de traitement de 8 semaines. Aucune réaction de perfusion grave n'a été signalée.
Dans l'essai pédiatrique UC, 45 patients étaient dans le groupe d'âge de 12 à 17 ans et 15 dans le groupe d'âge de 6 à 11 ans. Le nombre de patients dans chaque sous-groupe est trop petit pour faire des conclusions définitives sur l'effet de l'âge sur les événements de sécurité. Il y avait des proportions plus élevées de patients présentant des événements indésirables graves (40% contre 18%) et l'arrêt en raison d'événements indésirables (40% contre 16%) dans le groupe d'âge plus jeune que dans le groupe d'âge plus âgé. Alors que la proportion de patients infections était également plus élevée dans le groupe d'âge plus jeune (60% contre 49%) pour les infections graves, les proportions étaient similaires dans les deux groupes d'âge (13% dans le groupe d'âge de 6 à 11 ans contre 11% dans le groupe d'âge de 12 à 17 ans). Les proportions globales des effets indésirables, y compris les réactions de perfusion, étaient similaires entre les groupes d'âge de 6 et 11 à 17 ans (13%).
Immunogénicité
Comme pour toutes les protéines thérapeutiques, il existe un potentiel d'immunogénicité. La détection de la formation d'anticorps dépend fortement de la sensibilité et de la spécificité du test. De plus, l'incidence observée de l'anticorps (y compris les anticorps neutralisants) dans un test peut être influencée par plusieurs facteurs, notamment la méthodologie du test, le moment de la gestion des échantillons de médicaments concomitants de collecte d'échantillons et la maladie sous-jacente. For these reasons comparison of the incidence of antibodies in the studies described below with the incidence of antibodies in other studies or to other infliximab products may be misleading.
Le traitement par l'infliximab peut être associé au développement d'anticorps contre l'infliximab. Une méthode d'immunodosage enzymatique (EIA) a été à l'origine utilisée pour mesurer les anticorps anti-infliximab dans les études cliniques de l'infliximab. La méthode EIA est soumise à des interférences par l'infliximab sérique entraînant peut-être une sous-estimation du taux de formation d'anticorps du patient. Une méthode d'immunodosage électrochimilumilumilumilumilumilumilumilumilumiluiscence (ECLIA) séparée (ECLIA) pour détecter les anticorps à l'infliximab a ensuite été développée et validée. Cette méthode est 60 fois plus sensible que l'EIA d'origine. Avec la méthode Eclia, tous les échantillons cliniques peuvent être classés comme positifs ou négatifs pour les anticorps à l'infliximab sans avoir besoin de la catégorie non concluante.
L'incidence des anticorps contre l'infliximab était basée sur la méthode de l'EIE originale dans toutes les études cliniques de l'infliximab, à l'exception de l'étude de phase 3 chez les patients pédiatriques atteints de CU où l'incidence des anticorps à l'infliximab a été détectée en utilisant à la fois les méthodes EIA et ECLIA.
Immunogénicité In Adult Patients
L'incidence des anticorps contre l'infliximab chez les patients atteints de PR et de CD étant donné un régime d'induction à 3 doses suivi d'un dosage d'entretien était d'environ 10%, comme évalué pendant 1 à 2 ans de traitement à l'infliximab. Une incidence plus élevée d'anticorps contre l'infliximab a été observée chez les patients atteints de CD recevant l'infliximab après des intervalles sans médicament> 16 semaines. Dans une étude PSA dans laquelle 191 patients ont reçu 5 mg / kg avec ou sans anticorps MTX contre l'infliximab se sont produits chez 15% des patients. La majorité des patients positifs aux anticorps avaient des titres faibles. Le développement des anticorps était plus faible chez les patients PR et CD recevant des thérapies immunosuppresseurs telles que 6-MP / AZA ou MTX. Les patients atteints de l'anticorps positif étaient plus susceptibles d'avoir des taux de dégagement plus élevés ont réduit l'efficacité et subir une réaction de perfusion que les patients qui étaient négatifs en anticorps [voir Effets indésirables ]. In the Ps Study II which included both the 5 mg / kg et 3 mg / kg doses antibodies were observed in 36% of patients treated with 5 mg / kg every 8 weeks for 1 year et in 51% of patients treated with 3 mg / kg every 8 weeks for 1 year.
Dans l'étude PS III, qui comprenait également à la fois les 5 mg / kg et 3 mg / kg d'anticorps ont été observés chez 20% des patients traités avec une induction de 5 mg / kg (semaines 0 2 et 6) et chez 27% des patients traités avec 3 mg / kg d'induction. Despite the increase in antibody formation the infusion reaction rates in Studies I and II in patients treated with 5 mg/kg induction followed by every 8 week maintenance for 1 year and in Study III in patients treated with 5 mg/kg induction (14.1%-23.0%) and serious infusion reaction rates (<1%) were similar to those observed in other study populations. The clinical significance of apparent increased immunogenicity on efficacy et infusion reactions in Ps patients as compared to patients with other diseases treated with Infliximab over the long term is not known.
Immunogénicité In Pediatric Patients With La maladie de Crohn
Dans l'étude, les péds de Crohn dans lesquels tous les patients ont reçu des doses stables de 6 MP AZA ou MTX, excluant les échantillons non concluants, 3 des 24 patients avaient des anticorps contre l'infliximab. Bien que 105 patients aient été testés pour les anticorps à l'infliximab, 81 patients ont été classés comme non concluants car ils n'ont pas pu être jugés négatifs en raison de l'interférence du test par la présence d'infliximab dans l'échantillon.
Immunogénicité In Pediatric Patients With Rectocolite hémorragique
Dans l'essai pédiatrique de l'UC, 58 patients ont été évalués pour les anticorps à l'infliximab en utilisant l'EIE ainsi que l'éclia tolérante au médicament. Avec l'EIE 4 sur 58 (7%), les patients avaient des anticorps contre l'infliximab. Avec l'Eclia 30 sur 58 (52%), les patients avaient des anticorps contre l'infliximab. L'incidence plus élevée d'anticorps contre l'infliximab par la méthode Eclia était due à la sensibilité 60 fois plus élevée par rapport à la méthode EIA. Alors que les patients positifs pour l'EIE avaient généralement des concentrations d'infliximab à creux indétectables, les patients Eclia positifs pourraient avoir des concentrations de creux détectables d'infliximab car le test ECLIA est plus sensible et tolérant au médicament.
Expérience de commercialisation de la poste
Les effets indésirables certains avec des résultats mortels ont été identifiés lors de l'utilisation post-approbation de l'infliximab chez les patients adultes et pédiatriques. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Réactions indésirables post-commercialisation chez les adultes et les patients pédiatriques
- Neutropénie [voir AVERTISSEMENTS AND PRÉCAUTIONS ] Agranulocytisie (y compris les nourrissons exposés in utero à l'infliximab) purpura thrombocytopénique idiopathique purpura thrombotique thrombocytopénique .
- Maladie pulmonaire interstitielle (y compris la fibrose pulmonaire / pneumonite interstitielle et les maladies rapidement progressives).
- Épanchement péricardique systémique et cutané vascularite .
- Erythème multiforme Syndrome de Stevens-Johnson Nécrolyse épidermique toxique Dermatose Bullous Dermatose (LABD) Pustulose exanthémateuse généralisée aiguë (AGEP) Nouveau apparition et aggravation de psoriasis (tous les types de lichennoïdes pustules principalement Palmoplante).
- Troubles démyélinisants périphériques (tels que le syndrome de Guillain-Barré, la polyneuropathie démyélinale chronique et la neuropathie motrice multifocale) Myélite transversale et les neuropathies (des réactions neurologiques supplémentaires ont également été observées) [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
- Insuffisance hépatique aiguë jaunisse hépatite et cholestasis [see AVERTISSEMENTS AND PRÉCAUTIONS ].
- Infections graves [voir AVERTISSEMENTS AND PRÉCAUTIONS ] et une infection percée du vaccin, y compris la tuberculose bovine (infection par BCG disséminée) après vaccination dans un nourrisson exposé in utero à l'infliximab [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
- Tumeurs malignes including leukemia mélanome Carcinome à cellules Merkel et cancer du col de l'utérus [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
- Réactions anaphylactiques, y compris anaphylactique choc L'œdème laryngé / pharyngé et le bronchospasme sévère et la crise ont été associés à l'administration de l'infliximab.
- Une perte visuelle transitoire a été signalée en association avec l'infliximab pendant ou dans les 2 heures suivant la perfusion. Accidents cérébrovasculaires ischémie / infarctus du myocarde (certains mortels) et une arythmie survenant dans les 24 heures suivant le début de la perfusion ont également été signalés [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
CARCRANGEMENT DES POSTERS ENFÉRES DES PATIQUES PÉDIATRIQUES
Les effets indésirables graves suivants ont été signalés dans l'expérience post-marchandage chez les patients pédiatriques: infections (certaines mortelles), y compris les infections opportunistes et les réactions de perfusion de tuberculose, les tumeurs malignes, y compris les lymphomes hépatospléniques à cellules T [voir Avertissement en boîte et AVERTISSEMENTS AND PRÉCAUTIONS ] anomalies enzymatiques hépatiques transitoires syndromes de type lupus et développement d'auto-anticorps.
Interactions médicamenteuses for Remicannoncee
Autres produits biologiques
La combinaison de l'infliximab avec d'autres produits biologiques utilisés pour traiter les mêmes conditions que l'infliximab n'est pas recommandé [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Un risque accru d'infections graves a été observé dans les études cliniques d'autres bloqueurs de TNF utilisés en combinaison avec Anakinra ou Abatacept sans avantage clinique supplémentaire. En raison de la nature des effets indésirables observés avec ces combinaisons avec une thérapie de bloqueurs TNF, des toxicités similaires peuvent également résulter de la combinaison d'Anakinra ou d'Abatacept avec d'autres bloqueurs de TNF. Par conséquent, la combinaison de l'infliximab et de l'anakinra ou de l'abatacept n'est pas recommandée [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
L'utilisation concomitante du tocilizumab avec des ARM biologiques telles que les antagonistes du TNF, y compris l'infliximab, doit être évitée en raison de la possibilité d'une immunosuppression accrue et d'un risque accru d'infection.
Méthotrexate et autres médicaments concomitants
Des études d'interaction médicamenteuses spécifiques, y compris les interactions avec le méthotrexate (MTX), n'ont pas été menées. La majorité des patients des études cliniques de PR ou de CD ont reçu un ou plusieurs médicaments concomitants. Dans les médicaments concomitants de la PR, en plus des MTX, il y avait des agents anti-inflammatoires non stéroïdiens (AINS) acide folique corticostéroïdes et / ou stupéfiants. Les médicaments CD concomitants étaient les antibiotiques antiviraux corticostéroïdes 6-MP / AZA et aminosalicylates. Dans les essais cliniques PSA, les médicaments concomitants comprenaient le MTX chez environ la moitié des patients ainsi que les AINS d'acide folique et les corticostéroïdes. L'utilisation concomitante du MTX peut diminuer l'incidence de la production d'anticorps anti-infliximab et augmenter les concentrations d'infliximab.
Immunosuppresseurs
Les patients atteints de CD qui ont reçu des immunosuppresseurs avaient tendance à subir moins de réactions de perfusion par rapport aux patients sans immunosuppresseurs [voir Effets indésirables ]. Serum infliximab concentrations appeared to be unaffected by baseline use of medications for the treatment of CD including corticosteroids antibiotiques (metronidazole or ciprofloxacin) et aminosalicylates.
Substrats du cytochrome P450
La formation d'enzymes CYP450 peut être supprimée par des niveaux accrus de cytokines (par exemple IFN TNFα IL-1 IL-6 IL-10) pendant l'inflammation chronique. Par conséquent, il est prévu que pour une molécule qui antagonise l'activité des cytokines tels que l'infliximab, la formation d'enzymes CYP450 pourrait être normalisée. Lors de l'initiation ou de l'arrêt de l'infliximab chez les patients traités avec des substrats CYP450 avec une surveillance étroite de l'indice thérapeutique de l'effet (par exemple la warfarine) ou une concentration de médicament (par exemple, la cyclosporine ou la théophylline) est recommandée et la dose individuelle du produit médicamenteuse peut être ajustée au besoin.
Vaccins en direct / agents infectieux thérapeutiques
Il est recommandé que les vaccins en direct ne soient pas donnés simultanément avec l'infliximab. Il est également recommandé que les vaccins vivants ne soient pas donnés aux nourrissons après une exposition in utero à l'infliximab pendant au moins 6 mois après la naissance [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Il est recommandé que les agents infectieux thérapeutiques ne soient pas administrés simultanément avec l'infliximab [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Avertissements pour Remicade
Inclus dans le cadre du PRÉCAUTIONS section.
Précautions pour Remicade
Infections graves
Les patients traités par l'infliximab courent un risque accru de développer des infections graves impliquant divers systèmes d'organes et sites qui peuvent entraîner une hospitalisation ou la mort.
Des infections opportunistes dues à des organismes viraux fongiques ou parasites fongiques invasifs bactériens, y compris l'aspergillose blastomycosis candidose coccidiodomycose cryptococcose histoplasmose legionellose Lisqueriosis pneumocystose saumonellose et tuberculose ont été signalés avec des bloqueurs de TNF. Les patients ont fréquemment présenté une maladie disséminée plutôt que localisée.
est la norethindrone comme pilule contraceptive
Le traitement par l'infliximab ne doit pas être initié chez les patients atteints d'une infection active, y compris les infections localisées cliniquement importantes. Les patients de plus de 65 ans, les patients atteints de comorbides et / ou les patients prenant des immunosuppresseurs concomitants tels que les corticostéroïdes ou le méthotrexate peuvent être plus à risque d'infection. Les risques et les avantages du traitement doivent être pris en compte avant de lancer un traitement chez les patients:
- avec une infection chronique ou récurrente;
- qui ont été exposés à la tuberculose;
- avec une histoire d'une infection opportuniste;
- qui ont résidé ou voyagé dans des zones de endémique tuberculose or endémique mycoses such as histoplasmosis coccidioidomycosis or blastomycosis; or
- avec des conditions sous-jacentes qui peuvent les prédisposer à l'infection.
Tuberculose
Des cas de réactivation de la tuberculose ou de nouvelles infections à la tuberculose ont été observés chez les patients recevant un infliximab, y compris les patients qui ont déjà reçu un traitement pour la tuberculose latente ou active. Des cas de tuberculose active ont également eu lieu chez les patients traités par l'infliximab pendant le traitement de la tuberculose latente.
Les patients doivent être évalués pour les facteurs de risque de tuberculose et testés pour une infection latente avant d'initier l'infliximab et périodiquement pendant le traitement. Il a été démontré que le traitement de l'infection à la tuberculose latente avant le traitement par des bloqueurs de TNF réduit le risque de réactivation de la tuberculose pendant le traitement. L'induration de 5 mm ou plus avec les tests cutanés de la tuberculine doit être considérée comme un résultat de test positif lors de l'évaluation si le traitement de la tuberculose latente est nécessaire avant d'initier l'infliximab, même pour les patients auparavant vaccinés avec Bacille Calmette-Guã © Rin (BCG).
Le traitement anti-tuberculose doit également être pris en compte avant le début de l'infliximab chez les patients ayant des antécédents de tuberculose latente ou active dans qui un traitement adéquat ne peut pas être confirmé et pour les patients avec un test négatif pour la tuberculose latente mais ayant des facteurs de risque d'infection à la tuberculose. La consultation avec un médecin ayant une expertise dans le traitement de la tuberculose est recommandée pour aider à décider si le début du traitement anti-tuberculose est approprié pour un patient individuel.
Tuberculose should be strongly considered in patients who develop a new infection during Infliximab treatment especially in patients who have previously or recently traveled to countries with a high prevalence of tuberculose or who have hannonce close contact with a person with active tuberculose.
Surveillance
Les patients doivent être étroitement surveillés pour le développement de signes et symptômes d'infection pendant et après le traitement par l'infliximab, y compris le développement de la tuberculose chez les patients qui ont testé négatif pour une infection latente tuberculose avant le début du traitement. Les tests d'infection à la tuberculose latente peuvent également être faussement négatifs lors de la thérapie avec l'infliximab.
Infliximab should be discontinued if a patient develops a serious infection or sepsis. A patient who develops a new infection during treatment with Infliximab should be closely monitored undergo a prompt et complete diagnostic workup appropriate for an immunocompromised patient et appropriate antimicrobial therapy should be initiated.
Infections fongiques invasives
Pour les patients qui résident ou voyagent dans des régions où les mycoses sont une infection fongique invasive endémique devraient être suspectées s'ils développent une maladie systémique grave. Une thérapie antifongique empirique appropriée doit être prise en compte lors d'un bilan diagnostique. Les tests d'antigène et d'anticorps pour l'histoplasmose peuvent être négatifs chez certains patients atteints d'une infection active. Lorsqu'il est possible, la décision d'administrer un traitement antifongique empirique chez ces patients doit être prise en consultation avec un médecin ayant une expertise dans le diagnostic et le traitement des infections fongiques invasives et devrait prendre en compte à la fois le risque d'infection fongique sévère et les risques de thérapie antifongique.
Tumeurs malignes
Tumeurs malignes some fatal have been reported among children annonceolescents et young annonceults who received treatment with TNF blockers (initiation of therapy ≤18 years of age) including Infliximab. Approximately half of these cases were lymphomes including Hodgkin’s et non-Hodgkin’s lymphome. The other cases represented a variety of malignancies including rare malignancies that are usually associated with immunosuppression et malignancies that are not usually observed in children et annonceolescents. The malignancies occurred after a median of 30 months (range 1 to 84 months) after the first dose of TNF blocker thérapie. Most of the patients were receiving concomitant immunosuppressants. These cases were reported post-marketing et are derived from a variety of sources including registries et spontaneous postmarketing reports.
Lymphomes
Dans les parties contrôlées des essais cliniques de tous les bloqueurs TNF, plus de cas de lymphome ont été observés chez les patients recevant un bloqueur de TNF par rapport aux patients témoins. Dans les parties contrôlées et ouvertes des essais cliniques sur l'infliximab, 5 patients ont développé des lymphomes chez 5707 patients traités par infliximab (durée médiane du suivi 1,0 ans) contre 0 lymphomes chez 1600 patients témoins (durée médiane du suivi 0,4 ans). Chez les patients atteints de PR, 2 lymphomes ont été observés pour un taux de 0,08 cas pour 100 patients-années de suivi qui est environ trois fois plus élevé que prévu dans la population générale. Dans la population combinée d'essais cliniques pour PR CD PSA comme des lymphomes UC et PS 5 ont été observés pour un taux de 0,10 cas pour 100 patients de suivi, qui est environ quatre fois plus élevé que prévu dans la population générale. Les patients atteints de CD RA ou PS, en particulier les patients atteints d'une maladie très active et / ou une exposition chronique aux thérapies par immunosuppresseurs, peuvent être plus à risque (jusqu'à plusieurs fois) que la population générale pour le développement du lymphome même en l'absence de bloqueurs du TNF. Des cas de leucémie aiguë et chronique ont été signalés avec une utilisation des bloqueurs TNF post-post-bourse dans la PR et d'autres maladies. Même en l'absence de traitement des bloqueurs TNF, les patients atteints de PR peuvent être à un risque plus élevé (environ 2 fois) que la population générale pour le développement de la leucémie.
Lymphome hépatosplénique à cellules T (HSTCL)
Cas post-commercialisation de lymphome à cellules T hépatospléniques (HSTCL) Un type rare de lymphome à cellules T a été signalé chez les patients traités par des bloqueurs TNF, y compris l'infliximab. Ces cas ont eu une évolution de la maladie très agressive et ont été mortels. Presque tous les patients avaient reçu un traitement avec les immunosuppresseurs azathioprine ou 6âmercaptopurine concomitamment avec un bloqueur de TNF à ou avant le diagnostic. La majorité des cas d'infliximab signalés se sont produits chez des patients atteints de CD ou de CU et la plupart étaient chez les adolescents et les jeunes adultes. Il n'est pas certain que la survenue de HSTCL soit liée aux bloqueurs TNF ou aux bloqueurs TNF en combinaison avec ces autres immunosuppresseurs. When treating patients consideration of whether to use Infliximab alone or in combination with other immunosuppressants such as azathioprine or 6-mercaptopurine should take into account a possibility that there is a higher risk of HSTCL with combination therapy versus an observed increased risk of immunogenicity and hypersensitivity reactions with Infliximab monotherapy from the clinical trial data [see AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
Cancer de la peau
Le mélanome et le carcinome à cellules de Merkel ont été signalés chez les patients traités par un traitement des bloqueurs TNF, y compris l'infliximab [voir Effets indésirables ]. Periodic skin examination is recommended for all patients particularly those with risk factors for skin cancer.
Cancer du col de l'utérus
Une étude de cohorte rétrospective basée sur la population utilisant des données des registres nationaux de santé suédois a révélé une augmentation de 2 à 3 fois de l'incidence du cancer du col de l'utérus invasif chez les femmes atteintes de PR traitées par l'infliximab par rapport aux patients biologiques-Naã¯ve ou dans la population générale, en particulier celles de plus de 60 ans. Une relation causale entre l'infliximab et le cancer du col de l'utérus ne peut être exclue. Le dépistage périodique devrait se poursuivre chez les femmes traitées avec l'infliximab [voir Effets indésirables ].
Autres tumeurs malignes
Dans les parties contrôlées des essais cliniques de certains bloqueurs de TNF, notamment des tumeurs malignes à l'infliximab (à l'exclusion du lymphome et du cancer de la peau non mélanome [NMSC]) ont été observés chez les patients recevant ces bloqueurs du TNF par rapport aux patients témoins. Pendant les parties contrôlées des essais d'infliximab chez les patients atteints de PSA PSA de PR CD modérément à gravement actif, comme les patients UC et PS 14 ont été diagnostiqués avec des tumeurs malignes (à l'exclusion du lymphome et du NMSC) parmi 4019 patients traités par l'inflixab Durée du suivi 0,5 ans pour les patients traités par l'infliximab et 0,4 ans pour les patients témoins. Parmi ceux-ci, les tumeurs malignes les plus courantes étaient colorectales mammaires et mélanome. Le taux de tumeurs malignes chez les patients traités par l'infliximab était similaire à celui attendu dans la population générale tandis que le taux des patients témoins était plus faible que prévu.
Dans un essai clinique explorant l'utilisation de l'infliximab chez les patients atteints d'une maladie pulmonaire obstructive chronique modérée à sévère (MPOC) plus de tumeurs malignes La majorité d'origine pulmonaire ou de la tête et du cou a été signalée chez les patients traités par l'infliximab par rapport aux patients témoins. Tous les patients avaient des antécédents de tabagisme [voir Effets indésirables ]. Prescribers should exercise caution when considering the use of Infliximab in patients with moderate to severe COPD.
Les patients PS doivent être surveillés pour les cancers de la peau non mélanome (NMSC), en particulier les patients qui ont subi un traitement de photothérapie prolongé. Dans la partie d'entretien des essais cliniques pour l'infliximab, les NMSC étaient plus fréquents chez les patients atteints de photothérapie précédente [voir Effets indésirables ].
Le rôle potentiel des bloqueurs du TNF dans le développement des tumeurs malignes n'est pas connu [voir Effets indésirables ]. Rates in clinical trials for Infliximab cannot be compared to rates in clinical trials of other TNF blockers et may not predict rates observed in a broannonceer patient population. Caution should be exercised in considering Infliximab treatment in patients with a history of malignancy or in continuing treatment in patients who develop malignancy while receiving Infliximab.
Réactivation du virus de l'hépatite B
L'utilisation de bloqueurs TNF, y compris l'infliximab, a été associée à la réactivation du virus de l'hépatite B (VHB) chez les patients qui sont des porteurs chroniques de ce virus. Dans certains cas, la réactivation du VHB se produisant en conjonction avec le traitement des bloqueurs TNF a été fatale. La majorité de ces rapports se sont produits chez les patients recevant de manière concomitante d'autres médicaments qui suppriment le système immunitaire qui peut également contribuer à la réactivation du VHB. Les patients doivent être testés pour l'infection par le VHB avant de lancer un traitement des bloqueurs TNF, y compris l'infliximab. Pour les patients qui testent positifs pour l'antigène de surface de l'hépatite B, la consultation avec un médecin ayant une expertise dans le traitement de l'hépatite B est recommandée. Des données adéquates ne sont pas disponibles sur l'innocuité ou l'efficacité du traitement des patients qui sont porteurs de VHB avec un traitement antiviral en conjonction avec le traitement des bloqueurs TNF pour prévenir la réactivation du VHB. Les patients porteurs de VHB et ont besoin d'un traitement par des bloqueurs de TNF doivent être étroitement surveillés pour les signes cliniques et en laboratoire d'une infection active du VHB tout au long du traitement et pendant plusieurs mois après la fin du traitement. Chez les patients qui développent la réactivation du VHB, les bloqueurs TNF doivent être arrêtés et antiviral La thérapie avec un traitement de soutien approprié doit être lancée. La sécurité de la reprise du traitement des bloqueurs TNF après le contrôle de la réactivation du VHB n'est pas connue. Par conséquent, les prescripteurs devraient faire preuve de prudence lors de la reprise du traitement des bloqueurs TNF dans cette situation et surveiller de près les patients.
Hépatotoxicité
Des réactions hépatiques sévères, notamment l'ictatite et la cholestase de l'insuffisance hépatique aiguë, ont été rapportées dans les données de commercialisation chez les patients recevant des infliximabs. L'hépatite auto-immune a été diagnostiquée dans certains de ces cas. Des réactions hépatiques graves se sont produites entre 2 semaines à plus d'un an après le début de l'infliximab; Des élévations des niveaux d'aminotransférase hépatiques n'ont pas été notées avant la découverte des lésions hépatiques dans bon nombre de ces cas. Certains de ces cas étaient mortels ou nécessitaient une transplantation hépatique. Les patients présentant des symptômes ou des signes de dysfonction hépatique doivent être évalués pour des preuves de lésion hépatique. Si l'ictère et / ou les élévations enzymatiques du foie marquées (par exemple ≥ 5 fois la limite supérieure de la normale), le développement de l'infliximab doit être interrompu et une enquête approfondie de l'anomalie doit être entreprise. Dans les essais cliniques, des élévations légères ou modérées de l'ALT et de l'AST ont été observées chez les patients recevant l'infliximab sans progression vers une lésion hépatique sévère [voir Effets indésirables ].
Insuffisance cardiaque
L'utilisation de l'infliximab à des doses> 5 mg / kg est contre-indiquée chez les patients souffrant d'insuffisance cardiaque modérée ou sévère. Une étude randomisée à double aveugle contrôlée par placebo a évalué l'utilisation de l'infliximab (5 mg / kg ou 10 mg / kg aux semaines 0 2 et 6) chez les patients souffrant d'insuffisance cardiaque modérée ou sévère [Classe III / IV de la New York Heart Association (NYHA). Par rapport aux patients qui ont reçu un placebo, il y avait un taux de mortalité plus élevé et un risque plus élevé d'hospitalisation à la semaine 28 en raison de l'insuffisance cardiaque chez les patients qui ont reçu la dose d'infliximab de 10 mg / kg et des taux d'égalité indésirables cardiovasculaires plus élevés chez les patients qui ont reçu des doses d'infliximab de 5 mg / kg et 10 mg / kg.
Il y a eu des rapports post-commercialisation de nouveaux apparitions et d'aggravation d'insuffisance cardiaque avec et sans facteurs précipités identifiables (par exemple, une maladie cardiovasculaire préexistante) chez les patients traités par l'infliximab. Certains de ces patients ont moins de 50 ans.
Si une décision est prise d'administrer l'infliximab (≤ 5 mg / kg) aux patients présentant une insuffisance cardiaque modérée ou sévère ou pour administrer l'infliximab (toute dose approuvée) aux patients souffrant d'une insuffisance cardiaque légère, ils doivent être étroitement surveillés pendant la thérapie et l'infliximabe devrait être interrompu si les symptômes nouveaux ou aggravés de l'insuffisance cardiaque [voir [voir l'infliximab Contre-indications et Effets indésirables ].
Réactions hématologiques
Des cas de leucopénie neutropénie thrombocytopénie et de pancytopénie, certains avec un résultat mortel ont été signalés chez les patients recevant de l'infliximab. La relation causale à la thérapie par l'infliximab reste incertaine. Bien qu'aucun groupe (s) à haut risque n'a été identifié, une prudence devrait être exercée chez les patients traités par l'infliximab qui ont des anomalies hématologiques en cours ou des antécédents. Tous les patients doivent être invités à consulter des soins médicaux immédiats s'ils développent des signes et des symptômes suggérant des dyscrasies sanguines ou une infection (par exemple, la fièvre persistante) pendant l'infliximab. L'arrêt du traitement par l'infliximab doit être pris en compte chez les patients qui développent des anomalies hématologiques importantes.
Hypersensibilité
Infliximab has been associated with hypersensitivity reactions that vary in their time of onset et required hospitalization in some cases. Most hypersensitivity reactions (including anaphylaxis urticaria dyspnea et/or hypotension) have occurred during or within 2 hours of Infliximab infusion.
Cependant, dans certains cas, des réactions sériques de maladie du sérum ont été observées chez les patients après un traitement par l'infliximab initial (c'est-à-dire dès la deuxième dose) et lorsque le traitement par l'infliximab a été rétabli après une période prolongée sans traitement inflixiab. Les symptômes associés à ces réactions comprennent la fièvre des maux de tête mal de gorge Myalgias polyarthralgias manue et œdème facial et / ou dysphagie. Ces réactions ont été associées à une augmentation marquée des anticorps contre la perte de l'infliximab de concentrations sériques détectables d'infliximab et une perte possible d'efficacité médicamenteuse.
Infliximab should be discontinued for severe hypersensitivity reactions. Medications for the treatment of hypersensitivity reactions (e.g. acetaminophen antihistamines corticosteroids et/or epinephrine) should be available for immediate use in the event of a reaction [see Posologie et administration et Effets indésirables ].
Dans les essais cliniques RA CD et PS, la ré-administration de l'infliximab après une période de non-traitement a entraîné une incidence plus élevée de réactions de perfusion par rapport au traitement d'entretien régulier [voir Effets indésirables ]. In general the benefit-risk of re-annonceministration of Infliximab after a period of no-treatment especially as a re-induction regimen given at weeks 0 2 et 6 should be carefully considered. In the case where Infliximab maintenance therapy for Ps is interrupted Infliximab should be reinitiated as a single dose followed by maintenance thérapie.
Réactions cardiovasculaires et cérébrovasculaires pendant et après la perfusion
ACCIDENTS DÉRIQUES DÉRIQUES DU CÉRÉBROVASCULS ISCHÉMIE / INFARCTION (Une certaine arythmie de l'hypotension mortelle) et des arythmies ont été signalées pendant et dans les 24 heures suivant l'initiation de la perfusion de l'infliximab. Des cas de perte visuelle transitoire ont été signalés pendant ou dans les 2 heures suivant la perfusion de l'infliximab. Surveiller les patients pendant la perfusion et si une réaction grave se produit arrête la perfusion. Une gestion plus approfondie des réactions devrait être dictée par des signes et symptômes [voir Effets indésirables ].
Réactions neurologiques
Infliximab et other agents that inhibit TNF have been associated with CNS manifestation of systemic vascularite seizure et new onset or exacerbation of clinical symptoms et/or rannonceiographic evidence of central nervous system demyelinating disorders including sclérose en plaques et optic neuritis et peripheral demyelinating disorders including Guillain-Barré syndrome. Prescribers should exercise caution in considering the use of Infliximab in patients with these neurologic disorders et should consider discontinuation of Infliximab if these disorders develop.
Administration concomitante avec d'autres produits biologiques
Des infections graves et une neutropénie ont été observées dans des études cliniques avec une utilisation simultanée d'Anakinra et un autre étanercept de bloqueur du TNF sans avantage clinique supplémentaire par rapport à l'étanercept seul. En raison de la nature des effets indésirables observés avec l'utilisation simultanée de la thérapie par étanercept et de l'anakinra, des toxicités similaires peuvent également résulter de l'utilisation simultanée d'Anakinra et d'autres bloqueurs de TNF. Par conséquent, l'utilisation simultanée de l'infliximab et de l'anakinra n'est pas recommandée.
Dans les études cliniques, l'administration simultanée de bloqueurs de TNF et d'abatacept a été associée à un risque accru d'infections, notamment des infections graves par rapport aux bloqueurs du TNF seuls sans avantage clinique accru. Par conséquent, l'utilisation simultanée de l'infliximab et de l'abatacept n'est pas recommandée [voir Interactions médicamenteuses ].
Il n'y a pas suffisamment d'informations concernant l'utilisation simultanée de l'infliximab avec d'autres produits biologiques utilisés pour traiter les mêmes conditions que l'infliximab. L'utilisation concomitante de l'infliximab avec ces produits biologiques n'est pas recommandée en raison de la possibilité d'un risque accru d'infection [voir Interactions médicamenteuses ].
Commutation entre les médicaments antirhumatiques modifiant les maladies biologiques (DMARD)
Des précautions doivent être prises lors du passage d'un biologique à un autre, car le chevauchement de l'activité biologique peut encore augmenter le risque d'infection.
Auto-immunité
Le traitement avec l'infliximab peut entraîner la formation d'auto-anticorps et le développement d'un syndrome de type lupus. Si un patient développe des symptômes suggérant un syndrome de type lupus après un traitement avec un traitement à l'infliximab doit être interrompu [voir Effets indésirables ].
Vaccinations et utilisation de vaccins vivants / agents infectieux thérapeutiques
Vaccinations
Avant de déclencher l'infliximab chez les patients pédiatriques et adultes à mettre à jour les vaccinations conformément aux directives actuelles de la vaccination.
Vaccins vivants et agents infectieux thérapeutiques
Chez les patients recevant des bloqueurs de TNF, des données limitées sont disponibles sur la réponse à la vaccination avec des vaccins vivants ou sur la transmission secondaire de l'infection par les vaccins vivants. L'utilisation de vaccins vivants peut entraîner des infections cliniques, y compris les infections disséminées. L'administration simultanée de vaccins vivants avec l'infliximab n'est pas recommandée.
Les résultats mortels dus à une infection disséminée en BCG ont été signalés chez un nourrisson qui a reçu un vaccin BCG après une exposition in utero à l'infliximab. L'infliximab est connu pour traverser le placenta et a été détecté jusqu'à 6 mois après la naissance. Au moins une période d'attente de six mois après la naissance est recommandée avant l'administration de tout vaccin vivant aux nourrissons exposés in utero à l'infliximab.
D'autres utilisations d'agents infectieuses thérapeutiques tels que des bactéries atténuées vivantes (par exemple l'instillation de la vessie BCG pour le traitement du cancer) pourraient entraîner des infections cliniques, notamment les infections disséminées. Il est recommandé que les agents infectieux thérapeutiques ne soient pas donnés simultanément avec l'infliximab.
Informations de conseil des patients
Conseiller le patient ou son soignant pour lire l'étiquetage des patients approuvé par la FDA ( Guide des médicaments ).
Les patients ou leurs soignants doivent être informés des avantages et des risques potentiels de l'infliximab. Les prestataires de soins de santé devraient demander à leurs patients ou à leurs soignants de lire le guide des médicaments avant de commencer le traitement par l'infliximab et de le relire chaque fois qu'ils reçoivent une perfusion.
Infections
Informer les patients que l'infliximab augmente le risque de développer des infections graves. Instruisez les patients sur l'importance de contacter leur fournisseur de soins de santé s'ils développent des symptômes d'une infection comprenant des infections fongiques invasives de la tuberculose et une réactivation des infections du virus de l'hépatite B [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Tumeurs malignes
Tumeurs malignes have been reported among children annonceolescents et young annonceults who received treatment with TNF blockers. Patients should be counseled about the risk of lymphome et other malignancies while receiving Infliximab [see AVERTISSEMENTS AND PRÉCAUTIONS ].
Hépatotoxicité
Demandez aux patients de consulter un médecin s'ils développent des signes ou des symptômes d'hépatotoxicité (par exemple, la jaunisse) [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Insuffisance cardiaque
Demandez aux patients de consulter un médecin et de consulter leur prescripteur s'ils développent des signes ou des symptômes d'insuffisance cardiaque [voir Contre-indications et AVERTISSEMENTS AND PRÉCAUTIONS ].
Réactions hématologiques
Demandez aux patients de consulter des soins médicaux immédiats s'ils développent des signes et symptômes évolutifs de dyscrasies sanguines ou d'infection (par exemple, fièvre persistante) lors de l'infliximab [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Hypersensibilité
Conseiller aux patients de consulter des soins médicaux immédiats s'ils ressentent des symptômes de réactions d'hypersensibilité graves [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Réactions cardiovasculaires et cérébrovasculaires pendant et après la perfusion
Conseiller aux patients de consulter des soins médicaux immédiats s'ils développent des symptômes nouveaux ou aggravant des réactions cardiovasculaires et cérébrovasculaires qui ont été signalées pendant et dans les 24 heures suivant l'initiation de la perfusion de l'infliximab [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Réactions neurologiques
Conseiller aux patients de consulter un médecin s'ils développent des signes ou des symptômes de réactions neurologiques [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Vaccins en direct / agents infectieux thérapeutiques
Instruire les patients traités à l'infliximab pour éviter de recevoir des vaccins vivants ou des agents infectieux thérapeutiques [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Toxicologie non clinique
Carcinogenèse Mutagenèse A trouble de la fertilité
Une étude de 6 mois chez les souris CD-1 a été menée pour évaluer le potentiel tumorigène du TNFα anti-souris CV1Q un analogue analogue. Aucune preuve de tumorigénicité n'a été observée chez la souris qui a reçu des doses intraveineuses de 10 mg / kg ou 40 mg / kg CV1Q données chaque semaine. La pertinence de cette étude pour le risque humain est inconnue. Aucune altération de la fertilité ou des indices de performance reproductive n'a été observée chez des souris mâles ou femelles qui ont reçu CV1Q un analogue analogue à des doses de souris à des doses intraveineuses jusqu'à 40 mg / kg de chaque semaine.
Utiliser dans des populations spécifiques
Grossesse
Résumé des risques
Les études d'observation disponibles chez les femmes enceintes exposées à l'infliximab n'ont montré aucun risque accru de malformations majeures parmi les naissances vivantes par rapport à celles exposées à des non-biologiques. Cependant, les résultats sur d'autres résultats de naissance et maternels n'étaient pas cohérents dans les études de la conception et de la conduite de l'étude différentes (voir Données ).
Les anticorps monoclonaux tels que l'infliximab sont transférés à travers le placenta au cours du troisième trimestre de la grossesse et peuvent affecter la réponse immunitaire chez le nourrisson exposé in utero (voir Considérations cliniques ). Because infliximab does not cross-react with TNFα in species other than humans et chimpanzees animal reproduction studies have not been conducted with Infliximab. In a developmental study conducted in mice using an analogous antibody no evidence of maternal toxicity or fetal harm was observed (see Données ).
Toutes les grossesses ont un risque de fond de délai de congédiement perte ou d'autres résultats négatifs.
Le risque de fond estimé des principaux malformations congénitales et une fausse couche pour les populations indiquées est inconnue. Dans la population générale américaine, les risques de fond estimés des principaux malformations congénitales et une fausse couche dans les grossesses cliniquement reconnues sont respectivement de 2 à 4% et 15 à 20%.
Considérations cliniques
Risque maternel et / ou embryonnaire associé à la maladie
Les données publiées suggèrent qu'il existe un risque accru de résultats indésirables de la grossesse chez les femmes atteintes d'une maladie inflammatoire de l'intestin ou de la polyarthrite rhumatoïde associée à une activité accrue de la maladie. Les résultats défavorables de la grossesse comprennent l'accouchement prématuré (avant 37 semaines de gestation) un faible poids à la naissance (moins de 2,5 kg) et petit pour l'âge gestationnel à la naissance.
Réactions indésirables fœtales / néonatales
Comme pour les autres anticorps IgG, l'infliximab traverse le placenta. L'infliximab a été détecté dans le sérum des nourrissons jusqu'à 6 mois après la naissance. Par conséquent, ces nourrissons peuvent courir un risque accru d'infection, y compris une infection disséminée qui peut devenir mortelle. Au moins une période d'attente de six mois après la naissance est recommandée avant l'administration de vaccins vivants (par exemple, le vaccin BCG ou d'autres vaccins vivants tels que le vaccin contre le rotavirus) à ces nourrissons [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. Cases of Agranulocytisie in infants exposed in utero have also been reported [see Effets indésirables ].
Données
Données humaines
Deux études de cohorte prospectives ont été menées en évaluant les résultats de la naissance ainsi que l'état de santé des nourrissons jusqu'à l'âge d'un an chez les femmes exposées à l'infliximab par rapport aux comparateurs non biologiques, y compris le méthotrexate azathioprine 6-mercaptopurine et les corticostéroïdes systémiques utilisés pour le traitement de maladies similaires. La première étude a été menée dans un registre de grossesse des MII aux États-Unis et a évalué les résultats de la grossesse chez 294 femmes atteintes d'une maladie inflammatoire de l'intestin exposée à l'infliximab pendant la grossesse, contre 515 femmes sous traitement non biologique. L'exposition à l'infliximab n'a pas été associée à des taux accrus de malformations congénitales majeures pour les nourrissons de malformations / mortinaissances de faible poids à la naissance faible pour l'âge ou l'infection gestationnelle au cours de la première année de vie. La deuxième étude parmi les patients atteints de MII et les non-IBD en Suède en Finlande et au Danemark a comparé 97 7 et 166 femmes exposées à l'infliximab à 2693 2499 et 1268 femmes en thérapie systémique non biologique respectivement. Dans cette étude, la comparaison des données groupées dans les trois pays, l'exposition à l'infliximab n'était pas associée à des taux accrus d'anomalies congénitales ou de décès du nourrisson. L'infliximab en combinaison avec des immunosuppresseurs (principalement des corticostéroïdes systémiques et de l'azathioprine) a été associé à des taux accrus de naissance prématurée petits pour l'âge gestationnel faible poids à la naissance et à l'hospitalisation du nourrisson pour l'infection par rapport au traitement systémique non biologique. Bien que l'étude n'ait montré aucune association avec la monothérapie par l'infliximab, les analyses auraient pu être sous-alimentées pour détecter une association.
Il y avait des limites méthodologiques supplémentaires avec ces études qui peuvent expliquer les résultats de l'étude dans les deux études: l'utilisation concomitante d'autres médicaments ou traitements n'a pas été contrôlée et la gravité de la maladie n'a pas été évaluée; Aux États-Unis, le patient a signalé que des résultats ont été collectés sans validation clinique. Ces limitations méthodologiques entravent l'interprétation des résultats de l'étude.
Données sur les animaux
Étant donné que les produits de l'infliximab ne réagissent pas avec le TNFα chez les espèces autres que les humains et les chimpanzés des études de reproduction animale n'ont pas été menées avec l'infliximab. Une étude de développement embryofétal a été réalisée chez des souris enceintes en utilisant un analogue analogue CV1Q anti-souris, un analogue qui inhibe sélectivement l'activité fonctionnelle du TNFα de souris. Cet anticorps administré chez la souris pendant la période d'organogenèse les jours de gestation (GDS) 6 et 12 à des doses IV jusqu'à 40 mg / kg n'a produit aucune preuve de la mortalité fœtale de la toxicité maternelle ou des anomalies structurelles. Des doses de 10 à 15 mg / kg dans des modèles animaux pharmacodynamiques avec l'anticorps analogue anti-TNF ont produit une efficacité pharmacologique maximale. Les analyses des échantillons fœtaux sur GD 14 ont indiqué le transfert placentaire de l'anticorps et l'exposition des fœtus pendant l'organogenèse. Dans une étude de développement péri-et post-natal chez la souris, aucune toxicité maternelle ou effets de développement défavorables chez la progéniture n'a été observée lorsque les barrages ont été administrés des doses IV de 10 ou 40 mg / kg de l'anticorps analogue sur le GDS 6 12 et 18 et les jours de lactation 3 9 et 15.
Lactation
Résumé des risques
La littérature publiée montre que l'infliximab est présent à de faibles niveaux dans le lait maternel. L'exposition systémique chez un nourrisson allaité devrait être faible car l'infliximab est largement dégradé dans le tractus gastro-intestinal. Une étude multicentrique américaine de 168 femmes traitées par l'infliximab pour une maladie inflammatoire de l'intestin (échantillons de lait maternel obtenus n = 29) a montré que les nourrissons exposés à l'infliximab à travers le lait maternel n'avaient aucune augmentation des taux d'infection et se sont développés normalement. Il n'y a pas de données sur les effets de l'infliximab sur la production de lait. Les avantages du développement et de la santé de l'allaitement doivent être pris en compte avec le besoin clinique de la mère de l'infliximab et de tout effet négatif potentiel sur l'enfant allaité de l'infliximab ou de l'état maternel sous-jacent.
Usage pédiatrique
La sécurité et l'efficacité de l'infliximab ont été établies chez des patients pédiatriques de 6 à 17 ans pour le traitement d'induction et d'entretien de la CD et de la CD [voir Posologie et administration et Effets indésirables ]. However the safety et effectiveness of Infliximab in pediatric patients <6 years of age with CD or UC have not been established. The safety et effectiveness of Infliximab in the treatment of pediatric patients with Ps et juvenile polyarthrite rhumatoïde (JRA) have not been established.
Maladie pédiatrique de Crohn
La sécurité et l'efficacité de l'infliximab ont été établies pour réduire les signes et les symptômes et induire et maintenir une rémission clinique chez les patients pédiatriques de 6 ans et plus avec un CD modérément à gravement actif qui a eu une réponse inadéquate à la thérapie conventionnelle. L'utilisation de l'infliximab pour cette indication est étayée par des preuves d'une étude de CD pédiatrique en ouverture randomisée chez 112 patients pédiatriques âgés de 6 ans et plus [voir Études cliniques ].
Infliximab has been studied only in combination with conventional immunosuppressive therapy in pediatric CD. The longer term (greater than 1 year) safety et effectiveness of Infliximab in pediatric CD patients have not been established in clinical trials.
Des cas de commercialisation de la post-commercialisation de HSTCL ont été signalés chez les patients pédiatriques traités par des bloqueurs TNF, y compris l'infliximab. En raison du risque de HSTCL, une évaluation minutieuse du risque-avantage doit être effectuée lorsque l'infliximab est utilisé en combinaison avec d'autres immunosuppresseurs chez les patients atteints de CD pédiatrique [voir Avertissement en boîte AVERTISSEMENTS AND PRÉCAUTIONS ].
Colite ulcéreuse pédiatrique
La sécurité et l'efficacité de l'infliximab pour la réduction des signes et des symptômes et de l'inducteur et du maintien d'une rémission clinique chez les patients pédiatriques âgés de 6 ans et plus avec une CU modérément à sévère active qui a eu une réponse inadéquate à la thérapie conventionnelle. L'utilisation de l'infliximab pour cette indication est étayée par des preuves d'études adéquates et bien contrôlées sur l'infliximab chez les adultes présentant des données supplémentaires sur la sécurité et la pharmacocinétique d'une étude UC pédiatrique ouverte chez 60 patients pédiatriques âgés de 6 ans et plus [voir [voir Posologie et administration Effets indésirables et Études cliniques ]. The effectiveness of Infliximab in inducing et maintaining mucosal healing in pediatric UC was not established. Although 41 patients hannonce a Mayo endoscopy subscore of 0 or 1 at the Semaine 8 endoscopy the induction phase was open-label et lacked a control group. Only 9 patients hannonce an optional endoscopy at Semaine 54. Approximately half of the patients were on concomitant immunomodulators (AZA 6-MP MTX) at study start.
En raison du risque de HSTCL, une évaluation minutieuse des risques-avantages doit être effectuée lorsque l'infliximab est utilisé en combinaison avec d'autres immunosuppresseurs chez les patients atteints de CU pédiatrique [voir Avertissement en boîte et AVERTISSEMENTS AND PRÉCAUTIONS ].
La sécurité et l'efficacité à plus long terme (plus d'un an) et l'efficacité de l'infliximab chez les patients atteints de CU pédiatrique n'ont pas été établies dans les essais cliniques.
Polyarthrite rhumatoïde juvénile (JRA)
La sécurité et l'efficacité de l'infliximab dans le traitement des patients pédiatriques atteints de polyarthrite rhumatoïde juvénile (JRA) n'ont pas été établies.
L'innocuité et l'efficacité de l'infliximab chez les patients atteints de JRA ont été évaluées dans une étude en double aveugle à double aveugle contrôlée par placebo multicentrique pendant 14 semaines, suivie d'une extension de traitement en double aveugle pendant un maximum de 44 semaines. Les patients atteints de JRA actifs âgés de 4 à 17 ans qui avaient été traités avec MTX pendant au moins 3 mois ont été inscrits. L'utilisation concomitante des corticostéroïdes oraux d'acide folique (≤0,2 mg / kg / jour de prednisone ou équivalent) AINS et / ou de médicaments antihumatiques modifiant la maladie (DMARD) a été autorisé.
Des doses d'infliximab ou d'un placebo de 3 mg / kg ont été administrées par voie intraveineuse aux semaines 0 2 et 6. Les patients randomisés pour un placebo croisé pour recevoir 6 mg / kg d'infliximab aux semaines 14 et 20, puis toutes les 8 semaines jusqu'à la semaine 44.
L'étude n'a pas réussi à établir l'efficacité de l'infliximab dans le traitement de la JRA. Les principales observations de l'étude comprenaient un taux de réponse placebo élevé et un taux d'immunogénicité plus élevé que ce qui a été observé chez les adultes. De plus, un taux de clairance plus élevé de l'infliximab a été observé que ce qui avait été observé chez les adultes.
L'analyse pharmacocinétique de la population a montré que chez les patients pédiatriques atteints de JRA avec un poids corporel allant jusqu'à 35 kg recevant 6 mg / kg d'infliximab et des patients pédiatriques atteints de JRA avec un poids corporel supérieur à 35 kg jusqu'à l'adulte poids corporel recevant 3 mg / kg d'infliximab.
Au total, 60 patients atteints de JRA ont été traités avec des doses de 3 mg / kg et 57 patients ont été traités avec des doses de 6 mg / kg. La proportion de patients présentant des réactions de perfusion qui a reçu 3 mg / kg d'infliximab était de 35% (21/60) sur 52 semaines, contre 18% (10/57) chez les patients qui ont reçu 6 mg / kg sur 38 semaines. Les réactions de perfusion les plus courantes rapportées étaient les maux de tête et l'hypotension de la fièvre des vomissements. Dans les 3 mg / kg d'infliximab, le groupe 4, les patients ont eu une réaction de perfusion grave et 3 patients ont signalé une réaction anaphylactique possible (dont 2 faisaient partie des réactions de perfusion graves). Dans les 6 mg / kg d'infliximab, le groupe 2, les patients ont eu une réaction de perfusion grave 1 dont une réaction anaphylactique possible. Deux des 6 patients qui ont connu des réactions de perfusion graves ont reçu l'infliximab par perfusion rapide (durée de moins de 2 heures). Les anticorps contre l'infliximab se sont développés chez 38% (20/53) des patients qui ont reçu 3 mg / kg d'infliximab contre 12% (6/49) des patients qui ont reçu 6 mg / kg.
Au total, 68% (41/60) des patients qui ont reçu 3 mg / kg d'infliximab en combinaison avec du MTX ont connu une infection de plus de 52 semaines, contre 65% (37/57) des patients qui ont reçu 6 mg / kg d'infliximab en combinaison avec du MTX sur 38 semaines. Les infections les plus couramment rapportées étaient l'infection des voies respiratoires supérieures et la pharyngite et l'infection grave la plus souvent signalée était la pneumonie. D'autres infections notables comprenaient une infection primitive de varicelle chez 1 patient et zoster de l'herpès chez 1 patient.
Utilisation gériatrique
Sur le nombre total de patients traités par l'infliximab dans les études cliniques RA et PS, 256 (9,6%) avaient 65 ans et plus tandis que 17 (0,6%) avaient 75 ans et plus. Dans ces essais, aucune différence globale de sécurité ou d'efficacité n'a été observée entre les patients gériatriques (patients ≥ 65 ans) et les patients adultes plus jeunes (patients de 18 à 65 ans). Cependant, l'incidence des effets indésirables graves chez les patients gériatriques était plus élevé dans les groupes inflixiab et témoins par rapport aux patients adultes plus jeunes.
Sur le nombre total de patients traités par l'infliximab dans les études cliniques AS et PSA, 76 (3,2%) étaient âgées de 65 ans et plus tandis que 9 (0,4%) avaient 75 ans et plus. Dans les études CD UC AS et PSA, il n'y avait pas un nombre insuffisant de patients gériatriques pour déterminer s'ils réagissent différemment des adultes plus jeunes.
L'incidence des infections graves chez les patients gériatriques traités à l'infliximab était plus élevé que chez les patients adultes plus jeunes traités par l'infliximab; Par conséquent, une surveillance étroite des patients gériatriques pour le développement d'infections graves est recommandée [voir AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
Informations sur la surdose pour Remicade
Des doses uniques allant jusqu'à 20 mg / kg ont été administrées sans aucun effet toxique direct. En cas de surdosage, il est recommandé de surveiller le patient pour tout signe ou symptôme de réactions indésirables ou d'effets [voir AVERTISSEMENTS AND PRÉCAUTIONS ] et un traitement symptomatique approprié institué immédiatement.
Contre-indications pour Remicade
L'utilisation de l'infliximab à des doses> 5 mg / kg est contre-indiquée chez les patients souffrant d'insuffisance cardiaque modérée ou sévère [voir AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
Infliximab is contraindicated in patients with a previous severe hypersensitivity reaction to infliximab or any of the inactive ingredients of Infliximab or any murine proteins [severe hypersensitivity reactions have included anaphylaxis hypotension et serum sickness] [see AVERTISSEMENTS AND PRÉCAUTIONS et Effets indésirables ].
Pharmacologie clinique for Remicannoncee
Mécanisme d'action
Infliximab neutralizes the biological activity of TNFα by binding with high affinity to the soluble et transmembrane forms of TNFα et inhibits binding of TNFα with its receptors. Infliximab does not neutralize TNFβ (lymphotoxin-α) a related cytokine that utilizes the same receptors as TNFα. Biological activities attributed to TNFα include: induction of pro-inflammatory cytokines such as interleukins (IL) 1 et 6 enhancement of leukocyte migration by increasing endothelial layer permeability et expression of annoncehesion molecules by endothelial cells et leukocytes activation of neutrophil et eosinophil functional activity induction of acute phase reactants et other liver proteins as well as tissue degrannonceing enzymes produced by synoviocytes et/or chondrocytes. Cells expressing transmembrane TNFα bound by infliximab can be lysed in vitro or in vivo. Infliximab inhibits the functional activity of TNFα in a wide variety of in vitro bioassays utilizing human fibroblasts endothelial cells neutrophils B et T-lymphocytes et epithelial cells. The relationship of these biological response markers to the mechanism(s) by which Infliximab exerts its clinical effects is unknown. Anti-TNFα antibodies reduce disease activity in the cotton -top tamarin colitis model et decrease synovitis et joint erosions in a murine model of collagen-induced arthritis. Infliximab prevents disease in transgenic mice that develop polyarthritis as a result of constitutive expression of human TNFα et when annonceministered after disease onset allows eroded joints to heal.
Pharmacodynamique
Des concentrations élevées de TNFα ont été trouvées dans les tissus et les fluides impliqués des patients atteints de PR CD UC comme PSA et PS. Dans le traitement RA avec l'infliximab a réduit l'infiltration des cellules inflammatoires en zones enflammées de l'articulation ainsi que l'expression de molécules médiatrices de l'adhésion cellulaire [molécule d'adhésion intercellulaire E-sélectine-1 (VCAM-1) et de la chimiotactique de la mcp-1) et de la mcp-1) et de la mcp-1. [Matrix Metalloproteinase (MMP) 1 et 3]. Dans le traitement CD avec l'infliximab, une infiltration a réduit l'infiltration des cellules inflammatoires et la production de TNFα dans des zones enflammées de l'intestin et réduit la proportion de cellules mononucléaires de la lamina propria capria capable d'exprimer le TNFα et l'interféron. Après le traitement avec des patients infliximab, avec PR ou CD, a présenté une diminution des niveaux d'IL-6 sérique et de protéine C-réactive (CRP) par rapport à la ligne de base. Les lymphocytes sanguins périphériques des patients traités par l'infliximab n'ont montré aucune diminution significative du nombre ou des réponses prolifératives à une stimulation mitogène in vitro par rapport aux cellules de patients non traités. Dans le traitement du PSA avec l'infliximab, a entraîné une réduction du nombre de cellules T et de vaisseaux sanguins dans les lésions cutanées de synovium et psoriasiques ainsi qu'une réduction des macrophages dans la synovium. Dans le PS, le traitement à l'infliximab peut réduire l'épaisseur épidermique et l'infiltration des cellules inflammatoires. La relation entre ces activités pharmacodynamiques et les mécanismes par lesquelles l'infliximab exerce ses effets cliniques est inconnue.
Pharmacocinétique
Chez les adultes, des perfusions intraveineuses (IV) simples de 3 mg / kg à 20 mg / kg (deux fois la dose maximale recommandée pour toute indication) ont montré une relation linéaire entre la dose administrée et la concentration de sérum maximale. Le volume de distribution à l'état d'équilibre était indépendant de la dose et a indiqué que l'infliximab était distribué principalement dans le compartiment vasculaire. Les résultats pharmacocinétiques pour des doses uniques de 3 mg / kg à 10 mg / kg dans RA 5 mg / kg dans CD et 3 mg / kg à 5 mg / kg dans PS indiquent que la demi-vie médiane terminale de l'infliximab est de 7,7 à 9,5 jours.
Après une dose initiale de perfusions répétées de l'infliximab à 2 et 6 semaines, a entraîné des profils de temps de concentration prévisibles après chaque traitement. Aucune accumulation systémique d'infliximab ne s'est produite lors d'un traitement répété continu avec 3 mg / kg ou 10 mg / kg à des intervalles de 4 ou 8 semaines. Le développement d'anticorps contre l'infliximab a augmenté la clairance de l'infliximab. À 8 semaines après une dose de maintenance de 3 à 10 mg / kg de concentrations sériques d'infliximab médian infliximab, variait d'environ 0,5 à 6 mcg / ml; Cependant, les concentrations d'infliximab n'étaient pas détectables (<0.1 mcg/mL) in patients who became positive for antibodies to infliximab. No major differences in clearance or volume of distribution were observed in patient subgroups defined by age weight or gender. It is not known if there are differences in clearance or volume of distribution in patients with marked impairment of hepatic or renal function.
Infliximab pharmacokinetic characteristics (including peak et trough concentrations et terminal half-life) were similar in pediatric (aged 6 to 17 years) et annonceult patients with CD or UC following the annonceministration of 5 mg / kg of Infliximab.
Études cliniques
Maladie adulte de Crohn
Maladie active de Crohn chez l'adulte
L'innocuité et l'efficacité des doses uniques et multiples d'infliximab ont été évaluées chez 2 études cliniques randomisées en double aveugle contrôlé par un placebo chez 653 patients adultes avec un indice d'activité de la maladie (CDAI) modéré à sévèrement actif avec une réponse inadéquate à des thérapies conventionnelles antérieures. Des doses stables concomitantes de corticostéroïdes aminosalicylates et / ou d'agents immunomodulatrices ont été autorisées et 92% des patients ont continué à recevoir au moins un de ces médicaments.
Dans l'essai à dose unique de 108 patients adultes, 16% (4/25) des patients placebo ont obtenu une réponse clinique (diminution du CDAI ≥ 70 points) à la semaine 4 contre 81% (22/27) des patients recevant 5 mg / kg d'infliximab (P (P<0.001 two-sided Fisher’s Exact test). Additionally 4% (1/25) of placebo patients et 48% (13/27) of patients receiving 5 mg / kg Infliximab achieved clinical remission (CDAI<150) at Week 4.
Dans un essai multidose (accent I [Étude Crohn € ™ s i])) 545 patients adultes ont reçu 5 mg / kg à la semaine 0 et ont ensuite été randomisés pour l'un des trois groupes de traitement; Le groupe de maintenance du placebo a reçu un placebo aux semaines 2 et 6, puis toutes les 8 semaines; Le groupe d'entretien de 5 mg / kg a reçu 5 mg / kg aux semaines 2 et 6, puis toutes les 8 semaines; et le groupe de maintenance de 10 mg / kg a reçu 5 mg / kg aux semaines 2 et 6 puis 10 mg / kg toutes les 8 semaines. Les patients en réponse à la semaine 2 ont été randomisés et analysés séparément de ceux qui n'étaient pas en réponse à la semaine 2. Le compilage corticostéroïde a été autorisé après la semaine 6.
À la semaine 2, 57% (311/545) des patients étaient en réponse clinique. À la semaine 30, une proportion significativement plus élevée de ces patients dans les groupes d'entretien de 5 mg / kg et 10 mg / kg a obtenu une rémission clinique par rapport aux patients du groupe d'entretien du placebo (tableau 3).
De plus, une proportion significativement plus élevée de patients des groupes d'entretien de 5 mg / kg et 10 mg / kg d'infliximab étaient en rémission clinique et ont pu interrompre l'utilisation des corticostéroïdes par rapport aux patients du groupe d'entretien du placebo à la semaine 54 (tableau 3).
Tableau 3: Rémission clinique et retrait de stéroïdes chez les patients adultes atteints de CD (étude CROHN's i)
| Dose unique de 5 mg / kga | Induction à trois dosesb | ||
| Placebo Maintenance | Infliximab Maintenance Q8 semaine | ||
| 5 mg / kg | 10 mg / kg | ||
| Semaine 30 | 25/102 | 41/104 | 48/105 |
| Rémission clinique | 25% | 39% | 46% |
| Valeur pc | 0.022 | 0.001 | |
| Semaine 54 | 6/54 | 14/56 | 18/53 |
| Les patients en rémission capables de cesser l'utilisation des corticostéroïdesd | 11% | 25% | 34% |
| Valeur pc | 0.059 | 0.005 | |
| a Infliximab at Week 0 b Infliximab 5 mg / kg annonceministered at Weeks 0 2 et 6 c Valeur ps represent pairwise comparisons to placebo d Parmi ceux qui reçoivent des corticostéroïdes au départ |
Les patients des groupes d'entretien de l'infliximab (5 mg / kg et 10 mg / kg) ont eu plus de temps de perte de réponse que les patients du groupe d'entretien du placebo (figure 1). At Weeks 30 and 54 significant improvement from baseline was seen among the 5 mg/kg and 10 mg/kg Infliximab-treated groups compared to the placebo group in the disease-specific inflammatory bowel disease questionnaire (IBDQ) particularly the bowel and systemic components and in the physical component summary score of the general health-related quality of life questionnaire SF-36.
Figure 1: Estimation de Kaplan-Meier de la proportion d'adultes atteints de CD qui n'avaient pas perdu de réponse pendant la semaine 54 (étudier Crohn's i)
 |
Dans un sous-ensemble de 78 patients qui avaient une ulcération muqueuse au départ et qui ont participé à une sous-étude endoscopique, 13 patients sur 43 du groupe d'entretien de l'infliximab avaient des preuves endoscopiques de guérison muqueuse par rapport à 1 des 28 patients dans le groupe placebo à la semaine 10. Des patients atteints de la guérison des muqueuses ont également montré une guérisation muqueuse à la semaine.
Les patients qui ont obtenu une réponse et qui ont ensuite perdu la réponse étaient éligibles pour recevoir l'infliximab sur une base épisodique à une dose de 5 mg / kg de plus que la dose à laquelle ils ont été randomisés. La majorité de ces patients ont répondu à la dose plus élevée. Parmi les patients qui n'étaient pas en réponse à la semaine 2 59% (92/157) des patients d'entretien de l'infliximab ont répondu à la semaine 14, contre 51% (39/77) des patients d'entretien placebo. Parmi les patients qui n'ont pas répondu à la semaine 14, une thérapie supplémentaire n'a pas entraîné de réponses significativement plus [voir Posologie et administration ].
Fistulation de la maladie de Crohn chez les adultes
L'innocuité et l'efficacité de l'infliximab ont été évaluées dans 2 études randomisées contrôlées par placebo en double aveugle chez des patients adultes atteints de CD fistulant avec une ou des fistules qui était d'au moins 3 mois. L'utilisation concomitante de doses stables de corticostéroïdes 5-aminosalicylates antibiotiques MTX 6-mercaptopurine (6-MP) et / ou azathioprine (AZA) a été autorisée.
Dans le premier essai, 94 patients adultes ont reçu 3 doses de placebo ou d'infliximab aux semaines 0 2 et 6. Réponse de la fistule (réduction ≥50% du nombre de fistules entérocutanées drainant sur une compression douce sur au moins 2 visites consécutives sans augmentation des médicaments ou de la chirurgie pour CD) a été observé dans 68% (21/31) et 56% de 5 mg / kg Inflixabab (P = 0,002) et 56% de 5 mg / kg Inflixabab (P = 0,002) et 56% de 5 mg / kg Inflixabab (P = 0,002) et 56% de 5 mg / kg Inflixabe (18/32) des patients du groupe infliximab à 10 mg / kg (p = 0,021) contre 26% (8/31) des patients du bras du placebo. Le délai médian à l'apparition de la réponse et de la durée médiane de la réponse chez les patients traités par l'infliximab était respectivement de 2 et 12 semaines. La fermeture de toutes les fistules a été obtenue chez 52% des patients traités par l'infliximab, contre 13% des patients traités par placebo (P<0.001).
Dans le deuxième essai (accent II [étude des patients adultes de Crohn)) qui ont été inscrits devaient avoir au moins 1 fistule entérocutanée (abdominale périanale). Tous les patients ont reçu 5 mg / kg d'infliximab aux semaines 0 2 et 6. Les patients ont été randomisés dans un entretien d'infliximab de placebo ou de 5 mg / kg à la semaine 14. Les patients ont reçu des doses d'entretien à la semaine 14, puis toutes les 8 semaines à la semaine 46. Les patients qui étaient en réponse fistule (réponse de la fistule ont été définis de la même chose. Le critère d'évaluation principal était le temps de la randomisation à la perte de réponse chez les patients qui étaient en réponse à la fistule.
Parmi les patients randomisés (273 des 296 initialement inscrits), 87% avaient des fistules périanales et 14% avaient des fistules abdominales. Huit pour cent avaient également des fistules rectovaginales. Plus de 90% des patients avaient reçu une précédente immunosuppressive et antibiotique thérapie.
À la semaine 14, 65% (177/273) des patients étaient en réponse à la fistule. Les patients randomisés en entretien de l'infliximab ont eu plus de temps pour perdre la réponse de la fistule par rapport au groupe d'entretien du placebo (figure 2). À la semaine 54, 38% (33/87) des patients traités par l'infliximab n'avaient pas de fistules drainées par rapport à 22% (20/90) de patients traités par placebo (P = 0,02). Par rapport aux patients entre les emplacements du placebo, l'entretien de l'infliximab avait une tendance à moins d'hospitalisations.
Figure 2: Tableau de vie Estimations de la proportion de patients atteints de CD adulte qui n'avaient pas perdu la réponse de la fistule pendant la semaine 54 (étude Crohn's II)
 |
Les patients qui ont obtenu une réponse de la fistule et qui ont ensuite perdu la réponse étaient éligibles pour recevoir un traitement d'entretien de l'infliximab à une dose de 5 mg / kg de plus que la dose à laquelle ils ont été randomisés. Parmi les patients d'entretien du placebo, 66% (25/38) ont répondu à 5 mg / kg d'infliximab et 57% (12/21) des patients d'entretien de l'infliximab ont répondu à 10 mg / kg.
Les patients qui n'avaient pas obtenu de réponse d'ici la semaine 14 ne répondent pas à des doses supplémentaires d'infliximab.
Des proportions similaires de patients dans l'un ou l'autre groupe ont développé de nouvelles fistules (17% dans l'ensemble) et des nombres similaires ont développé des abcès (15% dans l'ensemble).
Maladie pédiatrique de Crohn
L'innocuité et l'efficacité de l'infliximab ont été évaluées dans une étude ouverte randomisée (étude PEDS Crohn) chez 112 patients pédiatriques âgés de 6 à 17 ans atteints de CD modérément à sévèrement actif et une réponse inadéquate aux thérapies conventionnelles. L'âge médian était de 13 ans et l'indice médian de l'activité de la maladie de Crohn pédiatrique (PCDAI) était de 40 (sur une échelle de 0 à 100). Tous les patients devaient être sur une dose stable d'AZA 6 MP ou de MTX; 35% recevaient également des corticostéroïdes au départ.
Tous les patients ont reçu un dosage à induction de 5 mg / kg d'infliximab aux semaines 0 2 et 6. À la semaine 10 103, les patients ont été randomisés pour un régime d'entretien de l'infliximab de 5 mg / kg étant donné toutes les 8 semaines ou toutes les 12 semaines.
À la semaine 10, 88% des patients étaient en réponse clinique (définis comme une diminution de la ligne de base dans le score PCDAI de ≥15 points et un score PCDAI total de ≤30 points) et 59% étaient en rémission clinique (définie comme un score PCDAI de ≤ 10 points).
La proportion de patients pédiatriques atteignant une réponse clinique à la semaine 10 a comparé favorablement avec la proportion d'adultes atteignant une réponse clinique dans l'étude de Crohn, la définition de l'étude de la réponse clinique dans l'étude PEDS Crohn était basée sur le score PCDAI tandis que le score CDAI a été utilisé dans le score de l'étude des adultes CROHN.
À la semaine 30 et à la semaine 54, la proportion de patients en réponse clinique était plus élevée dans le groupe de traitement de 8 semaines que dans le groupe de traitement de tous les 12 semaines (73% contre 47% à la semaine 30 et 64% contre 33% à la semaine 54). À la semaine 30 et à la semaine 54, la proportion de patients en rémission clinique était également plus élevée dans le groupe de traitement de 8 semaines que dans le groupe de traitement de 12 semaines (60% contre 35% à la semaine 30 et 56% contre 24% à la semaine 54) (tableau 4).
Pour les patients de l'étude, les PDE de Crohn reçoivent des corticostéroïdes au départ, la proportion de patients capables d'arrêter les corticostéroïdes alors qu'il était en rémission à la semaine 30 était de 46% pour le groupe d'entretien de 8 semaines et 33% pour le groupe d'entretien de toutes les 12 semaines. À la semaine 54, la proportion de patients capables d'arrêter les corticostéroïdes alors qu'il était en rémission était de 46% pour le groupe d'entretien de 8 semaines et de 17% pour le groupe d'entretien de toutes les 12 semaines.
Tableau 4: Réponse et rémission dans l'étude PEDS Crohn
| 5 mg / kg Infliximab | ||
| Toutes les 8 semaines | Toutes les 12 semaines | |
| Groupe de traitement | Groupe de traitement | |
| Patients randomisés | 52 | 51 |
| Réponse cliniquea | ||
| Semaine 30 | 73%d | 47% |
| Semaine 54 | 64%d | 33% |
| Rémission cliniqueb | ||
| Semaine 30 | 60%c | 35% |
| Semaine 54 | 56%d | 24% |
| a Défini comme une diminution de la ligne de base dans le score PCDAI ≥15 points et un score total de ≤30 points. b Défini comme un score PCDAI de ≤ 10 points. c Valeur p <0.05 d Valeur p <0.01 |
Colite ulcéreuse adulte
L'innocuité et l'efficacité de l'infliximab ont été évaluées dans 2 études cliniques randomisées à double aveugle contrôlé par placebo chez 728 patients adultes avec une UC modérément à gravement active (score de mayo de 6 à 12 [de la plage possible 0 à 12] sous-ensemble d'endoscopie ≥2) avec une réponse inadéquat aux thérapies orales conventionnelles (études UC I et UC II). Un traitement concomitant avec des doses stables d'aminosalicylates corticostéroïdes et / ou d'agents immunomodulatoires a été autorisé. Le conique de corticostéroïdes a été autorisé après la semaine 8. Les patients ont été randomisés à la semaine 0 pour recevoir un infliximab à 5 mg / kg de placebo ou 10 mg / kg d'infliximab aux semaines 0 2 6 et toutes les 8 semaines après la semaine 46 dans l'étude UC I et aux semaines 0 2 6 et toutes les 8 semaines par la semaine à la semaine 22 dans l'étude UC II. Dans l'étude, les patients UC II ont été autorisés à poursuivre la thérapie en aveugle à la semaine 46 à la discrétion de l'investigateur.
Les patients adultes en étude UC Je n'avais pas répondu ou étaient intolérants aux corticostéroïdes oraux 6-MP ou AZA. Les patients adultes de l'étude UC II n'avaient pas répondu ou étaient intolérants aux traitements ci-dessus et / ou aux aminosalicylates. Des proportions similaires de patients dans les études UC I et UC II recevaient des corticostéroïdes (61% et 51% respectivement) 6-MP / AZA (49% et 43%) et les aminosalicylates (70% et 75%) au départ. Plus de patients dans l'étude UC II que UC I prenaient uniquement des aminosalicylates pour UC (26% contre 11% respectivement). La réponse clinique a été définie comme une diminution de la ligne de base du score de Mayo de ≥30% et ≥3 points accompagnée d'une diminution du sous-sol de saignement rectal de ≥1 ou d'un sous-sol de saignement rectal de 0 ou 1.
Réponse clinique Rémission clinique And Guérison des muqueuses
Dans l'étude, UC I et l'étude UC II pour des pourcentages de patients plus élevés dans les deux groupes d'infliximab ont obtenu la rémission clinique de réponse clinique et la guérison muqueuse que dans le groupe placebo. Chacun de ces effets a été maintenu jusqu'à la fin de chaque essai (semaine 54 dans l'étude UC I et semaine 30 dans l'étude UC II). De plus, une plus grande proportion de patients dans les groupes d'infliximab a démontré une réponse soutenue et une rémission soutenue que dans les groupes placebo (tableau 5).
Des patients sous corticostéroïdes au départ de plus grandes proportions de patients adultes dans les groupes de traitement de l'infliximab étaient en rémission clinique et capables d'arrêter les corticostéroïdes à la semaine 30 par rapport aux patients des groupes de traitement placebo (22% dans les groupes de traitement de l'infliximab vs 10% dans le groupe placebo dans le groupe d'étude UC II). Dans l'étude UC I, cet effet a été maintenu au cours de la semaine 54 (21% dans les groupes de traitement de l'infliximab contre 9% dans le groupe placebo). La réponse associée à l'infliximab était généralement similaire dans les groupes de dose de 5 mg / kg et 10 mg / kg.
Tableau 5: Réponse rémission et guérison muqueuse dans les études UC adultes (études UC I et UC II)
| Étudiez UC I | Étudiez UC II | |||||
| Placebo | 5 mg / kg Infliximab | 10 mg / kg Infliximab | Placebo | 5 mg / kg Infliximab | 10 mg / kg Infliximab | |
| Patients randomisés | 121 | 121 | 122 | 123 | 121 | 120 |
| Réponse cliniqueannonce | ||||||
| Semaine 8 | 37% | 69% * | 62% * | 29% | 65% * | 69% * |
| Semaine 30 | 30% | 52% * | 51%** | 26% | 47%* | 60%* |
| Semaine 54 | 20% | 45% * | 44% * | N / A | N / A | N / A |
| Réponse soutenued | ||||||
| (Réponse clinique aux deux semaines 8 et 30) | 23% | 49%* | 46%* | 15% | 41% * | 53% * |
| (Réponse clinique aux semaines 8 30 et 54) | 14% | 39%* | 37%* | N / A | N / A | N / A |
| Rémission cliniqueb d | ||||||
| Semaine 8 | 15% | 39%* | 32%** | 6% | 34%* | 28% * |
| Semaine 30 | 16% | 34%** | 37%* | 11% | 26%** | 36% * |
| Semaine 54 | 17% | 35%** | 34%** | N / A | N / A | N / A |
| Rémission soutenued | ||||||
| (Rémission clinique aux deux semaines 8 et 30) | 8% | 23%** | 26%* | 2% | 15%* | 23%* |
| (Rémission clinique aux semaines 8 30 et 54) | 7% | 20%** | 20%** | N / A | N / A | N / A |
| Guérison des muqueusesCD | ||||||
| Semaine 8 | 34% | 62% * | 59% * | 31% | 60%* | 62% * |
| Semaine 30 | 25% | 50%* | 49%* | 30% | 46%** | 57% * |
| Semaine 54 | 18% | 45% * | 47%* | N / A | N / A | N / A |
| * P<0.001** P<0.01 a Défini comme une diminution de la ligne de base dans le score de mayo de ≥30% et ≥3 points accompagnés d'une diminution du sous-sol de saignement rectal de ≥1 ou d'un sous-sol de saignement rectal de 0 ou 1. (Le score de la mayo est constitué de l'évaluation globale et des découvertes de la fréquence des tabourets). b Défini comme un score de mayo ≤ 2 points aucun sous-sol individuel> 1. c Défini comme un 0 ou 1 sur le sous-score d'endoscopie du score Mayo. d Les patients qui ont eu un changement interdit de médicament avaient une stomie ou une colectomie ou des perfusions d'étude interrompus en raison du manque d'efficacité sont considérés comme ne sont pas en réponse clinique en rémission clinique ou en guérison muqueuse à partir du moment de l'événement. |
L'amélioration de l'infliximab était cohérente dans tous les sous-scores de Mayo au cours de la semaine 54 (étude UC I montrée dans le tableau 6; l'étude UC II à la semaine 30 était similaire).
Tableau 6: Proportion de patients atteints de CU adulte dans l'étude UC I avec des sous-scores de mayo indiquant une maladie inactive ou légère pendant la semaine 54
| Étudiez UC I | |||
| Placebo (n = 121) | Infliximab | ||
| 5 mg / kg (n = 121) | 10 mg / kg (n = 122) | ||
| Fréquence des selles | |||
| Base de base | 17% | 17% | 10% |
| Semaine 8 | 35% | 60% | 58% |
| Semaine 30 | 35% | 51% | 53% |
| Semaine 54 | 31% | 52% | 51% |
| Saignement rectal | |||
| Base de base | 54% | 40% | 48% |
| Semaine 8 | 74% | 86% | 80% |
| Semaine 30 | 65% | 74% | 71% |
| Semaine 54 | 62% | 69% | 67% |
| Évaluation mondiale du médecin | |||
| Base de base | 4% | 6% | 3% |
| Semaine 8 | 44% | 74% | 64% |
| Semaine 30 | 36% | 57% | 55% |
| Semaine 54 | 26% | 53% | 53% |
| Résultats de l'endoscopie | |||
| Base de base | 0% | 0% | 0% |
| Semaine 8 | 34% | 62% | 59% |
| Semaine 30 | 26% | 51% | 52% |
| Semaine 54 | 21% | 50% | 51% |
Colite ulcéreuse pédiatrique
La sécurité et l'efficacité de l'infliximab pour réduire les signes et symptômes et induire et maintenir une rémission clinique chez les patients pédiatriques âgés de 6 ans et plus avec une CU modérément à gravement active qui a eu une réponse inadéquate à la thérapie conventionnelle est étayée par des preuves d'études adéquates et bien contrôlées sur l'inflixiabe chez les adultes. Des données supplémentaires sur la sécurité et la pharmacocinétique ont été collectées dans un essai UC pédiatrique ouvert chez 60 patients pédiatriques âgés de 6 à 17 ans (âgée médiane de 14,5 ans) avec UC modérément à gravement actif (score de mayo de 6 à 12; sous-ensemble endoscopique ≥2) et une réponse inadéquate aux thérapies conventionnelles. Au départ, le score médian de la mayo était de 8 53% des patients recevaient un traitement par immunomodulateur (6-MP / AZA / MTX) et 62% des patients recevaient des corticostéroïdes (dose médiane de 0,5 mg / kg / jour dans les équivalents de prednisone). L'arrêt des immunomodulateurs et du cône de corticostéroïdes a été autorisé après la semaine 0.
Tous les patients ont reçu un dosage à induction de 5 mg / kg d'infliximab aux semaines 0 2 et 6. Les patients qui n'ont pas répondu à l'infliximab à la semaine 8 n'ont reçu aucun autre infliximab et sont retournés pour le suivi de la sécurité. À la semaine 8, 45 patients ont été randomisés pour un régime d'entretien de l'infliximab de 5 mg / kg, étant donné toutes les 8 semaines à la semaine 46 ou toutes les 12 semaines à la semaine 42. Les patients ont été autorisés à passer à un calendrier d'administration de dose plus élevé et / ou plus fréquent s'ils subissaient une perte de réponse.
La réponse clinique à la semaine 8 a été définie comme une diminution de la ligne de base dans le score de mayo de ≥30% et ≥3 points, y compris une diminution du sous-sol de saignement rectal de ≥1 points ou une réalisation d'un sous-sol de saignement rectal de 0 ou 1.
La rémission clinique à la semaine 8 a été mesurée par le score de mayo défini comme un score de mayo de ≤2 points sans sous-score individuel> 1. La rémission clinique a également été évaluée à la semaine 8 et à la semaine 54 en utilisant l'indice d'activité de colite ulcéreuse pédiatrique (PUCAI)1 score et a été défini par un score Pucai de <10 points.
Des endoscopies ont été effectuées au départ et à la semaine 8. Un sous-sol d'endoscopie de Mayo de 0 a indiqué une maladie normale ou inactive et un sous-sol de 1 maladie légère indiquée (érythème a diminué le schéma vasculaire ou la friabilité légère).
Sur les 60 patients traités 44 étaient en réponse clinique à la semaine 8. Des 32 patients prenant des immunomodulateurs concomitants au départ 23 ont obtenu une réponse clinique à la semaine 8, contre 21 sur 28 de ceux qui ne prenaient pas d'immunomodulateurs concomitants au départ. À la semaine 8, 24 patients sur 60 étaient en rémission clinique, mesuré par le score Mayo et 17 des 51 patients étaient en rémission, mesurés par le score PUCAI.
À la semaine 54 8 sur 21 patients du groupe d'entretien de 8 semaines et 4 des 22 patients dans le groupe d'entretien de toutes les 12 semaines ont atteint la rémission, mesurée par le score PUCAI.
Pendant la phase d'entretien, 23 sur 45 patients randomisés (9 dans le groupe de 8 semaines et 14 dans le groupe toutes les 12 semaines) ont nécessité une augmentation de leur dose et / ou une augmentation de la fréquence de l'administration de l'infliximab en raison de la perte de réponse. Neuf des 23 patients qui ont besoin d'un changement de dose avaient atteint la rémission à la semaine 54. Sept de ces patients ont reçu le dose de 10 mg / kg toutes les 8 semaines.
Polyarthrite rhumatoïde
L'innocuité et l'efficacité de l'infliximab chez les patients adultes atteints de PR ont été évaluées dans 2 essais pivots en double aveugle randomisés multicentriques: attirer (étude RA I) et Aspire (étude RA II). L'utilisation concomitante de doses stables de corticostéroïdes orales d'acide folique (≤ 10 mg / jour) et / ou les anti-inflammatoires non stéroïdiens (AINS) a été autorisé.
Étude RA I était une étude contrôlée par placebo de 428 patients atteints de PR active malgré le traitement par MTX. Les patients inscrits avaient un âge médian de 54 ans de la durée médiane de la maladie de 8,4 ans gonflée et un nombre d'articulations tendres de 20 et 31 respectivement et étaient sur une dose médiane de 15 mg / semaine de MTX. Les patients ont reçu soit un placebo MTX ou l'une des 4 doses / calendriers de l'infliximab MTX: 3 mg / kg ou 10 mg / kg d'infliximab par perfusion IV aux semaines 0 2 et 6 suivies de perfusions supplémentaires toutes les 4 ou 8 semaines en combinaison avec MTX.
L'étude RA II était une étude contrôlée par placebo sur 3 bras de traitement actif chez 1004 patients naïfs de MTX de 3 ans ou moins de la Durée de la PR. Les patients inscrits avaient un âge médian de 51 ans avec une durée médiane de la maladie de 0,6 ans, le nombre d'articulations gonflé et tendre de 19 et 31 ans respectivement et> 80% des patients avaient des érosions articulaires de base. À la randomisation, tous les patients ont reçu du MTX (optimisé à 20 mg / semaine d'ici la semaine 8) et soit un placebo 3 mg / kg ou 6 mg / kg d'infliximab aux semaines 0 2 et 6 et toutes les 8 semaines par la suite.
Données on use of Infliximab without concurrent MTX are limited [see Effets indésirables ].
Réponse clinique
Dans l'étude, toutes les doses / calendriers de l'infliximab MTX ont entraîné une amélioration des signes et symptômes, mesuré par l'American College of Rhumatology Response Critères (ACR 20) avec un pourcentage plus élevé de patients atteignant un ACR 20 50 et 70 par rapport au placebo MTX (tableau 7). Cette amélioration a été observée à la semaine 2 et maintenue au cours de la semaine 102. Des effets plus importants sur chaque composant de l'ACR 20 ont été observés chez tous les patients traités par l'infliximab MTX par rapport au placebo MTX (tableau 8). Plus de patients traités par l'infliximab ont atteint une réponse clinique majeure que les patients traités par placebo (tableau 7).
Dans l'étude, Ra II après 54 semaines de traitement, les deux doses d'infliximab MTX ont entraîné une réponse statistiquement significativement plus importante dans les signes et symptômes par rapport au MTX seul, mesuré par la proportion de patients atteignant l'ACR 20 50 et 70 réponses (tableau 7). Plus de patients traités par l'infliximab ont atteint une réponse clinique majeure que les patients traités par placebo (tableau 7).
Tableau 7: Réponse de l'ACR (pourcentage des patients) chez les patients atteints de PR adulte (études RA I et RA II)
| Réponse | Étude RA I | Étude RA II | ||||||
| Placebo+ MTX (n = 88) | Infliximab+MTX | Placebo+ MTX (n = 274) | Infliximab+MTX | |||||
| 3 mg / kg | 10 mg / kg | 3 mg / kgq 8 wks (n = 351) | 6 mg / kgq 8 semaines (n = 355) | |||||
| Q8 semaine (n = 86) | Q4 semaine (n = 86) | Q8 semaine (n = 87) | Q4 semaine (n = 81) | |||||
| ACR 20 | ||||||||
| Semaine 30 | 20% | 50%a | 50%y | 52%y | 58%a | N / A | N / A | N / A |
| Semaine 54 | 17% | 42%a | 48%y | 59%y | 59%a | 54% | 62%c | 66%a |
| ACR 50 | ||||||||
| Semaine 30 | 5% | 27%a | 29%y | 31%y | 26%a | N / A | N / A | N / A |
| Semaine 54 | 9% | 21%c | 34%y | 40%y | 38%a | 32% | 46%a | 50%a |
| ACR 70 | ||||||||
| Semaine 30 | 0% | 8%b | 11%b | 18%y | 11%a | N / A | N / A | N / A |
| Semaine 54 | 2% | 11%c | 18%a | 26%y | 19%a | 21% | 33%b | 37%a |
| Réponse clinique majeure | 0% | 7%c | 8%b | 15%a | 6%c | 8% | 12% | 17%a |
| a P≤0,001 b P<0.01 c P<0.05 |
Tableau 8: Composants de l'ACR 20 au départ et 54 semaines (étude RA I)
| Paramètre (médians) | Placebo+MTX (n = 88) | Infliximab+MTXa (n = 340) | ||
| Base de base | Semaine 54 | Base de base | Semaine 54 | |
| Nombre d'articulations tendres | 24 | 16 | 32 | 8 |
| Nombre d'articulations gonflées | 19 | 13 | 20 | 7 |
| Douleurb | 6.7 | 6.1 | 6.8 | 3.3 |
| Évaluation mondiale du médecinb | 6.5 | 5.2 | 6.2 | 2.1 |
| Évaluation globale du patientb | 6.2 | 6.2 | 6.3 | 3.2 |
| Indice de handicap (HAQ-D)c | 1.8 | 1.5 | 1.8 | 1.3 |
| CRP (Mg / DL) | 3.0 | 2.3 | 2.4 | 0.6 |
| a Toutes les doses / horaires de l'infliximab MTX b Échelle visuelle analogique (0 = meilleur 10 = pire) cQuestion d'évaluation de la santé Mesure de 8 catégories: s'habiller et toiletter sur la notoriété hygiène de marche de la marche et activités (0 = meilleur 3 = pire) |
Réponse radiographique
Les dommages structurels dans les mains et les pieds ont été évalués radiographiquement à la semaine 54 par le changement par rapport à la ligne de base dans le score Sharp (VDH-S) modifié par Van der Heijde (VDH-S) Un score composite de dommages structurels qui mesure le nombre et la taille des érosions articulaires et le degré de rétrécissement de l'espace conjoint dans les mains / bracelets et les pieds.
Dans l'étude RA I, environ 80% des patients avaient des données de rayons X appariées à 54 semaines et environ 70% à 102 semaines. L'inhibition de la progression des dommages structurels a été observée à 54 semaines (tableau 9) et maintenue pendant 102 semaines.
Dans l'étude RA II> 90% des patients avaient au moins 2 rayons X évaluables. L'inhibition de la progression des dommages structurels a été observée aux semaines 30 et 54 (tableau 9) dans les groupes MTX infliximab par rapport au MTX seul. Les patients traités par l'infliximab MTX ont démontré une progression moindre des dommages structurels par rapport au MTX seul, que les réactifs de base en phase aiguë (ESR et CRP) étaient normaux ou élevés: les patients avec des réactifs en phase aiguë de base élevés traités avec MTX seul ont démontré une progression moyenne dans le score VDH-S de 4,2 unités par rapport aux patients traités par l'inflimab. Les patients avec des réactifs de phase aiguë de base normaux traités avec du MTX seuls ont démontré une progression moyenne dans le score VDH-S de 1,8 unités par rapport à l'infliximab MTX qui a démontré 0,2 unités de progression. Parmi les patients recevant l'infliximab MTX, 59% n'avaient pas de progression (score VDH-S ≤0 unité) de dommages structurels contre 45% des patients recevant du MTX seul. Dans un sous-ensemble de patients qui ont commencé l'étude sans érosions, l'infliximab MTX a maintenu un état sans érosion à 1 an dans une proportion plus élevée de patients que le MTX seul à 79% (77/98) contre 58% (23/40) (P (P<0.01). Fewer patients in the Infliximab+MTX groups (47%) developed erosions in uninvolved joints compared to MTX alone (59%).
Tableau 9: Changement radiographique de la ligne de base à la semaine 54 chez les patients atteints de PR adulte (études RA I et RA II)
| Étude RA I | Étude RA II | |||||
| Placebo+MTX (n = 64) | Infliximab+MTX | Placebo+MTX (n = 282) | Infliximab+MTX | |||
| 3 mg / kg Q8 semaine (n = 71) | 10 mg / kg Q8 semaine (n = 77) | 3 mg / kg Q8 semaine (n = 359) | 6 mg / kg Q8 semaine (n = 363) | |||
| Score total | ||||||
| Base de base | ||||||
| Signifier | 79 | 78 | 65 | 11.3 | 11.6 | 11.2 |
| Médian | 55 | 57 | 56 | 5.1 | 5.2 | 5.3 |
| Changement de la ligne de base | ||||||
| Signifier | 6.9 | 1.3a | 0.2a | 3.7 | 0.4a | 0.5a |
| Médian | 4.0 | 0.5 | 0.5 | 0.4 | 0.0 | 0.0 |
| Score d'érosion | ||||||
| Base de base | ||||||
| Signifier | 44 | 44 | 33 | 8.3 | 8.8 | 8.3 |
| Médian | 25 | 29 | 22 | 3.0 | 3.8 | 3.8 |
| Changement de la ligne de base | ||||||
| Signifier | 4.1 | 0.2a | 0.2a | 3.0 | 0.3a | 0.1a |
| Médian | 2.0 | 0.0 | 0.5 | 0.3 | 0.0 | 0.0 |
| Score JSN | ||||||
| Base de base | ||||||
| Signifier | 36 | 34 | 31 | 3.0 | 2.9 | 2.9 |
| Médian | 26 | 29 | 24 | 1.0 | 1.0 | 1.0 |
| Changement de la ligne de base | ||||||
| Signifier | 2.9 | 1.1a | 0.0a | 0.6 | 0.1a | 0.2 |
| Médian | 1.5 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| a P<0.001 for each outcome against placebo. |
Réponse de la fonction physique
La fonction physique et l'invalidité ont été évaluées à l'aide du questionnaire sur l'évaluation de la santé (HAQ-DI) et du questionnaire général de la qualité de vie liée à la santé SF-36.
Dans l'étude, toutes les doses / calendriers de l'infliximab MTX ont montré une amélioration significativement plus importante par rapport à la référence dans le score de résumé des composants physiques HAQ-DI et SF-36 en moyenne au fil du temps au cours de la semaine 54 par rapport au placebo MTX et sans aggraver le score de résumé des composants mentaux SF-36. L'amélioration médiane (gamme interquartile) de la ligne de base à la semaine 54 dans HAQ-DI était de 0,1 (-0,1 0,5) pour le groupe MTX placebo et 0,4 (0,1 0,9) pour l'infliximab MTX (P<0.001). Both HAQ-DI et SF-36 effects were maintained through Week 102. Approximately 80% of patients in all doses/schedules of Infliximab+MTX remained in the trial through 102 weeks.
Dans l'étude RA II, les deux groupes de traitement de l'infliximab ont montré une amélioration plus importante du HAQ-DI à partir de la ligne de base moyenne au fil du temps à la semaine 54 par rapport au MTX seul; 0,7 pour l'infliximab MTX vs 0,6 pour MTX seul (p≤0,001). Aucune aggravation dans le score de résumé de la composante mentale SF-36 n'a été observée.
Spondylarthrite ankylosante
L'innocuité et l'efficacité de l'infliximab ont été évaluées dans une étude multicentrique randomisée à double aveugle contrôlée par un placebo chez 279 patients adultes atteints d'AS active. Les patients avaient entre 18 et 74 ans et avaient été tels que définis par les critères modifiés de New York pour la spondylarthrite ankylosante. Les patients devaient avoir eu une maladie active, comme en témoignent à la fois un score de l'indice d'activité de la spondylite de la spondylite (BASDAI) du bain (plage possible 0-10) et des douleurs vertébrales> 4 (à une échelle visuelle analogique [EVA] de 0-10). Les patients présentant une ankylose complète de la colonne vertébrale ont été exclus de la participation de l'étude et l'utilisation de médicaments anti-rhumatismaux modifiant la maladie (ARMards) et des corticostéroïdes systémiques a été interdite. Les doses d'infliximab 5 mg / kg ou de placebo ont été administrées par voie intraveineuse aux semaines 0 2 6 12 et 18.
À 24 semaines, une amélioration des signes et symptômes de AS est mesurée par la proportion de patients atteignant une amélioration de 20% des critères de réponse ASA (ASA 20) chez 60% des patients du groupe traité par l'infliximab vs 18% des patients du groupe placebo (P (P<0.001). Improvement was observed at Week 2 et maintained through Semaine 24 (Figure 3 et Table 10).
Figure 3: Proportion d'adultes en tant que patients qui ont obtenu une réponse ASAS 20
 |
À 24 semaines, les proportions de patients atteignant une amélioration de 50% et 70% des signes et symptômes de l'AS sont mesurés par les critères de réponse ASA (ASA 50 et ASA 70 respectivement) étaient respectivement de 44% et 28% pour les patients recevant un infliximab par rapport à 9% et 4% pour les patients recevant un placebo (P.<0.001 Infliximab vs. placebo). A low level of disease activity (defined as a value <20 [on a scale of 0-100 mm] in each of the 4 ASAS response parameters) was achieved in 22% of Infliximab-treated patients vs. 1% in placebo-treated patients (P<0.001).
Tableau 10: Composantes de l'activité de la maladie AS
| Placebo (n = 78) | Infliximab 5 mg / kg (n = 201) | Valeur p | |||
| Base de base | 24 semaines | Base de base | 24 semaines | ||
| Réponse des ailes 20 | |||||
| Critères (moyenne) | |||||
| Évaluation globale des patientsa | 6.6 | 6.0 | 6.8 | 3.8 | <0.001 |
| Douleurs à la colonne vertébralea | 7.3 | 6.5 | 7.6 | 4.0 | <0.001 |
| Basfib | 5.8 | 5.6 | 5.7 | 3.6 | <0.001 |
| Inflammationc | 6.9 | 5.8 | 6.9 | 3.4 | <0.001 |
| Réactifs de phase aiguë | |||||
| Médian CRPd (mg / dl) | 1.7 | 1.5 | 1.5 | 0.4 | <0.001 |
| Mobilité de la colonne vertébrale (moyenne CM) | |||||
| Test de Schober modifiée | 4.0 | 5.0 | 4.3 | 4.4 | 0.75 |
| Extension thoraciquee | 3.6 | 3.7 | 3.3 | 3.9 | 0.04 |
| Tragus au mure | 17.3 | 17.4 | 16.9 | 15.7 | 0.02 |
| Flexion vertébrale latéralee | 10.6 | 11.0 | 11.4 | 12.9 | 0.03 |
| a Mesuré sur un EVA avec 0 = aucun et 10 = sévère b Bath ankylosing Spondylart Index fonctionnel (BASFI) de 10 questions c Inflammation average of last 2 questions on the 6-question BASDAI d CRP Normal Range 0-1,0 mg / dl e Valeurs normales de mobilité vertébrale: test de Schober modifié:> 4 cm; Expansion thoracique:> 6 cm; tragus au mur: <15 cm; lateral spinal flexion:>10 cm |
L'amélioration médiane par rapport à la référence dans le questionnaire général de la qualité de vie liée à la santé SF-36 Le score de résumé des composants physiques à la semaine 24 était de 10,2 pour le groupe Inflixiab contre 0,8 pour le groupe placebo (P<0.001). There was no change in the SF-36 mental component summary score in either the Infliximab group or the placebo group.
Les résultats de cette étude étaient similaires à ceux observés dans une étude multicentrique contrôlée par placebo en double aveugle de 70 patients avec AS.
Arthrite psoriatique
La sécurité et l'efficacité de l'infliximab ont été évaluées dans une étude contrôlée par placebo en double aveugle multicentrique chez 200 patients adultes atteints de PSA actif malgré un traitement par DMARD ou AINS (≥ 5 articulations gonflées et ≥ 5 articulations tendres) avec 1 ou plusieurs des sous-types suivants: arthrite impliquant des articulations dip (n = 49) Mutilans arthriters (N = 3) arthritique arthritique arthritique (N = 3) Asymméraire arthritique Mutilans (N = 3) Asymméraux arthrites. (n = 40) Arthrite polyarticulaire (n = 100) et spondylarthrite avec arthrite périphérique (n = 8). Les patients avaient également du PS avec une lésion cible de qualification ≥ 2 cm de diamètre. Quarante-six pour cent des patients ont poursuivi des doses stables de méthotrexate (≤ 25 mg / semaine). Au cours des phases en double aveugle de 24 semaines, les patients ont reçu 5 mg / kg d'infliximab ou un placebo aux semaines 0 2 6 14 et 22 (100 patients dans chaque groupe). À la semaine 16, les patients placebo avec <10% improvement from baseline in both swollen et tender joint counts were switched to Infliximab induction (early escape). At Semaine 24 all placebo-treated patients crossed over to Infliximab induction. Dosing continued for all patients through Week 46.
Réponse clinique
Le traitement par l'infliximab a entraîné une amélioration des signes et symptômes évalués par les critères de l'ACR avec 58% des patients traités par l'infliximab atteignant l'ACR 20 à la semaine 14, contre 11% des patients traités par placebo (P<0.001). The response was similar regardless of concomitant use of methotrexate. Improvement was observed as early as Week 2. At 6 months the ACR 20/50/70 responses were achieved by 54% 41% et 27% respectively of patients receiving Infliximab compared to 16% 4% et 2% respectively of patients receiving placebo. Similar responses were seen in patients with each of the subtypes of PsA although few patients were enrolled with the arthritis mutilans et spondylitis with peripheral arthritis subtypes.
Par rapport au traitement placebo avec l'infliximab, a entraîné des améliorations des composants des critères de réponse de l'ACR ainsi que dans la dactylite et l'enthéopathie (tableau 11). La réponse clinique a été maintenue au cours de la semaine 54. Des réponses AC similaires ont été observées dans une étude plus précoce et contrôlée par placebo de 104 patients PSA et les réponses ont été maintenues au cours de 98 semaines dans une phase d'extension ouverte.
Tableau 11: Composantes de l'ACR 20 et pourcentage de patients atteints de PSA adultes avec 1 articulation ou plus atteints de dactylite et pourcentage de patients atteints de PSA adultes atteints d'enthesopathie au départ et semaine 24
| Patients randomisés | Placebo (n = 100) | Infliximab 5 mg / kga (n = 100) | ||
| Base de base | Semaine 24 | Base de base | Semaine 24 | |
| Paramètre (médians) | ||||
| Nombre d'articulations tendresb | 24 | 20 | 20 | 6 |
| Nombre d'articulations gonfléesc | 12 | 9 | 12 | 3 |
| Douleurd | 6.4 | 5.6 | 5.9 | 2.6 |
| Évaluation mondiale du médecind | 6.0 | 4.5 | 5.6 | 1.5 |
| Évaluation globale du patientd | 6.1 | 5.0 | 5.9 | 2.5 |
| Indice de handicap (HAQ-D)e | 1.1 | 1.1 | 1.1 | 0.5 |
| CRP (Mg / DL)f | 1.2 | 0.9 | 1.0 | 0.4 |
| % Patients avec 1 ou plus de chiffres avec une dactylite | 41 | 33 | 40 | 15 |
| % Patients atteints d'enthesopathie | 35 | 36 | 42 | 22 |
| a P<0.001 for percent change from baseline in all components of ACR 20 at Semaine 24 P<0.05 for % of patients with dactylitis et P=0.004 for % of patients with enthesopathy at Semaine 24 b Échelle 0-68 c Échelle 0-66 d Échelle visuelle analogique (0 = meilleur 10 = pire) e Question d'évaluation de la santé Mesure de 8 catégories: s'habiller et toiletter sur la notoriété hygiène de marche de la marche et activités (0 = meilleur 3 = pire) f Plage normale 0-0,6 mg / dl |
L'amélioration de la zone de psoriasis et de l'indice de gravité (PASI) chez les patients atteints de PSA présentant une surface corporelle de base (BSA) ≥3% (n = 87 placebo n = 83 infliximab) a été obtenue à la semaine 14, indépendamment de l'amélioration du méthotrexate concomitant avec 64% des patients traités par l'infliximabe réalisant au moins 75% de la base de la base de 2% de 2% des patients traités par place au pacier; Une amélioration a été observée chez certains patients dès la semaine 2. À 6 mois, les réponses PASI 75 et PASI 90 ont été obtenues respectivement de 60% et 39% de patients recevant un infliximab contre 1% et 0% respectivement de patients recevant un placebo. La réponse PASI a été généralement maintenue pendant la semaine 54. [Voir Études cliniques ].
Réponse radiographique
Les dommages structurels dans les mains et les pieds ont été évalués radiographiquement par le changement par rapport à la ligne de base du score Van der Heijde-Sharp (VDH-S) modifié par l'ajout de joints de trempette à la main. Le score VDH-S modifié total est un score composite de dommages structurels qui mesure le nombre et la taille des érosions articulaires et le degré de rétrécissement de l'espace conjoint (JSN) dans les mains et les pieds. À la semaine 24, les patients traités par l'infliximab avaient moins de progression radiographique que les patients traités par placebo (changement moyen de -0,70 contre 0,82 p<0.001). Infliximab-treated patients also hannonce less progression in their erosion scores (-0.56 vs 0.51) et JSN scores (-0.14 vs 0.31). The patients in the Infliximab group demonstrated continued inhibition of structural damage at Semaine 54. Most patients showed little or no change in the vdH-S score during this 12-month study (median change of 0 in both patients who initially received Infliximab or placebo). More patients in the placebo group (12%) hannonce reannonceily apparent rannonceiographic progression compared with the Infliximab group (3%).
Fonction physique
L'état de la fonction physique a été évalué à l'aide de l'indice de handicap HAQ (HAQ-DI) et de l'enquête sur la santé SFâ36. Les patients traités par l'infliximab ont démontré une amélioration significative de la fonction physique telle qu'évaluée par HAQ-DI (amélioration en pourcentage médian du score HAQ-DI de la ligne de base à la semaine 14 et 24 sur 43% pour les patients traités par l'infliximab vs 0% pour les patients traités par placebo).
Au cours de la partie contrôlée par placebo de l'essai (24 semaines), 54% des patients traités par l'infliximab ont atteint une amélioration cliniquement significative de HAQ-DI (≥ 0,3 diminution de l'unité) par rapport à 22% des patients traités par placebo. Les patients traités par l'infliximab ont également démontré une amélioration plus importante des scores de résumé des composants physiques et mentaux du SF-36 que les patients traités par placebo. Les réponses ont été maintenues jusqu'à 2 ans dans une étude d'extension ouverte.
Psoriasis en plaques
L'innocuité et l'efficacité de l'infliximab ont été évaluées dans 3 études randomisées contrôlées par placebo en double aveugle chez les patients âgés de 18 ans et plus avec un PS stable chronique impliquant ≥10% de BSA un score PASI minimum de 12 et qui étaient candidats à une thérapie systémique ou à la photothérapie. Les patients atteints de psoriasis pustuleux ou érythrodermique guttate ont été exclus de ces études. Aucune thérapie anti-psoriatique concomitante n'a été autorisée au cours de l'étude, à l'exception des corticostéroïdes topiques à faible puissance sur le visage et l'aine après la semaine 10 de l'initiation de l'étude.
L'étude I (Express) a évalué 378 patients qui ont reçu un placebo ou un infliximab à une dose de 5 mg / kg aux semaines 0 2 et 6 (thérapie d'induction) suivie d'une thérapie d'entretien toutes les 8 semaines. À la semaine 24, le groupe placebo s'est croisé en thérapie d'induction de l'infliximab (5 mg / kg) suivie d'un traitement d'entretien toutes les 8 semaines. Les patients à l'origine randomisés en infliximab ont continué à recevoir l'infliximab 5 mg / kg toutes les 8 semaines à la semaine 46. Dans tous les groupes de traitement, le score médian de PASI de base était de 21 et le score de base de l'évaluation globale du médecin statique (SPGA) variait de modéré (52% des patients) à marqué (36%) à Severe (2%). De plus, 75% des patients avaient un BSA> 20%. Soixante et onze pour cent des patients avaient précédemment reçu un traitement systémique et 82% ont reçu une photothérapie.
L'étude II (Express II) a évalué 835 patients qui ont reçu un placebo ou un infliximab à des doses de 3 mg / kg ou 5 mg / kg aux semaines 0 2 et 6 (thérapie d'induction). À la semaine 14 dans chaque groupe de dose d'infliximab, les patients randomisés ont été randomisés pour le traitement d'entretien (toutes les 8 semaines) ou au besoin (PRN) pendant la semaine 46. À la semaine 16, le groupe placebo s'est croisé en thérapie d'induction de l'infliximab (5 mg / kg) suivie d'une thérapie d'entretien toutes les 8 semaines. Dans tous les groupes de traitement, le score PASI de base médian était de 18 et 63% des patients avaient un BSA> 20%. Cinquante-cinq pour cent des patients ont précédemment reçu un traitement systémique et 64% ont reçu une photothérapie.
L'étude III (Spirit) a évalué 249 patients qui avaient auparavant reçu un psoralen plus un traitement ultraviolet A ( Puva ) ou une autre thérapie systémique pour leur psoriasis. Ces patients ont été randomisés pour recevoir le placebo ou l'infliximab à des doses de 3 mg / kg ou 5 mg / kg aux semaines 0 2 et 6. À la semaine 26, les patients avec un score SPGA de modéré ou de pire (supérieur ou égal à 3 sur une échelle de 0 à 5) ont reçu une dose supplémentaire du traitement randomisé. Dans tous les groupes de traitement, le score médian de base PASI était de 19 et le score SPGA de base variait de modéré (62% des patients) à marqué (22%) à sévère (3%). De plus, 75% des patients avaient un BSA> 20%. Parmi les patients inscrits, 114 (46%) ont reçu la semaine 26 dose supplémentaire.
Dans les études I II et III, le critère d'évaluation principal était la proportion de patients qui ont obtenu une réduction du score d'au moins 75% par rapport à la ligne de base à la semaine 10 par le PASI (PASI 75). Dans l'étude I et l'étude III, un autre résultat évalué comprenait la proportion de patients qui ont obtenu un score de défrichage ou minimal par la SPGA. Le SPGA est une échelle à 6 catégories allant de 5 = sévère à 0 = effacée indiquant l'évaluation globale du médecin de la gravité du psoriasis se concentrant sur l'érythème et la mise à l'échelle de l'induration. Le succès du traitement défini comme éliminé ou minimal consistait en aucune ou une élévation minimale de la plaque jusqu'à une faible coloration rouge dans l'érythème et aucune ou une échelle fine minimale sur <5% of the plaque.
L'étude II a également évalué la proportion de patients qui ont obtenu un score clair ou excellent par l'évaluation globale du médecin relatif (RPGA). Le RPGA est une échelle à 6 catégories allant de 6 = pire à 1 = claire qui a été évaluée par rapport à la ligne de base. Les lésions globales ont été classées en considération au pourcentage d'implication du corps ainsi qu'à l'échelle d'induration globale et à l'érythème. Le succès du traitement défini comme clair ou excellent consistait en une rose ou une pigmentation résiduelle à une amélioration marquée (texture de la peau presque normale; un érythème peut être présent). Les résultats de ces études sont présentés dans le tableau 12.
Tableau 12: Études de psoriasis adultes I II et III Pourcentage de patients qui ont obtenu PASI 75 et pourcentage qui ont obtenu le succès du traitement avec l'évaluation mondiale du médecin à la semaine 10
| Placebo | Infliximab | ||
| 3 mg / kg | 5 mg / kg | ||
| Étude du psoriasis I - Les patients randomisésa | 77 | — | 301 |
| Après 75 | 2 (3%) | — | 242 (80%) * |
| SPGA | 3 (4%) | — | 242 (80%) * |
| Étude du psoriasis II - les patients randomisésa | 208 | 313 | 314 |
| Après 75 | 4 (2%) | 220 (70%) * | 237 (75%) * |
| RPGA | 2 (1%) | 217 (69%) * | 234 (75%) * |
| Étude du psoriasis III - Patients randomisésb | 51 | 99 | 99 |
| Après 75 | 3 (6%) | 71 (72%) * | 87 (88%) * |
| SPGA | 5 (10%) | 71 (72%) * | 89 (90%) * |
| * P<0.001 compared with placebo a Les patients avec des données manquants à la semaine 10 ont été considérés comme des non-répondants. b Les patients avec des données manquants à la semaine 10 ont été imputés par la dernière observation. |
Dans l'étude I dans le sous-groupe de patients atteints de PS plus étendue qui avaient déjà reçu une photothérapie 85% des patients sur 5 mg / kg d'infliximab ont atteint un PASI 75 à la semaine 10, contre 4% des patients sur placebo.
Dans l'étude II dans le sous-groupe de patients atteints de PS plus étendue qui avaient précédemment reçu une photothérapie 72% et 77% des patients sur 3 mg / kg et 5 mg / kg d'infliximab ont atteint un PASI 75 à la semaine 10 respectivement par rapport à 1% sur le placebo. Dans l'étude II chez les patients atteints de PS plus étendue qui avaient échoué ou étaient intolérants à la photothérapie 70% et 78% des patients sur 3 mg / kg et 5 mg / kg d'infliximab ont atteint un PASI 75 à la semaine 10 respectivement par rapport à 2% sur le placebo.
Le maintien de la réponse a été étudié dans un sous-ensemble de 292 et 297 patients traités par l'infliximab dans les groupes de 3 mg / kg et 5 mg / kg; respectivement dans l'étude II. Stratifié par réponse PASI à la semaine 10 et les patients en cas de site d'enquête dans les groupes de traitement actifs ont été re-randomisés à un traitement de maintenance (PRN) prévu ou au besoin (PRN) à partir de la semaine 14.
Les groupes qui ont reçu une dose d'entretien toutes les 8 semaines semblent avoir un pourcentage plus élevé de patients conservant un PASI 75 à la semaine 50 par rapport aux patients qui ont reçu les doses au besoin ou au PRN et la meilleure réponse a été maintenue avec la dose de 5 mg / kg toutes les 8 semaines. Ces résultats sont présentés sur la figure 4. À la semaine 46, lorsque les concentrations de sérum inflixiabe étaient au niveau du bac Niveaux d'infliximab sérique à creux détectables. Cela peut être lié en partie à des taux d'anticorps plus élevés [voir Effets indésirables ]. In annoncedition in a subset of patients who hannonce achieved a response at Week 10 maintenance of response appears to be greater in patients who received Infliximab every 8 weeks at the 5 mg / kg dose. Regardless of whether the maintenance doses are PRN or every 8 weeks there is a decline in response in a subpopulation of patients in each group over time.
Les résultats de l'étude I à la semaine 50 dans les 5 mg / kg toutes les 8 semaines du groupe de dose d'entretien étaient similaires aux résultats de l'étude II.
Figure 4: Proportion de patients atteints de PS adultes qui ont obtenu une amélioration ≥ 75% de PASI de la ligne de base à la semaine 50 (patients randomisés à la semaine 14)
 |
L'efficacité et l'innocuité du traitement à l'infliximab au-delà de 50 semaines n'ont pas été évaluées chez les patients atteints de PS.
Références
1. Turner D Otley Ar Mack D et al. Validation du développement et évaluation d'un indice d'activité de la colite ulcéreuse pédiatrique: une étude multicentrique prospective. Gastro-entérologie. 2007; 133: 423432.
Informations sur les patients pour Remicade
Infliximab
pour l'injection pour une utilisation intraveineuse
Lisez le guide de médicaments fourni avec l'infliximab avant de recevoir le premier traitement et avant chaque fois que vous obtenez un traitement de l'infliximab. Ce guide de médicaments ne prend pas la place de parler avec votre médecin de votre état de santé ou de votre traitement.
Quelles sont les informations les plus importantes que je devrais connaître sur l'infliximab?
Infliximab may cause serious side effects including:
1. Risque d'infection
Infliximab is a medicine that affects your immune system. Infliximab can lower the ability of your immune system to fight infections. Serious infections have happened in patients receiving Infliximab.
Ces infections comprennent la tuberculose (TB) et les infections causées par des champignons ou des bactéries des virus qui se sont propagés dans tout le corps. Certains patients sont morts de ces infections.
- Votre médecin doit vous tester pour la tuberculose avant de commencer l'infliximab.
- Votre médecin doit vous surveiller de près pour les signes et symptômes de la tuberculose pendant le traitement avec l'infliximab.
Avant de commencer l'infliximab, dites à votre médecin si vous:
- Pensez que vous avez une infection. Vous ne devez pas commencer à recevoir de l'infliximab si vous avez une sorte d'infection.
- sont traités pour une infection.
- ont des signes d'une infection telle qu'une fièvre touss de symptômes pseudo-grippaux.
- Ayez des coupes ou des plaies ouvertes sur votre corps.
- Obtenez beaucoup d'infections ou ayant des infections qui continuent de revenir.
- avoir un diabète ou un problème de système immunitaire. Les personnes atteintes de ces conditions ont plus de chances d'infections.
- avoir une tuberculose ou avoir été en contact étroit avec quelqu'un avec TB.
- vivent ou ont vécu dans certaines parties du pays (comme les vallées de la rivière Ohio et Mississippi) où il existe un risque accru d'obtenir certains types d'infections fongiques (histoplasmose coccidiomidomycose ou blastomycose). Ces infections peuvent se développer ou devenir plus graves si vous recevez l'infliximab. Si vous ne savez pas si vous avez vécu dans une zone où la coccidiodomycose ou la blastomycose de l'histoplasmose est courant, demandez à votre médecin.
- ont ou ont eu l'hépatite B.
- Utilisez les médicaments Kineret (Anakinra) Orencia (Abatacept) actemra (tocilizumab) ou d'autres médicaments appelés biologiques utilisés pour traiter les mêmes conditions que l'infliximab.
Après avoir commencé l'infliximab Si vous avez une infection, un signe d'une infection, y compris une fièvre, une toux de la grippe ou des coupes ou des plaies ouvertes sur votre corps, appelez votre médecin immédiatement. L'infliximab peut vous rendre plus susceptible d'obtenir des infections ou de faire une infection que vous avez pire.
2. Risque de cancer
- Il y a eu des cas de cancers inhabituels chez les enfants et les patients adolescents utilisant des médicaments sur les bloqueurs du facteur de nécrose tumorale (TNF).
- Pour les enfants et les adultes qui reçoivent des médicaments contre les bloqueurs TNF, y compris l'infliximab, les chances d'obtenir un lymphome ou d'autres cancers peuvent augmenter.
- Certaines personnes recevant des bloqueurs TNF, y compris l'infliximab, ont développé un type de cancer rare appelé lymphome à cellules T hépatosplénique. Ce type de cancer entraîne souvent la mort. La plupart de ces personnes étaient des adolescents masculins ou des jeunes hommes. La plupart des gens étaient également traités pour la maladie de Crohn ou la colite ulcéreuse avec un bloqueur TNF et un autre médicament appelé azathioprine ou 6mercaptopurine.
- Les personnes qui ont été traitées pour la polyarthrite rhumatoïde de la maladie de la maladie de Crohn, la colite ulcéreuse ankylosante de la spondylite psorias, le psoriasis et le psoriasis en plaque, peuvent être plus susceptibles de développer un lymphome. Cela est particulièrement vrai pour les personnes atteintes d'une maladie très active.
- Certaines personnes traitées par l'infliximab ont développé certains types de cancer de la peau. Si des changements dans l'apparence de votre peau ou de vos croissances sur votre peau se produisent pendant ou après votre traitement avec l'infliximab, dites à votre médecin.
- Les patients atteints de maladie pulmonaire obstructive chronique (MPOC) Un type spécifique de maladie pulmonaire peuvent avoir un risque accru de se faire du cancer tout en étant traité avec l'infliximab.
- Certaines femmes traitées pour la polyarthrite rhumatoïde avec l'infliximab ont développé un cancer du col de l'utérus. Pour les femmes qui reçoivent de l'infliximab, y compris celles de plus de 60 ans, votre médecin peut vous recommander de continuer à être sélectionné régulièrement pour le cancer du col de l'utérus.
- Dites à votre médecin si vous avez déjà eu un type de cancer. Discutez avec votre médecin tout besoin d'ajuster les médicaments que vous prenez.
Voir la section Quels sont les effets secondaires possibles de l'infliximab? Ci-dessous pour plus d'informations.
Qu'est-ce que l'infliximab?
Infliximab is a prescription medicine that is approved for patients with:
- Polyarthrite rhumatoïde -annonceults with moderately to severely active polyarthrite rhumatoïde along with the medicine methotrexate.
- Crohn-Childre-enfants de Crohn 6 ans et plus et les adultes atteints de la maladie de Crohn qui n'ont pas bien répondu à d'autres médicaments.
- Spondylarthrite ankylosante in annonceults
- Arthrite psoriatique in annonceults
- Psoriasis en plaques -annonceult patients with psoriasis en plaques that is chronic (does not go away) severe extensive et/or disabling.
- Rectocolite hémorragique -children 6 years et older et annonceults with moderately to severely active rectocolite hémorragique who have not responded well to other medicines.
Infliximab blocks the action of a protein in your body called facteur de nécrose tumorale-Alpha (tnf-alpha). TNF-alpha is mannoncee by your body’s immune system. People with certain diseases have too much TNF-alpha that can cause the immune system to attack normal healthy parts of the body. Infliximab can block the damage caused by too much TNF-alpha.
On ne sait pas si l'infliximab est sûr et efficace chez les enfants de moins de 6 ans.
Qui ne devrait pas recevoir d'infliximab?
Vous ne devriez pas recevoir d'infliximab si vous avez:
- insuffisance cardiaque unless your doctor has examined you et decided that you are able to receive Infliximab. Talk to your doctor about your insuffisance cardiaque.
- a eu une réaction allergique à l'infliximab ou à l'un des autres ingrédients de l'infliximab. Voir la fin de ce guide de médicaments pour une liste complète des ingrédients dans l'infliximab.
Que dois-je dire à mon médecin avant de commencer le traitement avec l'infliximab?
Votre médecin évaluera votre santé avant chaque traitement.
Parlez à votre médecin de toutes vos conditions médicales, y compris si vous:
- avoir une infection (voir Quelles sont les informations les plus importantes que je devrais connaître sur l'infliximab? ).
- avoir d'autres problèmes hépatiques, y compris l'insuffisance hépatique.
- avoir une insuffisance cardiaque ou d'autres conditions cardiaques. Si vous avez une insuffisance cardiaque, cela peut empirer pendant que vous recevez de l'infliximab.
- ont ou ont eu un type de cancer.
- ont eu une photothérapie (traitement avec une lumière ou un soleil ultraviolet avec un médicament pour rendre votre peau sensible à la lumière) pour le psoriasis. Vous pouvez avoir plus de chances d'obtenir un cancer de la peau tout en recevant de l'infliximab.
- avoir une MPOC un type spécifique de maladie pulmonaire. Les patients atteints de MPOC peuvent avoir un risque accru de se faire du cancer lors de la réception de l'infliximab.
- ont ou ont eu une condition qui affecte votre système nerveux, comme:
- sclérose en plaques or Guillain-Barré syndrome or
- Si vous ressentez un engourdissement ou des picotements ou
- Si vous avez eu une crise.
- ont récemment reçu ou devraient recevoir un vaccin. Les adultes et les enfants qui reçoivent des influximabs ne doivent pas recevoir de vaccins vivants (par exemple le vaccin contre le bacille de calmette (comme le BCG pour le cancer de la vessie). Les adultes et les enfants devraient avoir tous leurs vaccins mis à jour avant de commencer le traitement avec l'infliximab.
- sont enceintes ou envisagent de devenir enceintes enceintes ou prévoient d'allaiter. Vous et votre médecin devriez décider si vous devez recevoir l'infliximab pendant que vous êtes enceinte ou allaite.
Si vous avez un bébé et que vous recevez de l'infliximab pendant votre grossesse, il est important de dire au médecin de votre bébé et à d'autres professionnels de la santé de votre utilisation de l'infliximab afin qu'il puisse décider quand votre bébé devrait recevoir un vaccin. Certaines vaccinations peuvent provoquer des infections.
Si vous avez reçu de l'infliximab pendant que vous étiez enceinte, votre bébé peut être plus à risque d'obtenir une infection. Si votre bébé reçoit un vaccin vivant dans les 6 mois après la naissance, votre bébé peut développer des infections avec de graves complications qui peuvent entraîner la mort. Cela comprend des vaccins en direct tels que le rotavirus BCG ou tout autre vaccin live. Pour d'autres types de vaccins, parlez avec votre médecin.
Comment dois-je recevoir de l'infliximab?
- On vous donnera l'infliximab à travers une aiguille placée dans une veine (IV ou perfusion intraveineuse) dans votre bras.
- Votre médecin peut décider de vous donner des médicaments avant de commencer la perfusion de l'infliximab pour prévenir ou réduire les effets secondaires.
- Seul un professionnel de la santé devrait préparer le médicament et vous l'administrer.
- Infliximab will be given to you over a period of about 2 hours.
- Si vous avez des effets secondaires de l'infliximab, la perfusion peut devoir être ajustée ou arrêtée. De plus, votre professionnel de la santé peut décider de traiter vos symptômes.
- Un professionnel de la santé vous surveillera pendant la perfusion de l'infliximab et pendant une période de temps après pour les effets secondaires. Votre médecin peut effectuer certains tests pendant que vous recevez l'infliximab pour vous surveiller pour les effets secondaires et pour voir dans quelle mesure vous réagissez au traitement.
- Votre médecin déterminera la bonne dose d'infliximab pour vous et à quelle fréquence vous devriez la recevoir. Assurez-vous de discuter avec votre médecin lorsque vous recevrez des perfusions et de venir pour toutes vos perfusions et rendez-vous de suivi.
Que dois-je éviter en recevant de l'infliximab?
Ne prenez pas l'infliximab avec des médicaments tels que Kineret (Anakinra) Orencia (Abatacept) actemra (tocilizumab) ou d'autres médicaments appelés biologiques utilisés pour traiter les mêmes conditions que l'infliximab.
Parlez à votre médecin de tous les médicaments que vous prenez y compris les médicaments sur ordonnance et en vente libre des vitamines et des suppléments à base de plantes. Il s'agit notamment de tout autre médicament pour traiter la maladie ulcéreuse de la maladie de la maladie de Crohn, la polyarthrite rhumatoïde ankylosante spondylartte psoriasie ou le psoriasis.
Connaissez les médicaments que vous prenez. Gardez une liste de vos médicaments et montrez-les à votre médecin et pharmacien lorsque vous obtenez un nouveau médicament.
Quels sont les effets secondaires possibles de l'infliximab?
Infliximab can cause serious side effects including:
Voir Quelles sont les informations les plus importantes que je devrais connaître sur l'infliximab?
Infections graves
- Certains patients en particulier ces 65 ans et plus ont eu des infections graves lors de la réception de l'infliximab. Ces infections graves incluent la tuberculose et les infections causées par des champignons ou des bactéries qui se sont propagées dans tout le corps ou provoquent des infections dans certaines zones (comme la peau). Certains patients meurent de ces infections. Si vous obtenez une infection lors de votre traitement avec l'infliximab, votre médecin traitera votre infection et peut avoir besoin d'arrêter votre traitement de l'infliximab.
- Dites immédiatement à votre médecin si vous avez l'un des signes suivants d'une infection lors de la réception ou après avoir reçu l'infliximab:
- une fièvre
- avoir des symptômes pseudo-grippaux
- se sentir très fatigué
- Red chaud ou douloureux
- toux
- Votre médecin vous examinera pour la tuberculose et effectuera un test pour voir si vous avez TB. Si votre médecin estime que vous êtes à risque de tuberculose, vous pouvez être traité avec des médicaments pour la tuberculose avant de commencer le traitement par l'infliximab et pendant le traitement avec l'infliximab.
- Même si votre Test de tuberculose est négatif, votre médecin doit vous surveiller attentivement pour les infections à la tuberculose pendant que vous recevez de l'infliximab. Les patients qui avaient un test cutané à TB négatif avant de recevoir l'infliximab ont développé une tuberculose active.
- Si vous êtes un porteur chronique du virus de l'hépatite B, le virus peut devenir actif pendant que vous êtes traité avec l'infliximab. Dans certains cas, les patients sont morts en raison de la réactivation du virus de l'hépatite B. Votre médecin doit faire un test sanguin pour le virus de l'hépatite B avant de commencer le traitement avec l'infliximab et parfois pendant que vous êtes traité. Dites à votre médecin si vous avez l'un des symptômes suivants:
- se sentir mal
- fatigue (fatigue)
- mauvais appétit
- fièvre éruption cutanée ou douleurs articulaires
Insuffisance cardiaque
Si vous avez un problème cardiaque appelé insuffisance cardiaque congestive Votre médecin doit vous vérifier de près pendant que vous recevez de l'infliximab. Votre insuffisance cardiaque congestive peut empirer pendant que vous recevez l'infliximab. Assurez-vous de parler à votre médecin de tout symptôme nouveau ou pire, notamment:
- essoufflement
- gain de poids soudain
- gonflement des chevilles ou des pieds
Le traitement avec l'infliximab peut devoir être arrêté si vous obtenez une insuffisance cardiaque congestive nouvelle ou pire.
Autres problèmes cardiaques
Certains patients ont connu un crise cardiaque (dont certains ont entraîné la mort) un faible flux sanguin vers le cœur ou un rythme cardiaque anormal dans les 24 heures suivant le début de leur perfusion de l'infliximab. Les symptômes peuvent inclure l'inconfort thoracique ou la douleur des armoines douleurs à l'estomac Douleur à souffle anxiété étourdie étourdisse évanouissement transpiration de nausées vomissant flottant ou battant dans votre poitrine et / ou un rythme cardiaque rapide ou lent. Dites immédiatement votre médecin si vous présentez l'un de ces symptômes.
Blessure au foie
Certains patients recevant de l'infliximab ont développé de graves problèmes hépatiques. Dites à votre médecin si vous avez:
- jaunisse (skin et eyes turning yellow)
- fièvre
- Urine de couleur brun foncé
- fatigue extrême (severe fatigue)
- douleur on the right side of your stomach area(right-sided abdominal douleur)
Problèmes de sang
Chez certains patients recevant l'infliximab, le corps peut ne pas faire suffisamment de cellules sanguines qui aident à lutter contre les infections ou à arrêter les saignements. Dites à votre médecin si vous:
- avoir une fièvre qui ne disparaît pas
- avoir l'air très pâle
- ecchymose ou saignement très facilement
Troubles du système nerveux
Certains patients recevant de l'infliximab ont développé des problèmes avec leur système nerveux. Dites à votre médecin si vous avez:
- changements dans votre vision
- crises
- engourdissement ou picotement in any part of your body
- faiblesse dans vos bras ou vos jambes
Certains patients ont connu un stroke within approximately 24 hours of their infusion with Infliximab. Tell your doctor right away if you have symptoms of a stroke which may include: numbness or weakness of the face arm or leg especially on one side of the body; sudden confusion trouble speaking or understeting; sudden trouble seeing in one or both eyes sudden trouble walking vertiges loss of balance or coordination or a sudden severe mal de tête.
Réactions allergiques
Certains patients ont eu des réactions allergiques à l'infliximab. Certaines de ces réactions étaient graves. Ces réactions peuvent se produire pendant que vous obtenez votre traitement de l'infliximab ou peu de temps après. Votre médecin peut devoir arrêter ou suspendre votre traitement avec l'infliximab et vous donner des médicaments pour traiter la réaction allergique. Les signes d'une réaction allergique peuvent inclure:
- ruches (plaques de peau soulevées rouges)
- difficulté à respirer
- douleur thoracique
- haut ou pression artérielle basse
- fièvre
- frissons
Certains patients traités par l'infliximab ont eu des réactions allergiques retardées. Les réactions retardées se sont produites 3 à 12 jours après avoir reçu un traitement avec l'infliximab. Dites immédiatement à votre médecin si vous avez l'un de ces signes de réaction allergique retardée à l'infliximab:
- fièvre
- éruption cutanée
- mal de tête
- mal de gorge
- Douleurs musculaires ou articulaires
- gonflement du visage et des mains
- difficulté à avaler
Syndrome de type lupus
Certains patients ont développé des symptômes qui ressemblent aux symptômes du lupus. Si vous développez l'un des symptômes suivants, votre médecin peut décider d'arrêter votre traitement avec l'infliximab.
- inconfort ou douleur à la poitrine qui ne disparaît pas
- essoufflement
- douleurs articulaires
- éruption cutanée on the cheeks or arms that gets worse in the sun
Psoriasis
Certaines personnes recevant de l'infliximab avaient un nouveau psoriasis ou une aggravation du psoriasis qu'ils avaient déjà. Dites à votre médecin si vous développez des patchs écailleux rouges ou des bosses surélevées sur la peau qui sont remplies de pus. Votre médecin peut décider d'arrêter votre traitement avec l'infliximab.
Les effets secondaires les plus courants de l'infliximab comprennent:
- infections respiratoires telles que sinus infections et mal de gorge
- mal de tête
- touxing
- douleurs à l'estomac
Les réactions de perfusion peuvent se produire jusqu'à 2 heures après votre perfusion d'infliximab. Les symptômes des réactions de perfusion peuvent inclure:
- fièvre
- frissons
- douleur thoracique
- pression artérielle basse or high blood pressure
- essoufflement
- éruption cutanée
- démangeaison
Les enfants qui ont reçu l'infliximab dans des études pour la maladie de Crohn ont montré quelques différences dans les effets secondaires par rapport aux adultes qui ont reçu l'infliximab pour la maladie de Crohn. Les effets secondaires qui se sont produits plus chez les enfants étaient: anémie (globules rouges bas) leucopénie (globules blancs) rinçage (rougeur ou rougissement) infections virales neutropénie (faible neutrophile les globules blancs qui luttent contre l'infection) l'infection bactérienne fracture et les réactions allergiques de la reprise de la respiration. Parmi les patients qui ont reçu l'infliximab pour la colite ulcéreuse dans les études cliniques, plus d'enfants ont eu des infections par rapport aux adultes.
Parlez à votre médecin de tout effet secondaire qui vous dérange ou ne disparaît pas.
Ce ne sont pas tous les effets secondaires avec l'infliximab. Demandez à votre médecin ou à votre pharmacien plus d'informations.
Appelez votre médecin pour des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800FDA-1088.
Informations générales sur l'infliximab
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide de médicaments. Vous pouvez demander à votre médecin ou à votre pharmacien d'informations sur l'infliximab qui est écrite pour les professionnels de la santé.
Pour plus d'informations, appelez le 1-800-Janssen (1-800-526-7736).
Quels sont les ingrédients de l'infliximab?
L'ingrédient actif est l'infliximab.
Les ingrédients inactifs de l'infliximab comprennent: le dibasique phosphate de sodium dihydraté monobasique phosphate de sodium monohydraté polysorbate 80 et le saccharose. Aucun conservateur n'est présent.
Ce guide de médicaments a été approuvé par la Food and Drug Administration des États-Unis.