Depakote est
Les Informations Présentées Sur Ce Site Ne Constituent Pas Un Avis Médical. Nous Ne Vendons Rien. L'Exactitude De La Traduction N'Est Pas Garantie. Clause De Non-Responsabilité
Résumé
Qu'est-ce que DePakote est?
Depakote ER (DivalProex sodium) est un anticonvulsivant et un stabilisateur d'humeur utilisé pour traiter plusieurs conditions, y compris des troubles de crise trouble bipolaire et les maux de tête de migraine. Depakote est disponible sous forme générique.
Quels sont les effets secondaires de Depakote ER?
Les effets secondaires courants de Depakote ER comprennent:
- diarrhée
- constipation
- estomac renversé
- vertiges
- somnolence
- faiblesse
- perte
- Changements flou / vision double / vision
- changements dans les périodes menstruelles
- seins élargis
- sonner dans les oreilles
- tremblement (tremblement)
- déséquilibre
- goût inhabituel ou désagréable dans votre bouche ou
- changements de poids.
Dites à votre médecin si vous ressentez des effets secondaires graves de Depakote ER, y compris:
- Signes d'infection (par exemple, fièvre des ganglions lymphatiques gonflées de gorge persistantes)
- douleur thoracique
- ecchymoses faciles ou saignements inexpliqués
- rythme cardiaque rapide / lent / irrégulier
- gonflement des mains ou des pieds
- Mouvement oculaire incontrôlé (nystagmus)
- Se sentir froid ou frissonnant
- respiration rapide ou
- perte de conscience.
Depakote ER may cause serious side effects including:
- perte d'appétit
- Douleurs supérieures de l'estomac (se propage dans votre dos)
- nausées en cours
- vomissement
- urine sombre
- gonflement du visage
- jaunissement de la peau ou des yeux (jaunisse)
- Changements de comportement
- dépression
- anxiété
- crises de panique
- Difficulté à dormir
- comportement impulsif
- irritabilité
- agitation
- hostilité
- agression
- agitation
- hyper activité (mentalement ou physiquement)
- pensées suicidaires
- confusion
- fatigue
- vomissement
- Changement dans votre état mental
- ecchymoses faciles
- Saignement inhabituel (bouche de nez ou gencives)
- taches ponctuelles violettes ou rouges sous votre peau
- somnolence sévère
- aggraver la crise
- glandes gonflées
- symptômes de la grippe
- picotements graves ou engourdissements
- faiblesse musculaire
- douleur thoracique
- Nouveau ou aggravant la toux de fièvre et
- difficulté à respirer
Cherchez des soins médicaux ou appelez le 911 à la fois si vous avez les effets secondaires graves suivants:
- Des symptômes oculaires graves tels que la perte de vision soudaine floue du tunnel de vision de la vision de la vision des yeux ou de l'enflure ou de voir des halos autour des lumières;
- Symptômes cardiaques graves tels que les battements cardiaques rapides ou battants; flotter dans votre poitrine; essoufflement; et des étourdissements soudains, de la légèreté ou de l'évanouissement;
- Maux de tête sévères Confusion Slurred Speech Bras ou Ligne Proulitude Trouble de la merde Perte de coordination Sentiment des muscles très rigides très rigides Fièvre élevée Propice ou des tremblements.
Ce document ne contient pas tous les effets secondaires possibles et d'autres peuvent survenir. Vérifiez auprès de votre médecin des informations supplémentaires sur les effets secondaires.
Obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus.
Le dosage pour Depakote est
Le dosage de Depakote ER est basé sur l'état de santé et la réponse au traitement.
Quelles substances ou suppléments de médicaments interagissent avec Depakote ER?
Depakote ER may interact with topiramate blood thinners aspirine acétaminophène zidovudine clozapine diazépam méropénème rifampin ou éthosuximide. Discutez de tous les médicaments que vous prenez avec votre médecin.
Depakote ER During Grossesse et Breastfeeding
Depakote ER is not recommended for use during pregnancy. It may harm a fetus. However since untreated seizures are a serious condition that can harm both a pregnant woman et her fetus do not stop taking this medication unless directed by a doctor. If you are planning pregnancy become pregnant or think you may be pregnant immediately talk to your doctor about the benefits et risks of using this medication. This medication passes into breast milk. While there have been no reports of harm to nursing infants consult your doctor before breast-feeding. If Depakote ER is used for seizures do not stop taking it without consulting your doctor. Your condition may become worse if the drug is suddenly stopped.
Informations Complémentaires
Notre centre de médicaments à effets secondaires Depakote ER offre une vue complète des informations sur les médicaments disponibles sur les effets secondaires potentiels lors de la prise de ce médicament.
Informations sur les médicaments de la FDA
- Description de la drogue
- Indications
- Dosage
- Effets secondaires
- Interactions médicamenteuses
- Avertissements
- Surdosage
- Pharmacologie clinique
- Guide des médicaments
AVERTISSEMENT
Réactions indésirables mettant la vie en danger
Hépatotoxicité
Population générale: une insuffisance hépatique entraînant des décès s'est produite chez les patients recevant du valproate et ses dérivés. Ces incidents se sont généralement produits au cours des six premiers mois de traitement. L'hépatotoxicité grave ou mortelle peut être précédée de symptômes non spécifiques tels que la faiblesse de la faiblesse de la faiblesse de l'œdème facial et des vomissements. Chez les patients atteints d'épilepsie, une perte de contrôle des crises peut également se produire. Les patients doivent être surveillés de près pour l'apparition de ces symptômes. Des tests hépatiques sériques doivent être effectués avant le traitement et à des intervalles fréquents par la suite, en particulier au cours des six premiers mois [voir avertissements et PRÉCAUTIONS ].
Les enfants de moins de deux ans sont à un risque considérablement accru de développer une hépatotoxicité mortelle, en particulier ceux qui ont plusieurs anticonvulsivants ceux qui souffrent de troubles métaboliques congénitaux ceux qui souffrent de troubles de crise graves accompagnés d'un retard mental et de personnes atteintes d'une maladie cérébrale organique. Lorsque Depakote ER est utilisé dans ce groupe de patients, il doit être utilisé avec une extrême prudence et en tant qu'agent unique. Les avantages de la thérapie doivent être pesés avec les risques. L'incidence de l'hépatotoxicité mortelle diminue considérablement dans les groupes de patients progressivement plus âgés.
Patients atteints de maladie mitochondriale: il existe un risque accru d'insuffisance hépatique aiguë induite par le valproate et les décès qui en résultent chez les patients atteints de syndromes de neurométaboliques héréditaires causés par les mutations d'ADN du gène de l'ADN polymérase mitochondrial (POLG) (par exemple le syndrome de Huttenlocher Alperst). Depakote ER est contre-indiqué chez les patients connus comme ayant des troubles mitochondriaux causés par des mutations Polg et des enfants de moins de deux ans qui sont cliniquement soupçonnés d'avoir un trouble mitochondrial [voir Contre-indications ]. In patients over two years of age who are clinically suspected of having a hereditary mitochondrial disease Depakote ER should only be used after other anticonvulsants have failed. This older group of patients should be closely monitored during treatment with Depakote ER for the development of acute liver injury with regular clinical assessments et serum liver testing. POLG mutation screening should be performed in accordance with current clinical practice [see AVERTISSEMENTS AND PRÉCAUTIONS ].
Risque fœtal
Le valproate peut provoquer des malformations congénitales majeures, en particulier les anomalies du tube neuronal (par exemple le spina bifida). De plus, le valproate peut provoquer une diminution des scores de QI après une exposition in utero.
Le valproate est donc contre-indiqué chez les femmes enceintes traitées pour une prophylaxie de migraine [voir Contre-indications ]. Valproate should only be used to treat pregnant women with epilepsy or trouble bipolaire if other medications have failed to control their symptoms or are otherwise unacceptable.
Valproate ne doit pas être administré à une femme en potentiel de procréation à moins que le médicament ne soit essentiel à la gestion de son état de santé. Ceci est particulièrement important lorsque l'utilisation du valproate est considérée pour une condition non généralement associée à des blessures permanentes ou à la mort (par exemple, migraine). Les femmes doivent utiliser une contraception efficace lors de l'utilisation de valproate [voir avertissements et PRÉCAUTIONS ].
A Guide des médicaments décrire les risques de valproate est disponible pour les patients [voir Informations sur les patients ].
Pancréatite
Des cas de pancréatite potentiellement mortels ont été signalés chez les enfants et les adultes recevant du valproate. Certains des cas ont été décrits comme hémorragiques avec une progression rapide des symptômes initiaux à la mort. Des cas ont été signalés peu de temps après une utilisation initiale ainsi qu'après plusieurs années d'utilisation. Les patients et les tuteurs doivent être avertis que les douleurs abdominales vomissent les nausées et / ou l'anorexie peuvent être des symptômes de pancréatite qui nécessitent une évaluation médicale rapide. Si la pancréatite est diagnostiquée, le valproate doit généralement être interrompu. Un traitement alternatif pour l'état médical sous-jacent devrait être initié comme indiqué cliniquement [voir avertissements et PRÉCAUTIONS ].
La description de Depakote est
Le divalproex sodium est un composé de coordination stable composé de valproate de sodium et d'acide valproïque dans une relation molaire 1: 1 et s'est formé pendant la neutralisation partielle de l'acide valproïque avec 0,5 équivalent d'hydroxyde de sodium. Chimiquement, il est désigné comme BIS d'hydrogène de sodium (2-propylpentanoate). Divalproex sodium a la structure suivante:
| |
Le divalproex sodium se produit comme une poudre blanche avec une odeur caractéristique.
Depakote ER 250 et 500 mg tablets are for oral administration. Depakote ER tablets contain divalproex sodium in a once-a-day extended-release formulation equivalent to 250 et 500 mg of valproic acid.
Ingrédients inactifs
Depakote ER 250 et 500 mg de comprimés: FD&C Blue No. 1 hypromellose lactose microcrystalline cellulose polyethylene glycol potassium sorbate propylene glycol silicon dioxide titanium dioxide et triacetin.
De plus, 500 mg comprimés contiennent de l'oxyde de fer et du polydextrose.
Répond au test de dissolution USP 2.
Les utilisations de Depakote sont
Manie
Depakote ER is a valproate et is indicated for the treatment of acute manic or mixed episodes associated with trouble bipolaire with or without psychotic features. A manic episode is a distinct period of abnormally et persistently elevated expansive or irritable mood. Typical symptoms of mania include pressure of speech motor hyperactivity reduced need for sleep flight of ideas gretiosity poor judgment aggressiveness et possible hostilité. A mixed episode is characterized by the criteria for a manic episode in conjunction with those for a major depressive episode (depressed mood loss of interest or pleasure in nearly all activities).
L'efficacité de DePakote ER est basée en partie sur des études de Depakote (divalproex sodium retardée de comprimés de libération) dans cette indication et a été confirmé dans un essai de 3 semaines avec des patients répondant aux critères TRO DSM-IV pour le trouble bipolaire I ou mixte qui ont été hospitalisés pour la manie aiguë [ Études cliniques ].
L'efficacité du valproate pour une utilisation à long terme dans la manie, c'est-à-dire plus de 3 semaines n'a été démontrée dans les essais cliniques contrôlés. Par conséquent, les prestataires de soins de santé qui choisissent d'utiliser Depakote ER pendant de longues périodes devraient continuellement réévaluer le risque à long terme du médicament pour le patient individuel.
Épilepsie
Depakote ER is indicated as monotherapy et adjunctive therapy in the treatment of adult patients et pediatric patients down to the age of 10 years with complex partial seizures that occur either in isolation or in association with other types of seizures. Depakote ER is also indicated for use as sole et adjunctive therapy in the treatment of Saisies d'absence simples et complexes in adults et children 10 years of age or older et adjunctively in adults et children 10 years of age or older with multiple seizure types that include absence seizures.
Une simple absence est définie comme un trouble très brève du sensorium ou une perte de conscience accompagnée de certains décharges épileptiques généralisées sans autres signes cliniques détectables. L'absence complexe est le terme utilisé lorsque d'autres signes sont également présents.
Migraine
Depakote ER is indicated for prophylaxis of migraine mal de têtes. There is no evidence that Depakote ER is useful in the acute treatment of migraine mal de têtes.
Limitations importantes
En raison du risque pour le fœtus d'une diminution des troubles neurodéveloppementaux du QI, les anomalies du tube neural et d'autres malformations congénitales majeures qui peuvent survenir très tôt dans la grossesse, le valproate ne devrait pas être utilisée pour traiter les femmes atteintes d'épilepsie ou de trouble bipolaire qui sont enceintes ou qui planent non plus enceintes. Valproate ne doit pas être administré à une femme en potentiel de procréation à moins que d'autres médicaments n'étaient à fournir un contrôle adéquat des symptômes ou sont autrement inacceptables [voir AVERTISSEMENTS AND PRÉCAUTIONS Utiliser dans des populations spécifiques et Informations de conseil des patients ].
Pour la prophylaxie des maux de tête de migraine, Depakote ER est contre-indiqué chez les femmes enceintes et chez les femmes à potentiel de procréation qui n'utilisent pas de contraception efficace [voir Contre-indications ].
Le dosage pour Depakote est
Depakote ER is an extended-release product intended for once-a-day oral administration. Depakote ER tablets should be swallowed whole et should not be crushed or chewed.
Manie
Depakote ER tablets are administered orally. The recommended initial dose is 25 mg/kg/day given once daily. The dose should be increased as rapidly as possible to achieve the lowest therapeutic dose which produces the desired clinical effect or the desired range of plasma concentrations. In a placebo-controlled clinical trial of acute mania or mixed type patients were dosed to a clinical response with a trough plasma concentration between 85 et 125 mcg/mL. The maximum recommended dosage is 60 mg/kg/day.
Il n'y a pas de preuves disponibles à partir d'essais contrôlés pour guider un clinicien dans la gestion à plus long terme d'un patient qui s'améliore pendant le traitement de Depakote ER d'un épisode maniaque aigu. Bien qu'il soit généralement convenu que le traitement pharmacologique au-delà d'une réponse aiguë dans la manie est souhaitable à la fois pour le maintien de la réponse initiale et pour la prévention des nouveaux épisodes maniaques, il n'y a pas de données pour soutenir les avantages du dépassement ER dans un traitement à plus long terme (c'est-à-dire au-delà de 3 semaines).
Épilepsie
Depakote ER (divalproex sodium) extended-release tablets are administered orally et must be swallowed whole. As Depakote ER dosage is titrated upward concentrations of clonazepam diazepam ethosuximide lamotrigine tolbutamide phenobarbital carbamazepine et/or phenytoin may be affected [see Interactions médicamenteuses ].
Convulsions partielles complexes
Pour les adultes et les enfants de 10 ans ou plus.
Monothérapie (thérapie initiale)
Depakote ER has not been systematically studied as initial therapy. Patients should initiate therapy at 10 to 15 mg/kg/day. The dosage should be increased by 5 to 10 mg/kg/week to achieve optimal clinical response. Ordinarily optimal clinical response is achieved at daily doses below 60 mg/kg/day. If satisfactory clinical response has not been achieved plasma levels should be measured to determine whether or not they are in the usually accepted therapeutic range (50 to 100 mcg/mL). No recommendation regarding the safety of valproate for use at doses above 60 mg/kg/day can be made.
La probabilité de thrombocytopénie augmente considérablement aux concentrations plasmatiques totales de valproate auge supérieures à 110 mcg / ml chez les femmes et 135 mcg / ml chez les hommes. L'avantage d'une amélioration du contrôle des crises avec des doses plus élevées doit être pesée avec la possibilité d'une plus grande incidence de réactions indésirables.
Conversion en monothérapie
Les patients doivent lancer un traitement entre 10 et 15 mg / kg / jour. La posologie doit être augmentée de 5 à 10 mg / kg / semaine pour obtenir une réponse clinique optimale. Une réponse clinique ordinaire optimale est obtenue à des doses quotidiennes inférieures à 60 mg / kg / jour. Si une réponse clinique satisfaisante n'a pas été atteinte à des taux plasmatiques doit être mesurée pour déterminer s'ils se trouvent ou non dans la plage thérapeutique généralement acceptée (50 à 100 mcg / ml). Aucune recommandation concernant la sécurité du valproate pour une utilisation à des doses supérieures à 60 mg / kg / jour ne peut être faite.
Le dose concomitante du médicament antiépilepsie (AED) peut normalement être réduit d'environ 25% toutes les 2 semaines. Cette réduction peut être lancée au début de la thérapie par Depakote ou retardée de 1 à 2 semaines en cas de craignant que les crises soient susceptibles de se produire avec une réduction. La vitesse et la durée du retrait de l'AED concomitantes peuvent être très variables et les patients doivent être surveillés de près au cours de cette période pour une fréquence accrue de crise.
Thérapie complémentaire
Depakote ER may be added to the patient's regimen at a dosage of 10 to 15 mg/kg/day. The dosage may be increased by 5 to 10 mg/kg/week to achieve optimal clinical response. Ordinarily optimal clinical response is achieved at daily doses below 60 mg/kg/day. If satisfactory clinical response has not been achieved plasma levels should be measured to determine whether or not they are in the usually accepted therapeutic range (50 to 100 mcg/mL). No recommendation regarding the safety of valproate for use at doses above 60 mg/kg/day can be made.
Dans une étude de la thérapie complémentaire pour des crises partielles complexes dans lesquelles les patients recevaient de la carbamazépine ou de la phénytoïne en plus du valproate sans ajustement de carbamazépine ou de phénytoïne était nécessaire [voir Études cliniques ]. However since valproate may interact with these or other concurrently administered AEDs as well as other drugs periodic plasma concentration determinations of concomitant AEDs are recommended during the early course of therapy [see Interactions médicamenteuses ].
Saisies d'absence simples et complexes
La dose initiale recommandée est de 15 mg / kg / jour augmentant à des intervalles d'une semaine de 5 à 10 mg / kg / jour jusqu'à ce que les crises soient contrôlées ou que les effets secondaires empêchent les augmentations supplémentaires. La dose maximale recommandée est de 60 mg / kg / jour.
Une bonne corrélation n'a pas été établie entre les concentrations sériques de dose quotidiennes et l'effet thérapeutique. Cependant, la concentration sérique de valproate thérapeutique pour la plupart des patients avec des crises d'absence est considérée comme allant de 50 à 100 mcg / ml. Certains patients peuvent être contrôlés avec des concentrations sériques plus faibles ou supérieures [voir Pharmacologie clinique ].
Comme le dosage de Depakote ER est titré des concentrations de sang ascendantes de phénobarbital et / ou de phénytoïne peuvent être affectées [voir Interactions médicamenteuses ].
Les médicaments antiépilepsie ne devraient pas être brusquement interrompus chez les patients chez qui le médicament est administré pour prévenir les crises majeures en raison de la forte possibilité de précipitation de statut d'épileptique avec hypoxie et menace pour la vie.
Migraine
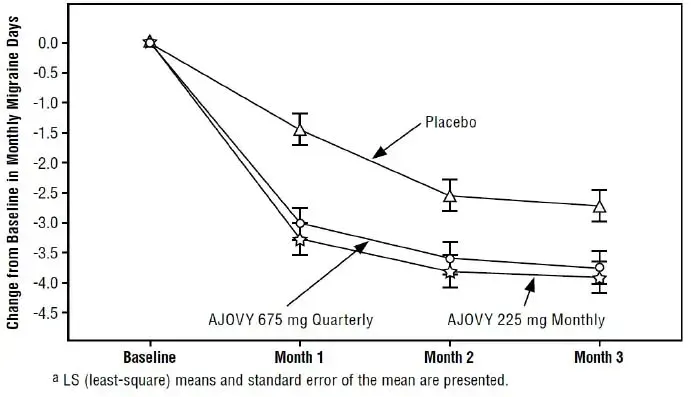
Depakote ER is indicated for prophylaxis of migraine mal de têtes in adults.
La dose de départ recommandée est de 500 mg une fois par jour pendant 1 semaine par la suite, passant à 1000 mg une fois par jour. Bien que des doses autres que 1000 mg une fois par jour de Depakote ER n'ait pas été évaluée chez les patients atteints de migraine, la gamme de dose effective de Depakote (divalproex sodium à libération de comprimés à libération) chez ces patients est de 500-1000 mg / jour. Comme pour les autres produits valproate, les doses de Depakote ER doivent être individualisées et un ajustement de dose peut être nécessaire. Si un patient nécessite des ajustements de dose plus petits que celui disponible avec Depakote ER Depakote doit être utilisé à la place.
La conversion de Depakote en Depakote est
Chez les patients adultes et les patients pédiatriques, 10 ans ou plus atteints d'épilepsie recevant auparavant Depakote Depakote ER doit être administré une fois par jour en utilisant une dose de 8 à 20% plus élevée que la dose quotidienne totale de Depakote (tableau 1). Pour les patients dont la dose quotidienne totale de dépakote ne peut pas être directement convertie en considération de Dépakote ER peut être donnée à la discrétion du clinicien pour augmenter la dose quotidienne totale du dépaskote du patient à la posologie suivante avant de se convertir à la dose quotidienne totale appropriée de Depakote ER.
Tableau 1: Conversion de dose
| Depakote Total Daily Dose (mg) | Depakote ER (mg) |
| 500 * - 625 | 750 |
| 750 * - 875 | 1000 |
| 1000 * -1125 | 1250 |
| 1250-1375 | 1500 |
| 1500-1625 | 1750 |
| 1750 | 2000 |
| 1875-2000 | 2250 |
| 2125-2250 | 2500 |
| 2375 | 2750 |
| 2500-2750 | 3000 |
| 2875 | 3250 |
| 3000-3125 | 3500 |
| * Ces doses quotidiennes totales de Depakote ne peuvent pas être directement converties en une dose quotidienne totale de 8 à 20% plus élevée de Depakote ER car les forces de dosage requises de Depakote ER ne sont pas disponibles. Une considération peut être accordée à la discrétion du clinicien pour augmenter la dose quotidienne totale de Depakote du patient à la dose plus élevée suivante avant de se convertir à la dose quotidienne totale appropriée de Depakote ER. |
Les données sont insuffisantes pour permettre une recommandation de facteur de conversion pour les patients atteints de doses de dépakote supérieures à 3125 mg / jour. Les concentrations plasmatiques de valproate CMIN pour Depakote ER en moyenne sont équivalentes à Depakote mais peuvent varier selon les patients à l'autre après la conversion. Si une réponse clinique satisfaisante n'a pas été atteinte à des taux plasmatiques doit être mesuré pour déterminer s'ils sont ou non dans la plage thérapeutique généralement acceptée (50 à 100 mcg / ml) [voir Pharmacologie clinique ].
Conseils de dosage général
Dosage chez les patients âgés
En raison d'une diminution de la clairance non liée du valproate et peut-être d'une plus grande sensibilité à la somnolence chez les personnes âgées, la dose de départ devrait être réduite chez ces patients. Les doses de démarrage chez les personnes âgées inférieures à 250 mg ne peuvent être obtenues qu'en utilisation de Depakote. La posologie doit être augmentée plus lentement et avec une surveillance régulière de la somnolence des liquides et de la consommation nutritionnelle de l'apport et d'autres effets indésirables. Les réductions de dose ou l'arrêt du valproate doivent être prises en compte chez les patients présentant une diminution de l'alimentation ou de l'apport fluide et chez les patients présentant une somnolence excessive. La dose thérapeutique ultime doit être obtenue sur la base de la tolérabilité et de la réponse clinique [voir AVERTISSEMENTS AND PRÉCAUTIONS Utiliser dans des populations spécifiques et Pharmacologie clinique ].
Réactions indésirables liées à la dose
La fréquence des effets indésirables (en particulier les enzymes hépatiques élevées et la thrombocytopénie) peuvent être liées à la dose. La probabilité de thrombocytopénie semble augmenter de manière significative à des concentrations totales de valproate ≥ 110 mcg / ml (femmes) ou ≥ 135 mcg / ml (hommes) [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. The benefit of improved therapeutic effect with higher doses should be weighed against the possibility of a greater incidence of adverse reactions.
G.I. Irritation
Les patients qui éprouvent G.I. L'irritation peut bénéficier de l'administration du médicament avec de la nourriture ou en renforçant lentement la dose à partir d'un niveau bas initial.
Conformité
Les patients doivent être informés de prendre Depakote ER chaque jour comme prescrit. Si une dose est manquée, elle doit être prise dès que possible, sauf s'il est presque temps pour la prochaine dose. Si une dose est ignorée, le patient ne doit pas doubler la dose suivante.
Dosage chez les patients prenant du rfinamide
Les patients se sont stabilisés sur du rfinamide avant de se faire prescrire du valproate doivent commencer le traitement au valproate à faible dose et titrer à une dose cliniquement efficace [voir Interactions médicamenteuses ].
Comment fourni
Dosage Forms And Strengths
Depakote ER 250 mg Contient le divalproex sodium équivalent à 250 mg d'acide valproïque dans chaque comprimé et est disponible en tant que:
- Comprimés d'ovaloïde blancs avec le logo A et le code hf
- Comprimés d'ovaloïde blancs avec le code hf
Depakote ER 500 mg Contient le divalproex sodium équivalent à 500 mg d'acide valproïque dans chaque comprimé et est disponible en tant que:
- Comprimés d'ovaloïde gris avec le logo A et le code HC
- Comprimés d'ovaloïde gris avec le code HC
Stockage et manipulation
Depakote ER 250 mg est disponible sous forme de comprimés ovaloïdes blancs contenant du divalproex sodium équivalent à 250 mg d'acide valproïque dans chaque comprimé dans les tailles d'emballage suivantes:
Bouteilles de 100 tablettes avec le logo A et le code hf - NDC 0074-3826-13
Bouteilles de 100 comprimés avec le code hf - NDC 0074-7401-13
Depakote ER 500 mg est disponible sous forme de comprimés ovaloïdes gris contenant du divalproex sodium équivalent à 500 mg d'acide valproïque dans chaque comprimé dans les tailles d'emballage suivantes:
Bouteilles de 100 comprimés avec le logo A et le code HC - NDC 0074-7126-13
Bouteilles de 100 tablettes avec le code HC - NDC 0074-7402-13
Bouteilles de 500 tablettes avec le logo A et le code HC - NDC 0074-7126-53
Packages de dose unitaire de 100 tablettes avec le logo A et le code HC - NDC 0074-7126-11
Stockage recommandé
Stocker les comprimés à 25 ° C (77 ° F); Excursions autorisées à 15-30 ° C (59-86 ° F) [voir Température ambiante contrôlée par l'USP ].
Fabriqué par: Depakote ER Tablets: 250 mg est MFD. par Abbvie Ltd Barceloneta PR 00617 500 mg est MFD. par Abbvie Inc. North Chicago IL 60064 U.S.A. ou Abbvie Ltd Barceloneta PR 00617 pour Abbvie Inc. North Chicago IL 60064 U.S.A. DePakote comprimés à libération retardée: MFD. par Abbvie Ltd Barceloneta PR 00617 pour Abbvie Inc. North Chicago IL 60064 U.S.A. Depakote Sprinkle Capsules: AbbVie Inc. North Chicago IL 60064 U.S.A. Révisé: mars 2024
Effets secondaires for Depakote ER
Les réactions indésirables graves suivantes sont décrites ci-dessous et ailleurs dans l'étiquetage:
- Échec hépatique [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Malformations congénitales [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Diminution du QI suivant une exposition utero [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Pancréatite [see AVERTISSEMENTS AND PRÉCAUTIONS ]
- Encéphalopathie hyperammonémique [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Comportement suicidaire et idéation [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Saignement et autres troubles hématopoïétiques [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Hypothermie [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Réaction médicamenteuse avec l'éosinophilie et les symptômes systémiques (habillage) / réactions d'hypersensibilité multiorganiques [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
- Somnolence chez les personnes âgées [voir AVERTISSEMENTS AND PRÉCAUTIONS ]
Étant donné que les études cliniques sont menées dans des conditions très variables les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux dans les études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Des informations sur les effets indésirables pédiatriques sont présentées dans la section 8.
Manie
L'incidence des événements émergentes au traitement a été déterminée sur la base de données combinées de deux essais cliniques contrôlés par un placebo de trois semaines de Depakote ER dans le traitement des épisodes maniaques associés au trouble bipolaire.
Le tableau 3 résume les effets indésirables rapportés pour les patients de ces essais où le taux d'incidence dans le groupe traité par DePakote était supérieur à 5% et supérieur à l'incidence du placebo.
Tableau 3: Réactions indésirables rapportées par> 5% des patients traités par Depakote lors d'essais contrôlés par placebo de manie aiguë1
| Événement indésirable | Depakote ER (n = 338)% | Placebo (n = 263)% |
| Somnolence | 26 | 14 |
| Dyspepsie | 23 | 11 |
| Nausée | 19 | 13 |
| Vomissement | 13 | 5 |
| Diarrhée | 12 | 8 |
| Vertiges | 12 | 7 |
| Douleur | 11 | 10 |
| Douleurs abdominales | 10 | 5 |
| Blessure accidentelle | 6 | 5 |
| Asthénie | 6 | 5 |
| Pharyngite | 6 | 5 |
| 1 Les réactions / événements indésirables suivants se sont produits à une incidence égale ou plus élevée pour le placebo que pour Depakote ER: Maux de tête |
Les effets indésirables supplémentaires suivants ont été rapportés par plus de 1% des patients traités par DePakote ER dans des essais cliniques contrôlés:
Corps dans son ensemble: Les frissons de douleur au dos des refroidissements et le niveau du médicament de la fièvre ont augmenté le syndrome de la grippe infection infection à l'infection rigidité du cou fongique.
Système cardiovasculaire: Hypotension d'hypertension de l'arythmie Hypotension posturale.
Système digestif: Constipation Dysphagie de la bouche sèche Dysphagie fécale Incontinence Flatroentérite Glossite Gum Hémorragie Ulcération buccale.
Système hémic et lymphatique: Le temps de saignement de l'anémie a augmenté l'ecchymose leucopénie.
Troubles métaboliques et nutritionnels: Hypoprotéinémie œdème périphérique.
Système musculo-squelettique: Myalgie de l'arthrose.
Système nerveux: Agitation anormale Agitation Réaction catatonique Hallucinations Dysarthrie HYPORTONIA Hypokinésie Psychose Réflexes Augmentation du trouble du sommeil Dyskinésie Tardive Tremor.
Système respiratoire: Rhinite à hoquet.
Peau et appendices: Érythémate de loup discoïde érythème érythème nodose furunculose éruption maculopapulaire de l'embarrhes de l'embounure de la séborrhée transpirant une éruption cutanée vésiculobullous.
Sens spéciaux: Conjonctivite Dry Eyes Trouble Eye Douleur oculaire Photophobie Perversion.
Système urogénital: Cystite Infection des voies urinaires Vaginite des troubles menstruels.
Épilepsie
Sur la base d'un essai contrôlé par placebo de thérapie d'appoint pour le traitement des crises partielles complexes Depakote a généralement été bien tolérée avec la plupart des effets indésirables évalués comme légers à modérés en gravité. L'intolérance était la principale raison de l'arrêt chez les patients traités par Depakote (6%) contre 1% des patients traités par placebo.
Le tableau 4 énumère les effets indésirables émergents du traitement qui ont été rapportés par ≥ 5% des patients traités par Depakote et pour lesquels l'incidence était supérieure à celle du groupe placebo dans l'essai contrôlé par placebo de thérapie complémentaire pour le traitement des crises partielles complexes. Étant donné que les patients ont également été traités avec d'autres médicaments antiépilepsie, il n'est pas possible de déterminer si les effets indésirables suivants peuvent être attribués à DePakote seul ou à la combinaison de Depakote et d'autres médicaments antiépilepsie.
Tableau 4: Réactions indésirables rapportées par ≥ 5% des patients traités par valproate pendant l'essai contrôlé par placebo sur le traitement complémentaire pour des crises partielles complexes
| Système / événement du corps | Depakote (N = 77)% | Placebo (N = 70)% |
| Le corps dans son ensemble | ||
| Mal de tête | 31 | 21 |
| Asthénie | 27 | 7 |
| Fièvre | 6 | 4 |
| Système gastro-intestinal | ||
| Nausée | 48 | 14 |
| Vomissement | 27 | 7 |
| Douleurs abdominales | 23 | 6 |
| Diarrhée | 13 | 6 |
| Anorexie | 12 | 0 |
| Dyspepsie | 8 | 4 |
| Constipation | 5 | 1 |
| Système nerveux | ||
| Somnolence | 27 | 11 |
| Tremblement | 25 | 6 |
| Vertiges | 25 | 13 |
| Dipropie | 16 | 9 |
| Amblyopie / vision floue | 12 | 9 |
| Ataxie | 8 | 1 |
| Nystagmus | 8 | 1 |
| Labilité émotionnelle | 6 | 4 |
| Penser anormal | 6 | 0 |
| Amnésie | 5 | 1 |
| Système respiratoire | ||
| Syndrome de la grippe | 12 | 9 |
| Infection | 12 | 6 |
| Bronchite | 5 | 1 |
| Rhinite | 5 | 4 |
| Autre | ||
| Alopécie | 6 | 1 |
| Perte de poids | 6 | 0 |
Le tableau 5 énumère les effets indésirables émergents du traitement qui ont été rapportés par ≥ 5% des patients du groupe de valproate à forte dose et pour laquelle l'incidence était supérieure à celle du groupe à faible dose dans un essai contrôlé de traitement de la monothérapie de dépakote des crises partielles complexes. Étant donné que les patients étaient titrés d'un autre médicament antiépilepsie au cours de la première partie de l'essai, il n'est pas possible dans de nombreux cas de déterminer si les effets indésirables suivants peuvent être attribués à Depakote seul ou à la combinaison de valproate et d'autres médicaments antiépilepsie.
Tableau 5: Réactions indésirables rapportées par ≥ 5% des patients du groupe à forte dose dans l'essai contrôlé de la monothérapie de valproate pour des crises partielles complexes1
Quelle résistance l'hydrocodone est-elle
| Système / événement du corps | Dose élevée (n = 131)% | Basse dose (n = 134)% |
| Le corps dans son ensemble | ||
| Asthénie | 21 | 10 |
| Système digestif | ||
| Nausée | 34 | 26 |
| Diarrhée | 23 | 19 |
| Vomissement | 23 | 15 |
| Douleurs abdominales | 12 | 9 |
| Anorexie | 11 | 4 |
| Dyspepsie | 11 | 10 |
| Système hémic / lymphatique | ||
| Thrombocytopeni a | 24 | 1 |
| Ecchymose | 5 | 4 |
| Métabolique / n utrtionnel | ||
| Prise de poids | 9 | 4 |
| Œdème périphérique | 8 | 3 |
| Système nerveux | ||
| Tremblement | 57 | 19 |
| Somnolence | 30 | 18 |
| Vertiges | 18 | 13 |
| Insomnie | 15 | 9 |
| Nervosité | 11 | 7 |
| Amnésie | 7 | 4 |
| Nystagmus | 7 | 1 |
| Dépression | 5 | 4 |
| Système respiratoire | ||
| Infection | 20 | 13 |
| Pharyngite | 8 | 2 |
| Dyspnée | 5 | 1 |
| Peau et appendices | ||
| Alopécie | 24 | 13 |
| Sens spéciaux | ||
| Amblyopie / vision floue | 8 | 4 |
| Sonnerie | 7 | 1 |
| 1 Mal de tête was the only adverse event that occurred in ≥5% of patients in the high dose group et at an equal or greater incidence in the low dose group. |
Les effets indésirables supplémentaires suivants ont été rapportés par plus de 1% mais moins de 5% des 358 patients traités avec du valproate dans les essais contrôlés de crises partielles complexes:
Corps dans son ensemble: Pain de dos malaise poitrine de poitrine.
Système cardiovasculaire: Palpitation de l'hypertension de tachycardie.
Système digestif: Augmentation de l'appétit de flatulence hématemèse éructation pancréatite parodontal abcès.
Système hémic et lymphatique: Petechia.
Troubles métaboliques et nutritionnels: SGOT a augmenté le SGPT a augmenté.
Système musculo-squelettique: Myalgie Twitching Arthralgia Cramps Cramps Myasthenia.
Système nerveux: Confusion d'anxiété Confusion anormale Paresthésie Hypertonia Incoordination ANNORMAL DREAMS TRUSSANDER Personnalité.
Système respiratoire: La toux de la sinusite a augmenté l'épistaxis de la pneumonie.
Peau et appendices: Peau sèche prurit éruption.
Sens spéciaux: Perversion du goût anormal de la surdité de l'otite moyenne.
Système urogénital: Incontinence urinaire Vaginite dysménorrhée Fréquence urinaire amenorrhée.
Migraine
Sur la base de deux essais cliniques contrôlés par placebo et leur valproate d'extension à long terme a été généralement bien toléré avec la plupart des effets indésirables considérés comme légers à modérés en gravité. Sur les 202 patients exposés au valproate dans les essais contrôlés par placebo, 17% ont interrompu pour l'intolérance. Ceci est comparé à un taux de 5% pour les 81 patients placebo. Y compris l'étude d'extension à long terme, les réactions indésirables rapportées comme principale raison de l'arrêt par ≥ 1% des 248 patients traités à un valproate étaient des tremblements de poids (6%) de nausées et / ou de vomissements (5%) (2%) de somnolence (1%) SGOT et / ou SGPT (1%) et de dépression (1%).
Le tableau 6 comprend les effets indésirables rapportés pour les patients de l'essai contrôlé par placebo où le taux d'incidence dans le groupe traité par DePakote était supérieur à 5% et était supérieur à celui des patients placebo.
Tableau 6: Réactions indésirables rapportées par> 5% des patients traités par DePakote ER pendant l'essai contrôlé par le placebo de la migraine avec une incidence plus importante que les patients prenant un placebo1
| Événement du système corporel | Depakote ER (n = 122)% | Placebo (n = 115)% |
| Système gastro-intestinal | ||
| Nausée | 15 | 9 |
| Dyspepsie | 7 | 4 |
| Diarrhée | 7 | 3 |
| Vomissement | 7 | 2 |
| Douleurs abdominales | 7 | 5 |
| Système nerveux | ||
| Somnolence | 7 | 2 |
| Autre | ||
| Infection | 15 | 14 |
| 1 Les effets indésirables suivants se sont produits chez 5% des patients traités par DePakote ER et à une incidence plus importante pour le placebo que pour Depakote ER: Asthénie et syndrome de la grippe. |
Les effets indésirables supplémentaires suivants ont été rapportés par plus de 1% mais pas plus de 5% des patients traités par DePakote ER et avec une incidence plus importante que le placebo dans l'essai clinique contrôlé par placebo pour la prophylaxie de la migraine:
Corps dans son ensemble: Infection virale accidentelle.
Système digestif: Augmentation du trouble des dents d'appétit.
Troubles métaboliques et nutritionnels: Gain de poids d'œdème.
Système nerveux: GAIT anormale vertigineuse d'hypertonie insomnie nervence Tremor vertigo.
Système respiratoire: Pharyngite rhinitis.
Peau et appendices: Éruption cutanée.
Sens spéciaux: Sonnerie.
Le tableau 7 comprend les effets indésirables rapportés pour les patients des essais contrôlés par placebo où le taux d'incidence dans le groupe traité au valproate était supérieur à 5% et était supérieur à celui des patients placebo.
Tableau 7: Réactions indésirables rapportées par> 5% des patients traités au valproate pendant les essais contrôlés par le placebo migraine avec une incidence plus importante que les patients prenant un placebo1
| Réaction du système corporel | Depakote (n = 202)% | Placebo (n = 81)% |
| Système gastro-intestinal | ||
| Nausée | 31 | 10 |
| Dyspepsie | 13 | 9 |
| Diarrhée | 12 | 7 |
| Vomissement | 11 | 1 |
| Douleurs abdominales | 9 | 4 |
| Appétit accru | 6 | 4 |
| Système nerveux | ||
| Asthénie | 20 | 9 |
| Somnolence | 17 | 5 |
| Vertiges | 12 | 6 |
| Tremblement | 9 | 0 |
| Autre | ||
| Prise de poids | 8 | 2 |
| Maux de dos | 8 | 6 |
| Alopécie | 7 | 1 |
| 1 Les effets indésirables suivants se sont produits chez plus de 5% des patients traités par Depakote et à une incidence plus importante pour le placebo que pour Depakote: syndrome de la grippe et pharyngite. |
Les effets indésirables supplémentaires suivants ont été rapportés par plus de 1% mais pas plus de 5% des 202 patients traités au valproate dans les essais cliniques contrôlés:
Corps dans son ensemble: Douleur thoracique.
Système cardiovasculaire: Vaso-dilatation.
Système digestif: Constipation dry mouth flatulence et stomatitis.
Système hémic et lymphatique: Ecchymose.
Troubles métaboliques et nutritionnels: Œdème périphérique.
Système musculo-squelettique: Crampes aux jambes.
Système nerveux: Rêves anormaux Confusion Têthésie Paresthésie Trouble de la parole et anomalies pensées.
Système respiratoire: Dyspnée et sinusitis.
Peau et appendices: Prurit.
Système urogénital: Métrorragie.
Expérience de commercialisation de la poste
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Depakote. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Dermatologique: La texture des cheveux modifie la couleur des cheveux modifie la photosensibilité érythème multiforme de nécrolyse épidermique toxique troubles des ongles et des ongles et syndrome de Stevens-Johnson.
Psychiatrique: Émotionnel bouleversé psychose agression psychomotor hyperactivité hostilité trouble dans le trouble d'apprentissage de l'attention et la détérioration comportementale.
Neurologique: Convulsion paradoxale Parkinsonisme
Il y a eu plusieurs rapports de déclin cognitif aigu ou subaiguë et de changements comportementaux (apathie ou irritabilité) avec la pseudoatrophie cérébrale sur l'imagerie associée à la thérapie valproate; Les changements cognitifs / comportementaux et la pseudoatrophie cérébrale se sont renversés partiellement ou entièrement après l'arrêt de la valproate.
Il y a eu des rapports d'encéphalopathie aiguë ou subaiguë en l'absence de niveaux élevés d'ammoniac de niveaux de valproate élevés ou de changements de neuroimagerie. L'encéphalopathie s'est renversée partiellement ou entièrement après l'arrêt du valproate.
Musculo-squelette: Les fractures ont diminué l'ostéoporose et la faiblesse de la densité des minéraux osseuses.
Hématologique: Lymphocytose relative macrocytose leukopénie a acquis l'anémie anomalie de Pelger-Huet, y compris macrocytaire avec ou sans déficit de folie, suppression de la moelle osseuse pancytopénie anémie aplasique agranulocytose et porphyrie intermitte aiguë.
Endocrine: Mentes irrégulières Hyperandrogénisme secondaire Hirsutisme Hirrsutisme élevé au niveau de la testostérone Afficalage du sein Galactorrhée Glandes parotide gonflement La maladie ovaire polykystique diminution des concentrations de carnitine Hyponatrémie hyperglycinémie et sécrétion inappropriée de l'ADH.
Il y a eu de rares rapports sur le syndrome de Fanconi se produisant principalement chez les enfants.
Métabolisme et nutrition: Gain de poids.
Reproducteur: Aspermia azoospermie a diminué le nombre de spermatozoïdes a diminué la motilité des spermatozoïdes infertilité masculine et la morphologie anormale des spermatozoïdes.
Génito-urinaire: Inursie infection des voies urinaires et néphrite tubulo-interstitielle.
Sens spéciaux: Perte auditive.
Autre: Réaction allergique Anaphylaxie Développement Détraquez la douleur osseuse Bradycardie et la vascularite cutanée.
Interactions médicamenteuses for Depakote ER
Effets des médicaments co-administrés sur le dégagement de valproate
Les médicaments qui affectent le niveau d'expression des enzymes hépatiques, en particulier ceux qui augmentent les niveaux de glucuronosyltransférases (comme le ritonavir) peuvent augmenter la clairance du valproate. Par exemple, la phénytoïne carbamazépine et le phénobarbital (ou primidone) peuvent doubler la clairance du valproate. Ainsi, les patients en monothérapie auront généralement des demi-vies plus longues et des concentrations plus élevées que les patients recevant de la polythérapie avec des médicaments antiépilepsie.
Dans les médicaments en revanche qui sont des inhibiteurs des isozymes du cytochrome P450, par ex. On peut s'attendre à ce que les antidépresseurs aient peu d'effet sur la clairance du valproate car l'oxydation médiée par le cytochrome P450 est une voie métabolique secondaire relativement mineure par rapport à la glucuronidation et à la bêta-oxydation.
En raison de ces changements dans la surveillance de la clairance du valproate des concentrations de valproate et de médicament concomitantes, il faut augmenter chaque fois que des médicaments induisant des enzymes sont introduits ou retirés.
La liste suivante fournit des informations sur le potentiel d'influence de plusieurs médicaments couramment prescrits sur la pharmacocinétique de valproate. La liste n'est pas exhaustive et ne pourrait pas l'être, car de nouvelles interactions sont en continu.
Médicaments pour lesquels une interaction potentiellement importante a été observée
Aspirine
Une étude impliquant la co-administration de l'aspirine à des doses antipyrétiques (11 à 16 mg / kg) avec du valproate aux patients pédiatriques (n = 6) a révélé une diminution de la liaison aux protéines et une inhibition du métabolisme du valproate. La fraction libre de valproate a augmenté de 4 fois en présence d'aspirine par rapport au valproate seul. La voie de β-oxydation composée d'acide 2-e-valproïque 3-OH-Valproic et de l'acide valproïque 3-céto a été réduite de 25% des métabolites totaux excrétés sur du valproate seul à 8,3% en présence d'aspirine. La question de savoir si l'interaction observée dans cette étude s'applique ou non aux adultes est inconnue, mais il faut observer que le valproate et l'aspirine doivent être co-administrés.
Antibiotiques carbapénèmes
Une réduction cliniquement significative de la concentration d'acide valproïque sérique a été rapportée chez les patients recevant des antibiotiques de carbapénème (par exemple Ertapenem imipenem méropénème; il ne s'agit pas d'une liste complète) et peut entraîner une perte de contrôle des crises. Le mécanisme de cette interaction n'est pas bien compris. Les concentrations sériques d'acide valproïque doivent être surveillées fréquemment après avoir initié le traitement au carbapénème. Un traitement antibactérien ou anticonvulsivant alternatif doit être pris en compte si les concentrations sériques d'acide valproïque baissent de manière significative ou si le contrôle des crises se détériore [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Contraceptifs hormonaux contenant les œstrogènes
Les contraceptifs hormonaux contenant des œstrogènes peuvent augmenter la clairance du valproate, ce qui peut entraîner une diminution de la concentration de valproate et une fréquence de crise potentiellement augmentée. Les prescripteurs doivent surveiller les concentrations de valproate sérique et la réponse clinique lors de l'ajout ou de l'arrêt des produits contenant des œstrogènes.
Felbamate
Une étude impliquant la co-administration de 1200 mg / jour de felbamate avec du valproate à des patients atteints d'épilepsie (n = 10) a révélé une augmentation de la concentration de pic de valproate moyenne de 35% (de 86 à 115 mcg / ml) par rapport au valproate seul. L'augmentation de la dose de felbamate à 2400 mg / jour a augmenté la concentration moyenne de pic de valproate à 133 mcg / ml (augmentation d'une autre augmentation de 16%). Une diminution de la dose de valproate peut être nécessaire lorsque le traitement par le felbamate est initié.
Méthotrexate
Méthotrexate may decrease serum valproate levels et potentially result in increased frequency of seizures or bipolar symptoms. Prescribers should monitor serum valproate concentrations et clinical response when adding or discontinuing méthotrexate et adjust valproate dosage if necessary.
Rifampin
Une étude impliquant l'administration d'une seule dose de valproate (7 mg / kg) 36 heures après 5 nuits de dosage quotidien avec de la rifampine (600 mg) a révélé une augmentation de 40% de la clairance orale du valproate. Un réglage de la dose de valproate peut être nécessaire lorsqu'il est co-administré avec la rifampin.
Effets du valproate sur d'autres médicaments
Le valproate s'est avéré être un faible inhibiteur de certaines isozymes de p450 hydrase et glucuronosyltransférases.
La liste suivante fournit des informations sur le potentiel d'influence de la co-administration de valproate sur la pharmacocinétique ou la pharmacodynamique de plusieurs médicaments couramment prescrits. La liste n'est pas exhaustive car de nouvelles interactions sont en continu.
Des médicaments pour lesquels une interaction potentiellement importante de valproate a été observée
Amitriptyline / nordriptyline
L'administration d'une seule dose orale de 50 mg d'amitriptyline à 15 volontaires normaux (10 hommes et 5 femmes) qui ont reçu du valproate (BID de 500 mg) a entraîné une diminution de 21% de la dégagement plasmatique de l'amitriptyline et une diminution de 34% de la clairance nette de la norme. Des rapports de commercialisation rares de commercialisation de l'utilisation simultanée de valproate et d'amitriptyline entraînant un niveau d'amitriptyline accru ont été reçus. L'utilisation concomitante du valproate et de l'amitriptyline a rarement été associée à la toxicité. La surveillance des niveaux d'amitriptyline doit être prise en compte pour les patients prenant du valproate concomitamment avec l'amitriptyline. Il convient de prendre en compte la réduction de la dose d'amitriptyline / nord-nord-nortriptyline en présence de valproate.
Carbamazépine / carbamazépine-1011-époxyde
Les taux sériques de carbamazépine (CBZ) ont diminué de 17% tandis que celui de la carbamazépine-1011-époxyde (CBZ-E) a augmenté de 45% lors de la co-administration de valproate et de CBZ aux patients épileptiques.
Clonazépam
L'utilisation concomitante de valproate et de clonazépam peut induire un statut d'absence chez les patients ayant des antécédents de type absence.
Diazépam
Valproate déplace le diazépam de ses sites de liaison à l'albumine de plasma et inhibe son métabolisme. La co-administration de valproate (1500 mg par jour) a augmenté la fraction libre du diazépam (10 mg) de 90% chez des volontaires sains (n = 6). La clairance du plasma et le volume de distribution pour le diazépam libre ont été réduits de 25% et 20% respectivement en présence de valproate. La demi-vie d'élimination du diazépam est restée inchangée lors de l'ajout de valproate.
Éthosuximide
Le valproate inhibe le métabolisme de l'éthosuximide. L'administration d'une seule dose d'éthosuximide de 500 mg avec du valproate (800 à 1600 mg / jour) à des volontaires sains (n = 6) s'est accompagné d'une augmentation de 25% de l'élimination de la demi-vie de l'éthosuximide et d'une diminution de 15% de sa dégagement total par rapport à l'éthosuxide seul. Les patients recevant du valproate et de l'éthosuximide en particulier avec d'autres anticonvulsivants doivent être surveillés pour des altérations des concentrations sériques des deux médicaments.
Lamotrigine
Dans une étude en régime permanent impliquant 10 volontaires sains, la demi-vie d'élimination de la lamotrigine est passée de 26 à 70 heures avec la co-administration de valproate (une augmentation de 165%). La dose de lamotrigine doit être réduite lorsqu'elle est co-administrée avec du valproate. Des réactions cutanées graves (comme le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique) ont été signalées avec l'administration concomitante de la lamotrigine et du valproate. Voir l'insert du package lamotrigine pour plus de détails sur le dosage de lamotrigine avec l'administration de valproate concomitante.
Phénobarbital
Valproate s'est avéré inhiber le métabolisme du phénobarbital. La co-administration de valproate (250 mg de soumission pendant 14 jours) avec des sujets phénobarbitaux aux sujets normaux (n = 6) a entraîné une augmentation de 50% de la demi-vie et une diminution de 30% de la clairance plasmatique du phénobarbital (60 mg unique). La fraction de la dose de phénobarbitale excrétée inchangée a augmenté de 50% en présence de valproate.
Il existe des preuves d'une dépression sévère du SNC avec ou sans élévations significatives des concentrations sériques de barbiturique ou de valproate. Tous les patients recevant une thérapie par barbiturique concomitante doivent être étroitement surveillés pour la toxicité neurologique. Des concentrations de barbiture sériques doivent être obtenues si possible et la dose de barbiture a diminué le cas échéant.
La primidone qui est métabolisée en barbiturique peut être impliquée dans une interaction similaire avec le valproate.
Lable
Valproate déplace la phénytoïne de ses sites de liaison à l'albumine plasmatique et inhibe son métabolisme hépatique. La co-administration de valproate (400 mg TID) avec de la phénytoïne (250 mg) chez les volontaires normales (n = 7) a été associée à une augmentation de 60% de la fraction libre de la phénytoïne. La clairance du plasma total et le volume apparent de distribution de la phénytoïne ont augmenté de 30% en présence de valproate. La clairance et le volume apparent de distribution de la phénytoïne libre ont été réduits de 25%.
Chez les patients atteints d'épilepsie, des crises de percée se produisent avec la combinaison de valproate et de phénytoïne. La posologie de la phénytoïne doit être ajustée comme l'exige la situation clinique.
Propofol
L'utilisation concomitante de valproate et de propofol peut entraîner une augmentation des taux sanguins de propofol. Réduisez la dose de propofol lors de la co-administration avec du valproate. Surveillez de près les patients pour des signes de sédation accrue ou de dépression cardiorespiratoire.
Rufinamide
Sur la base d'une analyse pharmacocinétique de la population, la clairance du rfinamide a été diminuée par le valproate. Les concentrations de rufinamide ont augmenté <16% to 70% dependent on concentration of valproate (with the larger increases being seen in pediatric patients at high doses or concentrations of valproate). Les patients se sont stabilisés sur du rfinamide avant de se faire prescrire du valproate doivent commencer le traitement au valproate à faible dose et titrer à une dose cliniquement efficace [voir Posologie et administration ]. Similarly patients on valproate should begin at a rufinamide dose lower than 10 mg/kg per day (pediatric patients) or 400 mg per day (adults).
Tolbutamide
D'après les expériences in vitro, la fraction non liée du tolbutamide est passée de 20% à 50% lorsqu'elle est ajoutée à des échantillons de plasma prélevés sur les patients traités par du valproate. La pertinence clinique de ce déplacement est inconnue.
Warfarine
Dans une étude in vitro, le valproate a augmenté la fraction non liée de la warfarine jusqu'à 32,6%. La pertinence thérapeutique de ceci est inconnue; Cependant, les tests de coagulation doivent être surveillés si le traitement par valproate est institué chez les patients prenant des anticoagulants.
Zidovudine
Chez six patients séropositifs pour le VIH, la clairance de la zidovudine (100 mg Q8H) a été diminuée de 38% après l'administration de valproate (250 ou 500 mg Q8H); La demi-vie de la zidovudine n'était pas affectée.
Topiramate
L'administration concomitante de valproate et de topiramate a été associée à l'hyperammonémie avec et sans encéphalopathie [voir Contre-indications et AVERTISSEMENTS AND PRÉCAUTIONS ]. Concomitant administration of topiramate with valproate has also been associated with hypothermia in patients who have tolerated either drug alone. It may be prudent to examine blood ammonia levels in patients in whom the onset of hypothermia has been reported [see AVERTISSEMENTS AND PRÉCAUTIONS ].
Cannabidiol
L'administration concomitante de valproate et de cannabidiol a été associée à un risque accru d'élévation de l'ALT et / ou de l'AST. Cela a été gérable par réduction de la dose ou dans des cas plus graves par l'arrêt d'un ou des deux médicaments. La fonction hépatique, y compris la transaminase sérique et les niveaux totaux de bilirubine, doit être surveillée pendant le traitement concomitant [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Les avertissements pour Depakote sont
Inclus dans le cadre du PRÉCAUTIONS section.
Les précautions pour Depakote sont
Hépatotoxicité
Informations générales sur l'hépatotoxicité
Une insuffisance hépatique entraînant des décès s'est produite chez les patients recevant du valproate. Ces incidents se sont généralement produits au cours des six premiers mois de traitement. L'hépatotoxicité grave ou mortelle peut être précédée de symptômes non spécifiques tels que la faiblesse de la faiblesse de la faiblesse de l'œdème facial et des vomissements. Chez les patients atteints d'épilepsie, une perte de contrôle des crises peut également se produire. Les patients doivent être surveillés de près pour l'apparition de ces symptômes. Des tests hépatiques sériques doivent être effectués avant le traitement et à des intervalles fréquents par la suite, en particulier au cours des six premiers mois de traitement de valproate. Cependant, les prestataires de soins de santé ne devraient pas s'appuyer totalement sur la biochimie sérique, car ces tests peuvent ne pas être anormaux dans tous les cas, mais devraient également considérer les résultats des antécédents médicaux provisoires et un examen physique minutieux.
Il convient de faire preuve de prudence lors de l'administration de produits de valproate aux patients ayant des antécédents de maladie hépatique. Patients sous plusieurs anticonvulsivants enfants Les personnes atteintes de troubles métaboliques congénitaux ceux qui souffrent de troubles de crise graves accompagnés d'un retard mental et de personnes atteintes d'une maladie cérébrale organique peuvent être à risque particulier. Voir ci-dessous les patients atteints d'une maladie mitochondriale connue ou suspectée.
L'expérience a indiqué que les enfants de moins de deux ans ont un risque considérablement accru de développer une hépatotoxicité mortelle, en particulier celles qui ont des conditions susmentionnées. Lorsque Depakote ER est utilisé dans ce groupe de patients, il doit être utilisé avec une extrême prudence et en tant qu'agent unique. Les avantages de la thérapie doivent être pesés avec les risques. Dans les groupes de patients progressivement plus âgés, l'expérience de l'épilepsie a indiqué que l'incidence de l'hépatotoxicité mortelle diminue considérablement.
Patients atteints de maladie mitochondriale connue ou suspectée
Depakote ER is contraindicated in patients known to have mitochondrial disorders caused by POLG mutations et children under two years of age who are clinically suspected of having a mitochondrial disorder [see Contre-indications ]. Valproate-induced acute liver failure et liver-related deaths have been reported in patients with hereditary neurometabolic syndromes caused by mutations in the gene for mitochondrial DNA polymerase γ (POLG) (e.g. Alpers-Huttenlocher Syndrome) at a higher rate than those without these syndromes. Most of the reported cases of liver failure in patients with these syndromes have been identified in children et adolescents.
Les troubles liés au POLG devraient être suspectés chez les patients ayant des antécédents familiaux ou des symptômes suggestifs d'un trouble lié au POLG, y compris, mais sans s'y limiter, à l'encéphalopathie réfractaire Épilepsie (focale myoclonique) Epilepticus à la présentation Développement de la régression psychomotor Migraine avec aura occipitale. Les tests de mutation Polg doivent être effectués conformément à la pratique clinique actuelle pour l'évaluation diagnostique de ces troubles. Les mutations A467T et W748S sont présentes chez environ 2/3 des patients atteints de troubles autosomiques liés à la POLG récessifs.
Chez les patients de plus de deux ans, qui sont cliniquement soupçonnés d'avoir une maladie mitochondriale héréditaire Depakote ER ne devrait être utilisée qu'après l'échec des autres anticonvulsivants. Ce groupe plus âgé de patients doit être étroitement surveillé pendant le traitement par Depakote ER pour le développement de lésions hépatiques aiguës avec des évaluations cliniques régulières et une surveillance des tests hépatiques sériques.
Le médicament doit être interrompu immédiatement en présence d'un dysfonctionnement hépatique significatif suspecté ou apparent. Dans certains cas, le dysfonctionnement hépatique a progressé malgré l'arrêt du médicament [voir Avertissement en boîte et Contre-indications ].
Malformations congénitales structurelles
Le valproate peut causer des dommages fœtaux lorsqu'il est administré à une femme enceinte. Les données du registre de la grossesse montrent que l'utilisation du valproate maternel peut provoquer des anomalies de tube neuronal et d'autres anomalies structurelles (par exemple les défauts craniofaciaux malformations cardiovasculaires HYPOSPASPADIA MALFORMATIONS DE LIB). Le taux de malformations congénitales chez les bébés nés de mères utilisant du valproate est environ quatre fois plus élevé que le taux chez les bébés nés de mères épileptiques utilisant d'autres monothérapies anti-seizure. Les preuves suggèrent que la supplémentation en acide folique avant la conception et au cours du premier trimestre de la grossesse diminue le risque de défauts de tubes neuronaux congénitaux dans la population générale [voir Utiliser dans des populations spécifiques ].
Diminution du QI suivant une exposition utero
Le valproate peut provoquer une diminution des scores de QI après une exposition in utero. Des études épidémiologiques publiées ont indiqué que les enfants exposés au valproate in utero ont des scores de test cognitifs plus faibles que les enfants exposés in utero à un autre médicament antiépileptique ou à aucun médicament antiépileptique. Le plus grand de ces études1 est une étude de cohorte prospective menée aux États-Unis et au Royaume-Uni qui a révélé que les enfants exposés prénatals au valproate (n = 62) avaient des scores de QI plus faibles à 6 ans (97 [95% c.i. 94-101]) que les enfants atteints d'exposition prénatale à l'autre antiépileptique Traitements de la monothérapie: lamotrigine (108%. La carbamazépine (105 [95% c.i.102 € 108]) et la phénytoïne (108 [95% c.i.104 € 112]). On ne sait pas quand pendant les effets cognitifs de la grossesse chez les enfants exposés au valproate se produisent. Parce que les femmes de cette étude ont été exposées à des médicaments antiépileptiques tout au long de la grossesse, si le risque de diminution du QI était lié à une période de temps particulière pendant la grossesse n'a pas pu être évaluée.
Bien que toutes les études disponibles aient des limites méthodologiques, le poids des preuves soutient la conclusion que l'exposition au valproate in utero peut entraîner une diminution du QI chez les enfants.
Dans les études animales, la progéniture avec une exposition prénatale au valproate a eu des malformations similaires à celles observées chez l'homme et a démontré des déficits neuro -haviores [voir Utiliser dans des populations spécifiques ].
Utilisation chez les femmes de potentiel de procréation
En raison du risque pour le fœtus de diminution des troubles neurodéveloppementaux du QI et des malformations congénitales majeures (y compris des anomalies du tube neuronal) qui peuvent se produire très tôt dans la grossesse, le valproate ne doit pas être administré à une femme de potentiel de maternité, sauf si d'autres médicaments n'ont pas réussi à fournir un contrôle adéquat des symptômes ou autrement inacceptable. Ceci est particulièrement important lorsque l'utilisation du valproate est considérée pour une condition non généralement associée à des blessures permanentes ou à la mort comme la prophylaxie des maux de tête de migraine [voir Contre-indications ]. Women should use effective contraception while using valproate.
Les femmes en potentiel de procréation doivent être conseillées régulièrement concernant les risques relatifs et les avantages de l'utilisation du valproate pendant la grossesse. Ceci est particulièrement important pour les femmes qui prévoient une grossesse et pour les filles au début de la puberté; Des options thérapeutiques alternatives doivent être prises en compte pour ces patients [voir Avertissement en boîte et Utiliser dans des populations spécifiques ].
Pour prévenir les crises majeures, le valproate ne doit pas être interrompu brusquement car cela peut précipiter le statut épileptique avec l'hypoxie maternelle et fœtale qui en résulte et menace la vie.
Les preuves suggèrent que la supplémentation en acide folique avant la conception et au cours du premier trimestre de la grossesse diminue le risque de malformations neurales congénitales dans la population générale. On ne sait pas si le risque de défauts du tube neural ou une diminution du QI chez la progéniture des femmes recevant du valproate est réduite par la supplémentation en acide folique. La supplémentation en acide folique alimentaire avant la conception et pendant la grossesse doit être systématiquement recommandée pour les patients utilisant du valproate.
Pancréatite
Des cas de pancréatite potentiellement mortels ont été signalés chez les enfants et les adultes recevant du valproate. Certains des cas ont été décrits comme hémorragiques avec une progression rapide des symptômes initiaux à la mort. Certains cas se sont produits peu de temps après l'utilisation initiale ainsi qu'après plusieurs années d'utilisation. Le taux basé sur les cas signalés dépasse les personnes attendues dans la population générale et il y a eu des cas dans lesquels la pancréatite s'est réapprovisionnée après la rechallenge avec le valproate. Dans les essais cliniques, il y avait 2 cas de pancréatite sans étiologie alternative chez 2416 patients représentant 1044 patients-années. Les patients et les tuteurs doivent être avertis que les douleurs abdominales vomissent les nausées et / ou l'anorexie peuvent être des symptômes de pancréatite qui nécessitent une évaluation médicale rapide. Si la pancréatite est diagnostiquée parpakote ER doit normalement être interrompue. Un traitement alternatif pour l'état médical sous-jacent doit être initié comme indiqué cliniquement [voir Avertissement en boîte ].
Troubles du cycle de l'urée
Depakote ER is contraindicated in patients with known urea cycle disorders (UCD).
L'encéphalopathie hyperammonémique parfois mortelle a été signalée après le début du traitement du valproate chez les patients atteints de troubles du cycle de l'urée Un groupe d'anomalies génétiques rares, en particulier une carence en ornithine transcarbamylase. Avant l'initiation de l'évaluation du traitement de DePakote ER pour l'UCD doit être pris en compte chez les patients suivants: 1) ceux ayant des antécédents d'encéphalopathie inexpliquée ou d'encéphalopathie de coma associée à une charge de protéine de charge protéique liée à la grossesse ou à l'encéphalopathie inexpliquée. 2) Ceux avec des vomissements cycliques et une létogie de l'irritabilité extrême d'irritabilité Aataxie BUN ou évitement des protéines; 3) ceux qui ont des antécédents familiaux de l'UCD ou des antécédents familiaux de décès infantiles inexpliqués (en particulier les hommes); 4) Ceux avec d'autres signes ou symptômes de l'UCD. Les patients qui développent des symptômes d'une encéphalopathie hyperammonémique inexpliquée lors de la réception d'un traitement au valproate devraient recevoir un traitement rapide (y compris l'arrêt de la thérapie de valproate) et être évaluée pour les troubles du cycle de l'urée sous-jacents [voir [voir Contre-indications et AVERTISSEMENTS AND PRÉCAUTIONS ].
Comportement suicidaire et idéation
Les médicaments antiépileptiques (AED), y compris le dépakote ER, augmentent le risque de pensées ou de comportement suicidaires chez les patients prenant ces médicaments pour toute indication. Les patients traités avec tout DEA pour toute indication doivent être surveillés pour l'émergence ou l'aggravation des pensées ou comportements suicidaires de dépression et / ou tout changement inhabituel d'humeur ou de comportement.
Analyses regroupées de 199 essais cliniques contrôlés par placebo (thérapie mono-et versitive) de 11 DEA différents ont montré que les patients randomisés pour l'un des DAE avaient environ deux fois le risque (risque relatif ajusté 1,8 à 95% IC: 1,2 2,7) de réflexion ou de comportement suicidaire comparé aux patients randomisés au placebo. Dans ces essais qui avaient une durée médiane de traitement de 12 semaines, le taux d'incidence estimé de comportement suicidaire ou d'idéation chez 27863 patients traités par AED était de 0,43% contre 0,24% chez 16029 patients traités par placebo représentant une augmentation d'environ un cas de réflexion ou de comportement suicidaire pour 530 patients traités. Il y avait quatre suicides chez les patients traités par médicaments dans les essais et aucun chez les patients traités par placebo, mais le nombre est trop petit pour permettre une conclusion sur l'effet du médicament sur le suicide.
Le risque accru de pensées ou de comportements suicidaires avec les DEA a été observé dès une semaine après avoir commencé le traitement médicamenteux avec des DEA et a persisté pour la durée du traitement évalué. Étant donné que la plupart des essais inclus dans l'analyse ne s'étendent pas au-delà de 24 semaines, le risque de pensées suicidaires ou de comportement au-delà de 24 semaines n'a pas pu être évaluée.
Le risque de pensées ou de comportements suicidaires était généralement cohérent parmi les médicaments dans les données analysées. La conclusion d'un risque accru avec les DEA de mécanismes d'action variables et à travers une gamme d'indications suggère que le risque s'applique à tous les DEA utilisés pour toute indication. Le risque ne varie pas considérablement selon l'âge (5 à 100 ans) dans les essais cliniques analysés.
Le tableau 2 montre un risque absolu et relatif par indication pour tous les DEA évalués.
Tableau 2: Risque par indication des médicaments antiépileptiques dans l'analyse regroupée
| Indication | Placebo Patients with Events Per 1000 Patients | Patiens de médicament avec des événements pour 1000 patients | Risque relatif: incidence des événements chez les patients atteints de médicament / incidence chez les patients placebo | Différence de risque: patients atteints de médicament supplémentaires avec des événements pour 1000 patients |
| Épilepsie | 1.0 | 3.4 | 3.5 | 2.4 |
| Psychiatrique | 5.7 | 8.5 | 1.5 | 2.9 |
| Autre | 1.0 | 1.8 | 1.9 | 0.9 |
| Total | 2.4 | 4.3 | 1.8 | 1.9 |
Le risque relatif de pensées ou de comportements suicidaires était plus élevé dans les essais cliniques pour l'épilepsie que dans les essais cliniques pour les conditions psychiatriques ou autres, mais les différences de risque absolues étaient similaires pour l'épilepsie et les indications psychiatriques.
Quiconque envisage de prescrire Depakote ER ou tout autre DAE doit équilibrer le risque de pensées ou de comportements suicidaires avec le risque de maladie non traitée. L'épilepsie et de nombreuses autres maladies pour lesquelles les DEA sont prescrites sont elles-mêmes associées à la morbidité et à la mortalité et à un risque accru de pensées et de comportement suicidaires. Si les pensées et les comportements suicidaires émergent pendant le traitement, le prescripteur doit examiner si l'émergence de ces symptômes chez un patient donné peut être liée à la maladie traitée.
Saignement et autres troubles hématopoïétiques
Le valproate est associé à une thrombocytopénie liée à la dose. Dans un essai clinique de valproate comme monothérapie chez les patients atteints d'épilepsie 34/126 patients (27%) recevant environ 50 mg / kg / jour en moyenne avaient au moins une valeur de plaquettes ≤ 75 x 109/ L. Environ la moitié de ces patients avaient un traitement interrompu avec le retour du nombre de plaquettes à la normale. Chez les patients restants, le nombre de plaquettes normalisé avec un traitement continu. Dans cette étude, la probabilité de thrombocytopénie semble augmenter considérablement à des concentrations totales de valproate ≥ 110 mcg / ml (femmes) ou ≥ 135 mcg / ml (mâles). Le bénéfice thérapeutique qui peut accompagner les doses plus élevées doit donc être évalué avec la possibilité d'une plus grande incidence d'effets indésirables. L'utilisation de valproate a également été associée à une diminution d'autres lignées cellulaires et à la myélodysplasie.
En raison des rapports d'inhibition des cytopénies de la phase secondaire de l'agrégation plaquettaire et des paramètres de coagulation anormaux (par exemple, de faibles déficiences du facteur de coagulation en fibrinogène, les mesures de la maladie de Von Willebrand) sont recommandées avant le traitement et à des intervalles périodiques. Il est recommandé que les patients recevant de dépakote ER soient surveillés pour la numérotation sanguine et les paramètres de coagulation avant la chirurgie planifiée et pendant la grossesse [voir Utiliser dans des populations spécifiques ]. Evidence of hemorrhage bruising or a disorder of hemostasis/coagulation is an indication for reduction of the dosage or withdrawal of therapy.
Hyperammonémie
Hyperammonémie has been reported in association with valproate therapy et may be present despite normal liver function tests. In patients who develop unexplained lethargy et vomissement or changes in mental status hyperammonemic encephalopathy should be considered et an ammonia level should be measured. Hyperammonémie should also be considered in patients who present with hypothermia [see AVERTISSEMENTS AND PRÉCAUTIONS ]. If ammonia is increased valproate therapy should be discontinued. Appropriate interventions for treatment of hyperammonemia should be initiated et such patients should undergo investigation for underlying urea cycle disorders [see Contre-indications et AVERTISSEMENTS AND PRÉCAUTIONS ].
Au cours de l'essai de manie pédiatrique contrôlé par placebo, un (1) chez vingt (20) adolescents (5%) traités avec du valproate a développé une augmentation des taux d'ammoniac plasmatique par rapport aux patients non (0) traités par placebo.
Les élévations asymptomatiques de l'ammoniac sont plus fréquentes et, lorsqu'elles sont présentes, nécessitent une surveillance étroite des taux d'ammoniac plasmatique. Si l'élévation persiste l'arrêt de la thérapie de valproate doit être envisagée.
Hyperammonémie And Encephalopathy Associated With Concomitant Topiramate Use
L'administration concomitante de topiramate et de valproate a été associée à une hyperammonémie à ou sans encéphalopathie chez les patients qui ont toléré l'un seul de médicament. Les symptômes cliniques de l'encéphalopathie hyperammonémique comprennent souvent des altérations aiguës du niveau de conscience et / ou de la fonction cognitive avec léthargie ou vomissements. L'hypothermie peut également être une manifestation de l'hyperammonémie [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. In most cases symptoms et signs abated with discontinuation of either drug. This adverse reaction is not due to a pharmacokinetic interaction. Patients with inborn errors of metabolism or reduced hepatic mitochondrial activity may be at an increased risk for hyperammonemia with or without encephalopathy. Although not studied an interaction of topiramate et valproate may exacerbate existing defects or unmask deficiencies in susceptible persons. In patients who develop unexplained lethargy vomissement or changes in mental status hyperammonemic encephalopathy should be considered et an ammonia level should be measured [see Contre-indications et AVERTISSEMENTS AND PRÉCAUTIONS ].
Hypothermie
Hypothermie defined as an unintentional drop in body core temperature to <35°C (95°F) has been reported in association with valproate therapy both in conjunction with et in the absence of hyperammonemia. This adverse reaction can also occur in patients using concomitant topiramate with valproate after starting topiramate treatment or after increasing the daily dose of topiramate [see Interactions médicamenteuses ]. Consideration should be given to stopping valproate in patients who develop hypothermia which may be manifested by a variety of clinical abnormalities including lethargy confusion coma et significant alterations in other major organ systems such as the cardiovascular et respiratory systems. Clinical management et assessment should include examination of blood ammonia levels.
Réaction médicamenteuse avec l'éosinophilie et les symptômes systémiques (habillage) / réactions d'hypersensibilité multiorganiques
La réaction médicamenteuse avec l'éosinophilie et les symptômes systémiques (robe) également connus sous le nom d'hypersensibilité multiorganique ont été signalés chez des patients prenant du valproate. La robe peut être fatale ou mortelle. La robe généralement, mais pas exclusivement, mais pas exclusivement de fièvre avec une lymphadénopathie à éruption cutanée et un gonflement facial en association avec d'autres anomalies du système d'organe telles que l'hépatite néphrite anomalies hématologiques, la myocardite ou la myosite ressemblant parfois à une infection virale aiguë. L'éosinophilie est souvent présente. Parce que ce trouble est variable dans son expression, d'autres systèmes d'organes non notés ici peuvent être impliqués. Il est important de noter que les premières manifestations d'hypersensibilité telles que la fièvre ou la lymphadénopathie peuvent être présentes même si l'éruption cutanée n'est pas évidente. Si ces signes ou symptômes sont présents, le patient doit être évalué immédiatement. Le valproate doit être interrompu et ne pas reprendre si une étiologie alternative pour les signes ou symptômes ne peut pas être établie.
Interaction avec les antibiotiques carbapènem
Les antibiotiques de carbapénème (par exemple Ertapenem imipenem méropénème; il ne s'agit pas d'une liste complète) peut réduire les concentrations de valproate sérique aux niveaux sous-thérapeutiques entraînant une perte de contrôle des crises. Les concentrations sériques de valproate doivent être surveillées fréquemment après avoir initié un traitement au carbapéném. Un traitement antibactérien ou anticonvulsivant alternatif doit être pris en compte si les concentrations de valproate sérique baissent de manière significative ou si le contrôle des crises se détériore [voir Interactions médicamenteuses ].
Somnolence In The Âgé
Dans un essai multicentrique en double aveugle de valproate chez les patients âgés atteints de démence (âge moyen = 83 ans), a été augmenté de 125 mg / jour à une dose cible de 20 mg / kg / jour. Une proportion significativement plus élevée de patients valproate avait une somnolence par rapport au placebo et, bien que non statistiquement significatif, il y avait une proportion plus élevée de patients atteints de déshydratation. Les arrêts pour la somnolence étaient également significativement plus élevés qu'avec le placebo. Chez certains patients atteints de somnolence (environ la moitié), il y avait une réduction de l'apport nutritionnel et une perte de poids. Il y avait une tendance pour les patients qui ont connu ces événements pour avoir une concentration d'albumine de base inférieure à un dégagement de valproate inférieur et un BUN plus élevé. Chez les patients âgés, le dosage doit être augmenté plus lentement et avec une surveillance régulière de la somnolence des liquides et de la consommation nutritionnelle et d'autres réactions indésirables. Les réductions de dose ou l'arrêt du valproate doivent être prises en compte chez les patients présentant une diminution de l'alimentation ou de l'apport fluide et chez des patients présentant une somnolence excessive [voir Posologie et administration ].
Surveillance: concentration plasmatique de médicament
Étant donné que le valproate peut interagir avec des médicaments administrés simultanément qui sont capables d'induction enzyme des déterminations périodiques de concentration plasmatique de valproate et de médicaments concomitants sont recommandés au cours du traitement précoce [voir Interactions médicamenteuses ].
Effet sur les tests de la fonction cétone et thyroïdienne
Le valproate est partiellement éliminé dans l'urine en tant que céto-métabolite qui peut conduire à une fausse interprétation du test de cétone urinaire.
Il y a eu des rapports de tests de fonction thyroïdiens modifiés associés au valproate. La signification clinique de celles-ci est inconnue.
Effet sur la réplication des virus du VIH et du CMV
Il existe des études in vitro qui suggèrent que le valproate stimule la réplication des virus VIH et CMV dans certaines conditions expérimentales. La conséquence clinique, le cas échéant, n'est pas connue. De plus, la pertinence de ces résultats in vitro est incertain pour les patients recevant un traitement antirétroviral maximal suppressif. Néanmoins, ces données doivent être gardées à l'esprit lors de l'interprétation des résultats de la surveillance régulière de la charge virale chez les patients infectés par le VIH recevant du valproate ou lorsqu'ils suivent cliniquement les patients infectés par le CMV.
Résidu de médicaments dans le tabouret
Il y a eu de rares rapports de résidus de médicaments dans les selles. Certains patients ont eu des troubles gastro-intestinaux anatomiques (y compris l'iléostomie ou la colostomie) ou les troubles gastro-intestinaux fonctionnels avec des temps de transit GI raccourcis. Dans certains rapports, des résidus de médicaments se sont produits dans le contexte de la diarrhée. Il est recommandé que les taux de valproate plasmatiques soient vérifiés chez les patients qui connaissent des résidus de médicaments dans les selles et l'état clinique des patients doit être surveillé. Si un traitement alternatif cliniquement indiqué peut être pris en compte.
Informations de conseil des patients
Conseiller au patient de lire l'étiquetage des patients approuvé par la FDA ( Guide des médicaments ).
Hépatotoxicité
Avertissez les patients et les tuteurs que les nausées vomissements douleurs abdominales anorexie diarrhée asthénie et / ou jaunisse peuvent être des symptômes d'hépatotoxicité et nécessitent donc une évaluation médicale supplémentaire rapidement [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Pancréatite
Avertissez les patients et les tuteurs que la douleur abdominale, les nausées, les vomissements et / ou l'anorexie peuvent être des symptômes de pancréatite et nécessitent donc une évaluation médicale supplémentaire rapidement [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Maladies congénitales et diminution du QI
Informer les femmes enceintes et les femmes de potentiel de procréation (y compris les filles qui commencent le début de la puberté) selon laquelle l'utilisation de valproate pendant la grossesse augmente le risque de malformations congénitales du QI et des troubles neurodéveloppementaux chez les enfants exposés in utero. Conseiller aux femmes d'utiliser une contraception efficace lors de la prise de valproate. Le cas échéant, conseiller ces patients sur des options thérapeutiques alternatives. Ceci est particulièrement important lorsque l'utilisation du valproate est considérée pour une condition non généralement associée à des blessures permanentes ou à la mort comme la prophylaxie de la migraine [voir Contre-indications ]. Advise patients to read the Guide des médicaments which appears as the last section of the labeling [see AVERTISSEMENTS AND PRÉCAUTIONS et Utiliser dans des populations spécifiques ].
Registre de grossesse
Conseiller les femmes en potentiel de procréation pour discuter de la planification de la grossesse avec leur médecin et de contacter immédiatement leur médecin si elles pensent qu'elles sont enceintes.
Encouragez les femmes qui prennent Depakote ER à s'inscrire au registre de grossesse nord-américain antiépileptique (NAAED) si elles tombent enceintes. Ce registre collecte des informations sur la sécurité des médicaments antiépileptiques pendant la grossesse. Pour inscrire les patients, les patients peuvent appeler le numéro gratuit 1-888-233-2334 ou visiter le site Web https://www.aedpregnancyregistry.org/ [voir Utiliser dans des populations spécifiques ].
Pensée et comportement suicidaires
Conseiller les patients leurs soignants et leurs familles qui, dont le dépassement ER, peuvent augmenter le risque de pensées et de comportements suicidaires et être alerte pour l'émergence ou l'aggravation des symptômes de la dépression de changements inhabituels d'humeur ou de comportement ou d'émergence des pensées suicidaires comportements ou pensées sur l'automutilation. Demandez aux patients des soignants et des familles de signaler immédiatement les comportements préoccupants aux prestataires de soins de santé [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Hyperammonémie
Informer les patients des signes et symptômes associés à l'encéphalopathie hyperammonémique et à informer le prescripteur si l'un de ces symptômes se produit [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Dépression du SNC
Étant donné que les produits de valproate peuvent produire une dépression du SNC, en particulier lorsqu'ils sont combinés avec un autre dépresseur du SNC (par exemple, l'alcool) conseille aux patients de ne pas s'engager dans des activités dangereuses telles que la conduite d'une automobile ou l'exploitation de machines dangereuses jusqu'à ce qu'elles soient connues qu'elles ne deviennent pas somnolente du médicament.
Réactions d'hypersensibilité multiorganiques
Instruisez les patients qu'une fièvre associée à d'autres atteintes du système d'organe (lymphadénopathie à éruption cutanée, etc.) peut être liée au médicament et doit être signalée immédiatement au médecin [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Résidu de médicaments dans le tabouret
Demandez aux patients de notifier leur fournisseur de soins de santé s'ils remarquent un résidu de médicaments dans les selles [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Toxicologie non clinique
Mutagenèse de la carcinogenèse et altération de la fertilité
Cancérogenèse
Le valproate a été administré par voie orale aux rats et aux souris à des doses de 80 et 170 mg / kg / jour (moins que la dose humaine maximale recommandée sur une base de mg / m²) pendant deux ans. Les principaux résultats ont été une augmentation de l'incidence des fibrosarcomes sous-cutanés chez des rats mâles à forte dose recevant du valproate et une tendance liée à la dose pour les adénomes pulmonaires bénins chez des souris mâles recevant du valproate.
Mutagenèse
Le valproate n'était pas mutagène dans un test bactérien in vitro (test Ames) n'a pas produit d'effets létaux dominants chez la souris et n'a pas augmenté la fréquence d'aberration des chromosomes dans une étude cytogénétique in vivo chez le rat. Des fréquences accrues d'échange chromatide sœur (SCE) ont été rapportées dans une étude sur des enfants épileptiques prenant du valproate; Cette association n'a pas été observée dans une autre étude menée chez les adultes.
Altération de la fertilité
Dans les études de toxicité chronique chez les rats juvéniles et adultes et les chiens, l'administration de valproate a entraîné une atrophie testiculaire et une spermatogenèse réduite à des doses orales de 400 mg / kg / jour ou plus chez les rats (environ égal à ou supérieur à la dose humaine maximale recommandée (MRHD) MRHD sur une base de mg / m²). Des études de fertilité chez le rat n'ont montré aucun effet sur la fertilité à des doses orales de valproate jusqu'à 350 mg / kg / jour (approximativement égal au MRHD sur une base de mg / m²) pendant 60 jours.
Utiliser dans des populations spécifiques
Grossesse
Grossesse Exposure Registry
Il existe un registre d'exposition à la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à des médicaments antiépileptiques (AED), notamment Depakote ER pendant la grossesse. Encouragez les femmes qui prennent Depakote ER pendant la grossesse à s'inscrire au registre de grossesse antiépileptique nord-américain (NAAED) en appelant le 1-888-233334 ou en visitant le site Web https://www.aedpregnancyregistry.org/. Cela doit être fait par la patiente elle-même.
Résumé des risques
Pour une utilisation dans la prophylaxie des maux de tête de migraine, le valproate est contre-indiqué chez les femmes enceintes et chez les femmes à potentiel de procréation qui n'utilisent pas de contraception efficace [voir Contre-indications ].
Pour une utilisation dans l'épilepsie ou trouble bipolaire Le valproate ne doit pas être utilisé pour traiter les femmes enceintes ou qui prévoient de devenir encein Avertissement en boîte et AVERTISSEMENTS AND PRÉCAUTIONS ]. Women with epilepsy who become pregnant while taking valproate should not discontinue valproate abruptly as this can precipitate status epilepticus with resulting maternal et fetal hypoxia et threat to life.
L'utilisation de valproate maternelle pendant la grossesse pour toute indication augmente le risque de malformations congénitales, en particulier les défauts du tube neuronal, notamment le spina bifida, mais également les malformations impliquant d'autres systèmes corporels (par exemple, défauts craniofaciaux, y compris malformations cardiovasculaires de fentes orales. Ce risque dépend de la dose; Cependant, une dose de seuil inférieure à laquelle il n'existe aucun risque. Une exposition in utero au valproate peut également entraîner une déficience auditive ou une perte auditive. La polythérapie de valproate avec d'autres DAE a été associée à une fréquence accrue de malformations congénitales par rapport à la monothérapie AED. Le risque d'anomalies structurelles majeures est la plus importante au cours du premier trimestre; Cependant, d'autres effets de développement graves peuvent survenir avec une utilisation de valproate tout au long de la grossesse. Le taux de malformations congénitales chez les bébés nés de mères épileptiques qui ont utilisé du valproate pendant la grossesse s'est avérée être environ quatre fois plus élevée que le taux chez les bébés nés de mères épileptiques qui ont utilisé d'autres monothérapies anti-seizure [voir [voir AVERTISSEMENTS AND PRÉCAUTIONS et Données (humain) ].
Des études épidémiologiques ont indiqué que les enfants exposés au valproate in utero ont des scores de QI plus faibles et un risque plus élevé de troubles neurodéveloppementaux par rapport aux enfants exposés à un autre AED in utero ou à pas de DEA in utero [voir AVERTISSEMENTS AND PRÉCAUTIONS et Données (humain) ].
Une étude d'observation a suggéré que l'exposition aux produits de valproate pendant la grossesse augmente le risque de troubles du spectre de l'autisme [voir Données (humain) ].
Dans les études animales, l'administration de valproate pendant la grossesse a entraîné des malformations structurelles fœtales similaires à celles observées chez l'homme et les déficits neuro -haviores chez la progéniture à des doses cliniquement pertinentes [voir Données (animal) ].
Il y a eu des rapports d'hypoglycémie chez les nouveau-nés et des cas mortels d'insuffisance hépatique chez les nourrissons après l'utilisation maternelle de valproate pendant la grossesse.
Les femmes enceintes prenant du valproate peuvent développer une insuffisance hépatique ou une coagulation des anomalies, notamment la thrombocytopénie hypofibrinogénémie et / ou une diminution des autres facteurs de coagulation qui peuvent entraîner des complications hémorragiques dans le nouveau-né, y compris la mort [voir [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Les tests de diagnostic prénatal disponibles pour détecter le tube neural et d'autres défauts doivent être offerts aux femmes enceintes à l'aide de valproate.
Les preuves suggèrent que la supplémentation en acide folique avant la conception et au cours du premier trimestre de la grossesse diminue le risque de malformations neurales congénitales dans la population générale. On ne sait pas si le risque de défauts du tube neural ou une diminution du QI chez la progéniture des femmes recevant du valproate est réduite par la supplémentation en acide folique. La supplémentation en acide folique alimentaire avant la conception et pendant la grossesse doit être systématiquement recommandée pour les patients utilisant du valproate [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Toutes les grossesses présentent un risque de fond de perte de maltraitance natale ou d'autres résultats indésirables. Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est respectivement de 2 à 4% et 15 à 20%.
Considérations cliniques
Risque maternel et / ou embryonnaire associé à la maladie
Pour prévenir les crises majeures, les femmes atteintes d'épilepsie ne doivent pas interrompre le valproate brusquement car cela peut précipiter le statut épileptique avec l'hypoxie maternelle et fœtale qui en résulte et menace la vie. Même les crises mineures peuvent poser un danger pour l'embryon ou le fœtus en développement [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. However discontinuation of the drug may be considered prior to et during pregnancy in individual cases if the seizure disorder severity et frequency do not pose a serious threat to the patient.
Effets indésirables maternels
Les femmes enceintes prenant du valproate peuvent développer des anomalies de coagulation, notamment la thrombocytopénie hypofibrinogénémie et / ou la diminution des autres facteurs de coagulation qui peuvent entraîner des complications hémorragiques chez le nouveau-né, y compris la mort [voir la mort [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. If valproate is used in pregnancy the clotting parameters should be monitored carefully in the mother. If abnormal in the mother then these parameters should also be monitored in the neonate.
Les patients prenant du valproate peuvent développer une défaillance hépatique [voir Avertissement en boîte et AVERTISSEMENTS AND PRÉCAUTIONS ]. Fatal cases of hepatic failure in infants exposed to valproate in utero have also been reported following maternal use of valproate during pregnancy.
Une hypoglycémie a été signalée chez les nouveau-nés dont les mères ont pris du valproate pendant la grossesse.
Données
Humain
Défauts du tube neural et autres anomalies structurelles
Il existe un vaste ensemble de preuves démontrant que l'exposition au valproate in utero augmente le risque de défauts du tube neural et d'autres anomalies structurelles. Sur la base des données publiées du réseau national de prévention des anomalies congénitales du CDC, le risque de spina bifida dans la population générale est d'environ 0,06 à 0,07% (6 à 7 sur 10000 naissances) par rapport au risque suivant dans l'exposition au valproate utero estimé à environ 1 à 2% (100 à 200 à 10000 naissances).
Le registre de grossesse NAAED a signalé un taux de malformation majeur de 9 à 11% chez la progéniture des femmes exposées à une moyenne de 1000 mg / jour de monothérapie valproate pendant la grossesse. Ces données montrent un risque accru de cinq fois plus élevé pour toute malformation majeure après une exposition au valproate in utero par rapport au risque après l'exposition in utero à d'autres DEA prises en monothérapie. Les principales malformations congénitales comprenaient des cas de défauts de tubes neuronaux malformations cardiovasculaires défauts de craniofacial (par exemple les fentes orales craniosynostose) Hypospadias les malformations des membres (par exemple en polydactylyfoot) et d'autres maladies malformations de gravité variable impliquant d'autres systèmes corporels [voir le club AVERTISSEMENTS AND PRÉCAUTIONS ].
Effet sur le QI et les effets neurodéveloppementaux
Des études épidémiologiques publiées ont indiqué que les enfants exposés au valproate in utero ont des scores de QI plus faibles que les enfants exposés à un autre AED in utero ou à aucune DEA in utero. Le plus grand de ces études1 est une étude de cohorte prospective menée aux États-Unis et au Royaume-Uni qui a constaté que les enfants présentant une exposition prénatale au valproate (n = 62) avaient des scores de QI plus faibles à 6 ans (97 [95% C.I. 94-101]) que les enfants atteints d'exposition prénatale à l'autre anti-épileptique Traitements de la monothérapie: la lamitrigine (108%. La carbamazépine (105 [95% c.i.102 € 108]) et la phénytoïne (108 [95% c.i.104 € 112]). On ne sait pas quand pendant les effets cognitifs de la grossesse chez les enfants exposés au valproate se produisent. Parce que les femmes de cette étude ont été exposées aux DEA tout au long de la grossesse, si le risque de QI diminué était lié à une période de temps particulière pendant la grossesse n'a pas pu être évaluée [voir AVERTISSEMENTS AND PRÉCAUTIONS ].
Bien que les études disponibles aient des limites méthodologiques, le poids des preuves soutient une association causale entre l'exposition au valproate in utero et les effets indésirables ultérieurs sur le neurodéveloppement, y compris l'augmentation des troubles du spectre autistique et le trouble du déficit d'attention / hyperactivité (TDAH). Une étude observationnelle a suggéré que l'exposition aux produits de valproate pendant la grossesse augmente le risque de troubles du spectre de l'autisme. Dans cette étude, les enfants nés de mères qui avaient utilisé des produits de valproate pendant la grossesse avaient 2,9 fois le risque (intervalle de confiance à 95% [IC]: 1,7-4,9) du développement des troubles du spectre autistique par rapport aux enfants nés de mères non exposées aux produits de validage pendant la grossesse. Les risques absolus pour les troubles du spectre de l'autisme étaient de 4,4% (IC à 95%: 2,6% -7,5%) chez les enfants valproate - et 1,5% (IC à 95%: 1,5% -1,6%) chez les enfants non exposés à des produits valproate. Une autre étude d'observation a révélé que les enfants exposés au valproate in utero présentaient un risque accru de TDAH (HR ajusté 1,48; IC à 95% 1,09-2,00) par rapport aux enfants non exposés. Parce que ces études étaient de nature observationnelle de nature concernant une association causale entre l'exposition in utero valproate et un risque accru de trouble du spectre autistique et du TDAH ne peut pas être considéré comme définitif.
Autre
Il y a des rapports de cas publiés sur une insuffisance hépatique mortelle chez la progéniture des femmes qui ont utilisé du valproate pendant la grossesse.
Animal
Dans les études de toxicité de développement menées chez des rats de souris, les lapins et les singes ont augmenté les taux d'anomalies structurelles fœtales. Le valproate a induit des malformations de plusieurs systèmes d'organes, y compris les défauts cardiaques et urogénitaux squelettiques. Chez les souris, en plus d'autres malformations, des défauts de tube neural fœtal ont été signalés après l'administration de valproate pendant les périodes critiques d'organogenèse et la réponse tératogène était corrélée avec les niveaux maternels maternels. Les anomalies comportementales (y compris les déficits cognitives locomotrices et d'interaction sociale) et des changements histopathologiques cérébraux ont également été rapportés chez la souris et la progéniture de rat exposées prénatalement à des doses cliniquement pertinentes de valproate.
Lactation
Résumé des risques
Le valproate est excrété dans le lait maternel. Les données dans la littérature publiée décrivent la présence de valproate dans le lait maternel (plage: 0,4 mcg / ml à 3,9 mcg / ml) correspondant à 1% à 10% des taux sériques maternels. Les concentrations sériques de valproate recueillies chez les nourrissons allaités âgés de 3 jours postnatals à 12 semaines suivant l'accouchement variaient de 0,7 mcg / ml à 4 mcg / ml, ce qui était de 1% à 6% des taux de valproate sérique maternel. Une étude publiée chez les enfants jusqu'à six ans n'a pas signalé d'effets défavorables au développement ou cognitif après une exposition au valproate via le lait maternel [voir Données (humain) ].
Il n'y a pas de données pour évaluer les effets de Depakote sur la production de lait ou l'excrétion.
Considérations cliniques
Les avantages du développement et de la santé de l'allaitement doivent être pris en compte avec le besoin clinique de la mère de Depakote et tout effet négatif potentiel sur le nourrisson allaité de Depakote ou de l'état maternel sous-jacent.
Surveillez le nourrisson allaité pour les signes de lésions hépatiques, y compris la jaunisse et les ecchymoses ou les saignements inhabituels. Il y a eu des rapports d'insuffisance hépatique et de coagulation des anomalies chez la progéniture des femmes qui ont utilisé du valproate pendant la grossesse [voir Utiliser dans des populations spécifiques ].
Données
Humain
Dans une étude publiée, le lait maternel et les échantillons de sang maternel ont été obtenus à partir de 11 patients épileptiques prenant du valproate à des doses allant de 300 mg / jour à 2400 mg / jour les jours postnatals 3 à 6. Chez 4 patients qui prenaient du valproate unique Concentration plasmatique maternelle (plage: 2,7% à 7,4%). Tous les patients (dont 7 prenaient d'autres AED concomitamment) des résultats similaires ont été obtenus pour la concentration de lait maternel (1,8 mcg / ml de plage: 0,4 mcg / ml à 3,9 mcg / ml) et le rapport plasma maternel (plage de 5,1%: 1,3% à 9,6%).
Une étude publiée sur 6 paires de mère-enfant de l'allaitement a mesuré les taux de valproate sérique pendant le traitement maternel du trouble bipolaire (750 mg / jour ou 1000 mg / jour). Aucune des mères n'a reçu de valproate pendant la grossesse et les nourrissons étaient âgés de 4 semaines à 19 semaines au moment de l'évaluation. Les taux sériques du nourrisson variaient de 0,7 mcg / ml à 1,5 mcg / ml. Les taux de valproate sérique maternels proches ou à l'intérieur de la gamme thérapeutique, l'exposition aux nourrissons était de 0,9% à 2,3% des niveaux maternels. De même dans 2 rapports de cas publiés avec des doses maternelles de 500 mg / jour ou 750 mg / jour pendant l'allaitement maternel des nourrissons âgés de 3 mois et 1 mois, l'exposition aux nourrissons était respectivement de 1,5% et 6% de la mère respectivement.
Une étude multicentrique d'observation prospective a évalué les effets neurodéveloppementaux à long terme de l'utilisation des DEA sur les enfants. Les femmes enceintes recevant de la monothérapie pour l'épilepsie ont été inscrites à des évaluations de leurs enfants à 3 ans et 6 ans. Les mères ont poursuivi la thérapie AED pendant la période d'allaitement. Les QI ajustés mesurés à 3 ans pour les enfants allaités et non battus étaient respectivement de 93 (n = 11) et 90 (n = 24). À 6 ans, les scores pour les enfants allaités et non pondérés étaient respectivement de 106 (n = 11) et 94 (n = 25) (p = 0,04). Pour d'autres domaines cognitifs évalués à 6 ans, aucun effet cognitif indésirable de l'exposition continue à un AED (y compris le valproate) via du lait maternel n'a été observé.
Femmes et mâles de potentiel reproducteur
Contraception
Les femmes de potentiel de procréation devraient utiliser une contraception efficace tout en prenant le valproate [voir Avertissement en boîte AVERTISSEMENTS AND PRÉCAUTIONS Interactions médicamenteuses et Utiliser dans des populations spécifiques ]. This is especially important when valproate use is considered for a condition not usually associated with permanent injury or death such as prophylaxis of migraine mal de têtes [see Contre-indications ].
Infertilité
Il y a eu des rapports d'infertilité masculine coïncidant avec la thérapie de valproate [voir Effets indésirables ].
Dans les études animales, l'administration orale de valproate à des doses cliniquement pertinentes a entraîné des effets reproductifs négatifs chez les hommes [voir Toxicologie non clinique ].
Usage pédiatrique
L'expérience a indiqué que les patients pédiatriques de moins de deux ans sont à un risque considérablement accru de développer une hépatotoxicité mortelle, en particulier celles qui ont des conditions susmentionnées [voir Avertissement en boîte et AVERTISSEMENTS AND PRÉCAUTIONS ]. When Depakote ER is used in this patient group it should be used with extreme caution et as a sole agent. The benefits of therapy should be weighed against the risks. Above the age of 2 years experience in epilepsy has indicated that the incidence of fatal hepatotoxicity decreases considerably in progressively older patient groups.
Les enfants plus jeunes en particulier ceux qui reçoivent des médicaments induisant des enzymes nécessiteront des doses d'entretien plus importantes pour atteindre des concentrations de valproate totale et non liées ciblées. Les patients pédiatriques (c'est-à-dire entre 3 mois et 10 ans) ont 50% de dégagements plus élevés exprimés en poids (c'est-à-dire ml / min / kg) que les adultes. Plus de 10 ans, les enfants ont des paramètres pharmacocinétiques qui se rapprochent de ceux des adultes.
La variabilité de la fraction libre limite l'utilité clinique de la surveillance des concentrations totales d'acide valproïque sérique. L'interprétation des concentrations d'acide valproïque chez les enfants devrait inclure la considération de facteurs qui affectent le métabolisme hépatique et la liaison des protéines.
Essais cliniques pédiatriques
Depakote was studied in seven pediatric clinical trials.
Deux des études pédiatriques ont été des essais contrôlés par placebo en double aveugle pour évaluer l'efficacité de Depakote ER pour les indications de Mania (150 patients âgés de 10 à 17 ans, dont 76 sur Depakote ER) et de la migraine (304 patients âgés de 12 à 17 ans 231 sur ceux qui étaient sous Depakote ER). L'efficacité n'a été établie ni pour le traitement de la migraine ou le traitement de la manie. Les effets indésirables liés au médicament les plus courants (rapportés> 5% et deux fois le taux de placebo) signalés dans l'étude contrôlée de la manie pédiatrique étaient la somnolence de douleur abdominale supérieure nausée, la somnolence accrue de l'ammoniac et des éruptions cutanées.
Les cinq essais restants étaient des études de sécurité à long terme. Deux études pédiatriques de six mois ont été menées pour évaluer la sécurité à long terme de Depakote ER pour l'indication de la manie (292 patients âgés de 10 à 17 ans). Deux études pédiatriques de douze mois ont été menées pour évaluer la sécurité à long terme de Depakote ER pour l'indication de la migraine (353 patients âgés de 12 à 17 ans). Une étude de douze mois a été menée pour évaluer la sécurité des capsules de pincement Depakote dans l'indication des crises partielles (169 patients âgés de 3 à 10 ans).
Dans ces sept essais cliniques, la sécurité et la tolérabilité de Depakote chez les patients pédiatriques se sont révélées comparables à celles de l'adulte [voir Effets indésirables ].
Toxicologie des animaux juvéniles
Dans les études du valproate chez les animaux immatures, les effets toxiques non observés chez les animaux adultes comprenaient une dysplasie rétinienne chez le rat traité pendant la période néonatale (à partir du jour postnatal 4) et la néphrotoxicité chez les rats traités pendant les périodes néonatales et juvéniles (à partir du jour postnatal 14). La dose sans effet pour ces résultats était inférieure à la dose humaine maximale recommandée sur une base de mg / m².
Utilisation gériatrique
Aucun patient de plus de 65 ans n'a été inscrit à des essais cliniques prospectifs en double aveugle de manie associés à une maladie bipolaire. Dans une revue de cas, une étude de 583 patients, 72 patients (12%) avaient plus de 65 ans. Un pourcentage plus élevé de patients de plus de 65 ans a signalé une somnolence et des tremblements de douleur à l'infection accidentelle. L'arrêt du valproate était parfois associé aux deux derniers événements. Il n'est pas clair si ces événements indiquent un risque supplémentaire ou s'ils résultent d'une maladie médicale préexistante et d'une utilisation des médicaments concomitants chez ces patients.
Une étude sur des patients âgés atteints de démence a révélé une somnolence liée au médicament et l'arrêt pour la somnolence [voir AVERTISSEMENTS AND PRÉCAUTIONS ]. The starting dose should be reduced in these patients et dosage reductions or discontinuation should be considered in patients with excessive somnolence [see Posologie et administration ].
Les informations sont insuffisantes pour discerner la sécurité et l'efficacité du valproate pour la prophylaxie des migraines chez les patients de plus de 65 ans.
La capacité des patients âgés (tranche d'âge: 68 à 89 ans) à éliminer le valproate s'est avérée réduite par rapport aux jeunes adultes (tranche d'âge: 22 à 26 ans) [voir Pharmacologie clinique ].
Effet de la maladie
Maladie du foie
La maladie du foie altère la capacité d'éliminer le valproate [voir Avertissement en boîte Contre-indications AVERTISSEMENTS AND PRÉCAUTIONS et Pharmacologie clinique ].
Les informations sur la surdose pour Depakote sont
Le surdosage avec le valproate peut entraîner un bloc cardiaque de somnolence coma profond et hypernatrémie. Des décès ont été signalés; Cependant, les patients se sont remis des niveaux de valproate élevés que 2120 mcg / ml.
Dans les situations de surdose, la fraction du médicament non lié aux protéines est élevée et l'hémodialyse ou l'hémodialyse en tandem plus l'héperfusion peut entraîner une élimination significative du médicament. Le bénéfice du lavage ou des vomissements gastriques variera selon le temps depuis l'ingestion. Des mesures générales de soutien doivent être appliquées avec une attention particulière à la maintenance d'un débit urinaire adéquat.
Il a été rapporté que la naloxone inverse les effets dépresseurs du SNC du surdosage de valproate. Parce que la naloxone pourrait théoriquement inverser également les effets antiépileptiques du valproate, il doit être utilisé avec prudence chez les patients atteints d'épilepsie.
Les contre-indications pour Depakote sont
- Depakote ER should not be administered to patients with hepatic disease or significant hepatic dysfunction [see AVERTISSEMENTS AND PRÉCAUTIONS ].
- Depakote ER is contraindicated in patients known to have mitochondrial disorders caused by mutations in mitochondrial DNA polymerase γ (POLG; e.g. Alpers-Huttenlocher Syndrome) et children under two years of age who are suspected of having a POLG-related disorder [see AVERTISSEMENTS AND PRÉCAUTIONS ].
- Depakote ER is contraindicated in patients with known hypersensitivity to the drug [see AVERTISSEMENTS AND PRÉCAUTIONS ].
- Depakote ER is contraindicated in patients with known urea cycle disorders [see AVERTISSEMENTS AND PRÉCAUTIONS ].
- Pour une utilisation dans la prophylaxie des maux de tête de migraine: Depakote ER est contre-indiqué chez les femmes enceintes et chez les femmes à potentiel de procréation qui n'utilisent pas de contraception efficace [voir AVERTISSEMENTS AND PRÉCAUTIONS et Utiliser dans des populations spécifiques ].
Pharmacologie clinique for Depakote ER
Mécanisme d'action
Le divalproex sodium se dissocie à l'ion valproate dans le tractus gastro-intestinal. Les mécanismes par lesquels le valproate exerce ses effets thérapeutiques n'a pas été établi. Il a été suggéré que son activité dans l'épilepsie est liée à une augmentation des concentrations cérébrales d'acide gamma-aminobutyrique (GABA).
Pharmacodynamique
La relation entre la concentration plasmatique et la réponse clinique n'est pas bien documentée. Un facteur contribuant est la liaison des protéines dépendant de la concentration non linéaire du valproate qui affecte la clairance du médicament. Ainsi, la surveillance du valproate sérique total peut ne pas fournir un indice fiable des espèces de valproate bioactive.
Par exemple, parce que la liaison à la protéine plasmatique du valproate dépend de la concentration, la fraction libre augmente d'environ 10% à 40 mcg / ml à 18,5% à 130 mcg / ml. Des fractions libres plus élevées que prévu se produisent chez les personnes âgées chez les patients hyperlipidémiques et chez les patients atteints de maladies hépatiques et rénales.
Épilepsie
La plage thérapeutique de l'épilepsie est généralement considérée comme étant de 50 à 100 mcg / ml de valproate total, bien que certains patients puissent être contrôlés avec des concentrations plasmatiques plus faibles ou plus élevées.
Manie
Dans les essais cliniques contrôlés par placebo sur des patients atteints de manie aiguë, ont été dosés à une réponse clinique avec des concentrations plasmatiques de creux entre 85 et 125 mcg / ml [voir Posologie et administration ].
Pharmacocinétique
Absorption / biodisponibilité
La biodisponibilité absolue des comprimés Depakote ER administrée en une seule dose après un repas était d'environ 90% par rapport à la perfusion intraveineuse.
Lorsqu'il est donné à des doses quotidiennes totales égales, la biodisponibilité de Depakote ER est inférieure à celle de Depakote (divalproex sodium comprimés à libération retardée). Dans cinq études à dose multiples chez des sujets sains (n = 82) et chez des sujets atteints d'épilepsie (n = 86) lorsqu'ils sont administrés dans des conditions de jeûne et de non-jet, de dépakote ER donnée par jour produisait quotidiennement une biodisponibilité moyenne de 89% par rapport à une dose quotidienne totale égale de dépakote étant donné Tid ou QID. Le temps médian vers des concentrations de valproate plasmatique maximale (CMAX) après l'administration de DePakote ER variait de 4 à 17 heures. Après plusieurs dosages une fois par jour de Depakote ER, la fluctuation de pic à poitrine dans les concentrations de valproate plasmatique était de 10 à 20% inférieure à celle de Depakote ordinaire étant donné Tid ou QID.
La conversion de Depakote en Depakote est
Lorsque Depakote ER est donné à des doses de 8 à 20% de plus que la dose quotidienne totale de Depakote, les deux formulations sont bioéquivalentes. Dans deux études croisées randomisées, plusieurs doses quotidiennes de Depakote ont été comparées à 8 à 20% de doses une fois plus élevées de Depakote ER. Dans ces deux études, les régimes de dépakote ER et Depakote étaient équivalents par rapport à la superficie sous la courbe (AUC; une mesure de l'étendue de la biodisponibilité). De plus, le valproate CMAX était inférieur et le CMIN était soit plus élevé ou non différent pour Depakote ER par rapport aux schémas de dépakote (voir tableau 8).
Tableau 8. Biodisponibilité des comprimés Depakote ER par rapport à Depakote lorsque la dose de Depakote ER est de 8 à 20% plus élevée
| Population d'étude | Régimes | Biodisponibilité relative | ||
| Depakote ER vs. Depakote | AUC24 | Cmax | Cmin | |
| Volontaires sains (n = 35) | 1000 | 1.059 | 0.882 | 1.173 |
| Les patients atteints d'épilepsie sur des médicaments antiépilepsy induisant des enzymes concomitants (n = 64) | 1000 à 5000 mg depakote ER contre 875 à 4250 mg depakote | 1.008 | 0.899 | 1.022 |
Les médicaments antiépilepsie concomitants (topiramate phénobarbital carbamazépine phénytoïne et lamotrigine ont été évalués) qui induisent le système d'isozymes du cytochrome P450 n'a pas modifié de manière significative la biodisponibilité du valproate lors de la conversion entre Depakote et Depakote ER.
Distribution
Liaison des protéines
La liaison à la protéine plasmatique du valproate dépend de la concentration et la fraction libre augmente d'environ 10% à 40 mcg / ml à 18,5% à 130 mcg / ml. La liaison aux protéines du valproate est réduite chez les personnes âgées chez les patients atteints de maladies hépatiques chroniques chez les patients souffrant de troubles rénaux et en présence d'autres médicaments (par exemple l'aspirine). À l'inverse, le valproate peut déplacer certains médicaments liés aux protéines (par exemple la phénytoïne carbamazépine warfarine et tolbutamide) [voir Interactions médicamenteuses Pour des informations plus détaillées sur les interactions pharmacocinétiques du valproate avec d'autres médicaments].
Distribution du SNC
Les concentrations de valproate dans le liquide céphalo-rachidien (CSF) approximativement des concentrations non liées dans le plasma (environ 10% de la concentration totale).
Métabolisme
Valproate est métabolisé presque entièrement par le foie. Chez les patients adultes en monothérapie, 30 à 50% d'une dose administrée apparaît dans l'urine comme un conjugué de glucuronide. La β-oxydation mitochondriale est l'autre voie métabolique majeure représentant généralement plus de 40% de la dose. Habituellement, moins de 15 à 20% de la dose est éliminée par d'autres mécanismes oxydatifs. Moins de 3% d'une dose administrée est excrétée inchangée dans l'urine.
La relation entre la dose et la concentration totale de valproate est non linéaire; La concentration n'augmente pas proportionnellement la dose mais augmente plutôt dans une moindre mesure en raison de la liaison des protéines plasmatiques saturées. La cinétique du médicament non liné est linéaire.
Élimination
Le dégagement du plasma moyen et le volume de distribution pour le valproate total sont de 0,56 L / h / 1,73 m² et 11 L / 1,73 m² respectivement. Le dégagement du plasma moyen et le volume de distribution pour le valproate libre sont de 4,6 L / h / 1,73 m² et 92 L / 1,73 m². La demi-vie terminale moyenne pour la monothérapie de valproate variait de 9 à 16 heures après les schémas posologiques oraux de 250 à 1000 mg.
Les estimations citées s'appliquent principalement aux patients qui ne prennent pas de médicaments qui affectent les systèmes enzymatiques de métabolisation hépatique. Par exemple, les patients prenant des médicaments antiépileptiques induisant des enzymes (carbamazépine phénytoïne et phénobarbital) élimineront le valproate plus rapidement. En raison de ces changements dans la surveillance de la clairance du valproate des concentrations antiépileptiques, il faut s'intensifier chaque fois que les antiépileptiques concomitants sont introduits ou retirés.
Populations spécifiques
Effet de l'âge
Pédiatrique
Le profil pharmacocinétique du valproate après l'administration de Depakote ER a été caractérisé dans une étude multicentrique à étiquette ouverte à dose multiple à dose chez les enfants et les adolescents. Depakote ER Une fois que les doses quotidiennes variaient de 250 à 1750 mg. Une fois que l'administration quotidienne de Depakote ER chez les patients pédiatriques (10-17 ans) a produit des profils de concentration en VPA plasmatiques similaires à ceux qui ont été observés chez l'adulte.
Âgé
Il a été démontré que la capacité des patients âgés (tranche d'âge: 68 à 89 ans) à éliminer le valproate est réduite par rapport aux jeunes adultes (tranche d'âge: 22 à 26 ans). La clairance intrinsèque est réduite de 39%; La fraction libre est augmentée de 44%. En conséquence, la dose initiale doit être réduite chez les personnes âgées [voir Posologie et administration ].
Effet du sexe
Il n'y a aucune différence dans la surface corporelle ajusté la clairance non liée entre les mâles et les femelles (4,8 ± 0,17 et 4,7 ± 0,07 L / h par 1,73 m² respectivement).
Effet de la race
Les effets de la race sur la cinétique du valproate n'ont pas été étudiés.
Effet de la maladie
Maladie du foie
La maladie du foie altère la capacité d'éliminer le valproate. Dans une étude, la clairance du valproate libre a été diminuée de 50% chez 7 patients atteints de cirrhose et de 16% chez 4 patients atteints d'hépatite aiguë par rapport à 6 sujets sains. Dans cette étude, la demi-vie du valproate est passée de 12 à 18 heures. La maladie hépatique est également associée à une diminution des concentrations d'albumine et à des fractions non liées plus grandes (2 à 2,6 fois augmentation) de valproate. En conséquence, la surveillance des concentrations totales peut être trompeuse, car les concentrations libres peuvent être considérablement élevées chez les patients atteints de maladie hépatique alors que les concentrations totales peuvent sembler normales [voir Avertissement en boîte Contre-indications et AVERTISSEMENTS AND PRÉCAUTIONS ].
Maladie rénale
Une légère réduction (27%) de la clairance non liée du valproate a été signalée chez les patients souffrant d'insuffisance rénale (clairance de la créatinine <10 mL/minute); however hemodialysis typically reduces valproate concentrations by about 20%. Therefore no dosage adjustment appears to be necessary in patients with renal failure. Protein binding in these patients is substantially reduced; thus monitoring total concentrations may be misleading.
Études d'interaction médicamenteuse sans interaction ou interaction cliniquement sans importance cliniquement
Antiacides
Une étude impliquant la co-administration de valproate 500 mg avec des antiacides couramment administrés (Maalox Trisogel et Titralac - 160 MEQ) n'a révélé aucun effet sur l'étendue de l'absorption du valproate.
Chlorpromazine
Une étude impliquant l'administration de 100 à 300 mg / jour de chlorpromazine aux patients schizophrènes recevant déjà du valproate (BID de 200 mg) a révélé une augmentation de 15% des taux plasmatiques de creux de valproate.
Halopéridol
Une étude impliquant l'administration de 6 à 10 mg / jour d'halopéridol à des patients schizophrènes recevant déjà du valproate (BID de 200 mg) n'a révélé aucun changement significatif dans les taux de plasma au creux de valproate.
Cimétidine et ranitidine
La cimétidine et la ranitidine n'affectent pas la clairance du valproate.
Acétaminophène
Le valproate n'a eu aucun effet sur aucun des paramètres pharmacocinétiques de l'acétaminophène lorsqu'il a été administré simultanément à trois patients épileptiques.
Clozapine
Chez les patients psychotiques (n = 11), aucune interaction n'a été observée lorsque le valproate a été co-administré avec la clozapine.
onglets d'isosorbide mononitrate 30 mg
Lithium
La co-administration de valproate (BID 500 mg) et de carbonate de lithium (300 mg TID) à des volontaires masculins normaux (n = 16) n'a eu aucun effet sur la cinétique à l'état d'équilibre du lithium.
Lorazépam
L'administration concomitante de valproate (BID de 500 mg) et de lorazépam (BID de 1 mg) chez les volontaires masculins normaux (n = 9) s'est accompagné d'une diminution de 17% de la clairance du plasma du lorazépam.
Olanzapine
Aucun ajustement de dose pour l'olanzapine n'est nécessaire lorsque l'olanzapine est administrée concomitante avec le valproate. La co-administration de valproate (BID de 500 mg) et d'olanzapine (5 mg) à des adultes en bonne santé (n = 10) a provoqué une réduction de 15% du CMAX et une réduction de 35% de l'ASC d'olanzapine.
Stéroïdes contraceptifs oraux
L'administration d'une seule dose d'éthinyloestradiol (50 mcg) / lévonorgestrel (250 mcg) à 6 femmes sur le traitement de valproate (200 mg) pendant 2 mois n'a révélé aucune interaction pharmacocinétique.
Études cliniques
Manie
L'efficacité de Depakote ER pour le traitement de la manie aiguë est basée en partie sur des études établissant l'efficacité de Depakote (Divalproex sodium retardé des comprimés de libération) pour cette indication. L'efficacité de DePakote ER a été confirmée dans une étude multicentrique parallèle du groupe parallèle à double tourbo contrôlé en double aveugle. L'étude a été conçue pour évaluer l'innocuité et l'efficacité de Depakote ER dans le traitement du trouble bipolaire I maniaque ou mixte chez les adultes. Les patients adultes et femmes qui avaient un diagnostic primaire DSM-IV TR actuel du trouble bipolaire I maniaque ou mixte et qui ont été hospitalisés pour une manie aiguë ont été inscrits à cette étude. Depakote ER a été initié à une dose de 25 mg / kg / jour donnée une fois que quotidiennement a augmenté de 500 mg / jour le jour 3, puis ajusté pour atteindre les concentrations de valproate plasmatique dans la plage de 85-125 mcg / ml. Les doses quotidiennes de dépassement quotidiennes pour les cas observées étaient de 2362 mg (plage: 500-4000) 2874 mg (plage: 1500-4500) 2993 mg (plage: 1500-4500) 3181 mg (plage: 1500-5000) et 3353 mg (plage: 1500-5500) à des jours 1 5 10 15 et 21 respectivement. Les concentrations moyennes de valproate étaient de 96,5 mcg / ml 102,1 mcg / ml 98,5 mcg / ml 89,5 mcg / ml aux jours 5 10 15 et 21 respectivement. Les patients ont été évalués sur l'échelle de notation de la manie (MRS; le score varie de 0 à 52).
Depakote ER was significantly more effective than placebo in reduction of the MRS total score.
Épilepsie
L'efficacité du valproate dans la réduction de l'incidence des crises partielles complexes (CPS) qui se produisent isolément ou en association avec d'autres types de crises ont été établies dans deux essais contrôlés.
Dans une étude multi-clinique contrôlée par placebo utilisant une conception complémentaire (thérapie complémentaire) 144 patients qui ont continué à souffrir de huit CP ou plus par 8 semaines pendant une période de 8 semaines de monothérapie avec des doses de carbamazépine ou de phénytoïne suffisantes pour assurer des concentrations de plasma dans la gamme thérapeutique ont été randomisées pour recevoir en plus de leur médicament antiépileple d'origine (AED) (AED). Les patients randomisés devaient être suivis pendant un total de 16 semaines. Le tableau suivant présente les résultats.
Tableau 9: Étude de thérapie complémentaire Incidence médiane du CPS par 8 semaines
| Traitement complémentaire | Nombre de patients | Incidence de base | Incidence expérimentale |
| Depakote | 75 | 16.0 | 8.9 * |
| Placebo | 69 | 14.5 | 11.5 |
| * La réduction de la ligne de base statistiquement significativement plus importante pour le valproate que le placebo au niveau P ≤ 0,05. |
La figure 1 présente la proportion de patients (axe x) dont la réduction en pourcentage par rapport aux taux de crise partielle complexe était au moins aussi grande que celle indiquée sur l'axe Y dans l'étude de thérapie complémentaire. Une réduction positive en pourcentage indique une amélioration (c'est-à-dire une diminution de la fréquence des crises) tandis qu'une réduction de pourcentage négative indique une aggravation. Ainsi, dans une affichage de ce type, la courbe pour un traitement efficace est décalée à gauche de la courbe pour le placebo. Ce chiffre montre que la proportion de patients atteignant un niveau d'amélioration particulier était systématiquement plus élevé pour le valproate que pour le placebo. Par exemple, 45% des patients traités par du valproate avaient une réduction ≥ 50% du taux de crise partiel complexe contre 23% des patients traités par placebo.
Figure 1
La deuxième étude a évalué la capacité du valproate à réduire l'incidence des CP lorsqu'il est administré comme seul AED. L'étude a comparé l'incidence du CPS chez les patients randomisés à un bras de traitement à dose élevé ou faible. Les patients se sont qualifiés pour l'entrée dans la phase de comparaison randomisée de cette étude uniquement si 1) ils ont continué à subir 2 CPS ou plus par 4 semaines pendant une période de monothérapie de 8 à 12 semaines avec des doses adéquates de AED (c'est-à-dire la phénytoïne carbamazépine phénobarbitale ou primidone) et 2), ils ont réussi une transition réussie sur un intervalle de deux semaines pour valproate. Les patients entrant dans la phase randomisée ont ensuite été amenés à leur dose cible attribuée progressivement effilés de leur AED concomitants et suivis pour un intervalle jusqu'à 22 semaines. Moins de 50% des patients randomisés ont cependant terminé l'étude. Chez les patients convertis en monothérapie Depakote, les concentrations moyennes de valproate totales pendant la monothérapie étaient respectivement de 71 et 123 mcg / ml dans les groupes à faible dose et à forte dose.
Le tableau suivant présente les résultats de tous les patients randomisés qui ont eu au moins une évaluation post-randomisation.
Tableau 10: Incidence médiane de l'étude en monothérapie du CPS par 8 semaines
| Traitement | Nombre de patients | Incidence de base | Incidence de phase randomisée |
| Valproate à forte dose | 131 | 13.2 | 10.7 * |
| Valproate à faible dose | 134 | 14.2 | 13.8 |
| * La réduction de la ligne de base statistiquement significativement plus élevée pour une dose élevée que la faible dose à p ≤ 0,05 niveau. |
La figure 2 présente la proportion de patients (axe x) dont la réduction en pourcentage par rapport aux taux de crise partielle complexe était au moins aussi grande que celle indiquée sur l'axe Y dans l'étude de monothérapie. Une réduction positive en pourcentage indique une amélioration (c'est-à-dire une diminution de la fréquence des crises) tandis qu'une réduction de pourcentage négative indique une aggravation. Ainsi, dans une affichage de ce type, la courbe pour un traitement plus efficace est déplacée à gauche de la courbe pour un traitement moins efficace. Ce chiffre montre que la proportion de patients atteignant un niveau de réduction particulier était systématiquement plus élevé pour le valproate à forte dose que pour le valproate à faible dose. Par exemple, le passage de la carbamazépine phénytoïne phénobarbitale ou de la monothérapie primidone à une monothérapie à haute dose à valproate 63% des patients n'ont connu aucun changement ou une réduction des taux de crise partielle complexes, contre 54% des patients recevant un faible valproate de dose.
Figure 2
Les informations sur les études pédiatriques sont présentées dans la section 8.
Migraine
Les résultats d'un essai clinique multicentrique randomisé en double aveugle contrôlé par placebo contrôlé ont démontré l'efficacité de Depakote ER dans le traitement prophylactique des maux de tête de la migraine. Cet essai a recruté des patients ayant des antécédents de migraines avec ou sans aura se produisant en moyenne deux fois ou plus par mois pendant les trois mois précédents. Les patients atteints de maux de tête quotidiens en grappe ou chronique ont été exclus. Les femmes de potentiel de procréation ont été autorisées dans le procès si elles étaient jugées pratiquant une méthode efficace de contraception.
Les patients qui ont connu ≥ 2 maux de tête de migraine au cours de la période de référence de 4 semaines ont été randomisés dans un rapport 1: 1 à Depakote ER ou Placebo et traités pendant 12 semaines. Les patients ont initié un traitement sur 500 mg une fois par jour pendant une semaine et ont ensuite été augmentés à 1000 mg une fois par jour avec une option pour réduire définitivement la dose à 500 mg une fois par jour au cours de la deuxième semaine de traitement si l'intolérance s'est produite. Quatre-vingt-dix-huit des 114 patients traités par DePakote (86%) et 100 des 110 patients traités par placebo (91%) traités au moins deux semaines ont maintenu la dose de 1000 mg une fois par jour pendant la durée de leurs périodes de traitement. Le résultat du traitement a été évalué sur la base de la réduction du taux de maux de tête de migraine de 4 semaines dans la période de traitement par rapport à la période de référence.
Les patients (50 hommes 187 femmes) âgés de 16 à 69 ans ont été traités avec Depakote ER (n = 122) ou un placebo (n = 115). Quatre patients avaient moins de 18 et 3 ans étaient supérieurs à 65 ans. Deux cent deux patients (101 dans chaque groupe de traitement) ont terminé la période de traitement. La réduction moyenne du taux de céphalées de migraine de 4 semaines était de 1,2 par rapport à une moyenne de base de 4,4 dans le groupe Depakote ER contre 0,6 à partir d'une moyenne de base de 4,2 dans le groupe placebo. La différence de traitement était statistiquement significative (voir figure 3).
Figure 3: Réduction moyenne des taux de maux de tête de migraine de 4 semaines
Références
1. Meador KJ Baker GA Browning N et al. Exposition aux médicaments antiépileptiques fœtaux et résultats cognitifs à l'âge de 6 ans (étude NEAD): une étude observationnelle prospective. Lancet Neurology 2013; 12 (3): 244-252.
Les informations sur les patients pour Depakote sont
Depakote est
(DEP-A-KOTE) (DivalProex Sodium) Comprimés à libération prolongée pour usage oral
Depakote
(DEP-A-KOTE) (DivalProex Sodium) Comprimés à libération retardée pour une utilisation orale
Depakote Sprinkle Capsules
(DEP-A-KOTE) (DivalProex Sodium retardée capsules de libération retardée) pour une utilisation orale
Quelles sont les informations les plus importantes que je devrais connaître sur DePakote?
N'arrêtez pas Depakote sans d'abord parler à un fournisseur de soins de santé. L'arrêt de Depakote peut soudainement causer de graves problèmes. Arrêter soudainement un médicament contre les crises chez un patient qui souffre d'épilepsie peut provoquer des convulsions qui ne s'arrêteront pas (statut epilepticus).
Depakote can cause serious side effects including:
1. Dommages hépatiques graves qui peuvent causer la mort, en particulier chez les enfants de moins de 2 ans et les patients atteints de troubles mitochondriaux. Le risque de subir ces lésions hépatiques graves est plus susceptible de se produire dans les 6 premiers mois de traitement.
Appelez votre fournisseur de soins de santé immédiatement si vous obtenez l'un des symptômes suivants:
- Se sentir très faible fatigué ou mal à l'aise (malaise)
- gonflement de ton visage
- ne pas avoir faim
- des nausées ou des vomissements qui ne disparaissent pas
- diarrhée
- Douleur sur le côté droit de votre estomac (abdomen)
- urine sombre
- jaunissement de votre peau ou des blancs de vos yeux
- Perte de contrôle des crises chez les personnes atteintes d'épilepsie
Dans certains cas, les lésions hépatiques peuvent se poursuivre même si le médicament est arrêté. Votre professionnel de la santé fera des tests sanguins pour vérifier votre foie avant et pendant le traitement par Depakote.
2. Depakote peut nuire à votre bébé à naître.
- Si vous prenez Depakote pendant la grossesse pour toute condition médicale, votre bébé est à risque de malformations congénitales graves qui affectent le cerveau et la moelle épinière (comme le spina bifida ou les anomalies du tube neural). Ces défauts peuvent commencer le premier mois avant même que vous sachiez que vous êtes enceinte. D'autres malformations congénitales qui affectent les structures des jambes de bras de tête cardiaque et l'ouverture où l'urine sort (uretra) au fond du pénis peut également se produire. Une diminution de la perte d'audition ou d'audition peut également se produire.
- Des malformations congénitales peuvent survenir même chez les enfants nés de femmes qui ne prennent aucun médicament et n'ont pas d'autres facteurs de risque.
- Prendre des suppléments d'acide folique avant de tomber enceinte et pendant la grossesse précoce peut réduire les chances d'avoir un bébé avec un défaut de tube neural.
- Si vous prenez Depakote pendant la grossesse pour toute condition médicale, votre enfant risque d'avoir un QI plus faible et peut être à risque de développer un trouble de l'autisme ou du déficit d'attention / hyperactivité.
- Il peut y avoir d'autres médicaments pour traiter votre état qui ont des chances plus faibles de provoquer une diminution du QI ou d'autres troubles du QI ou d'autres troubles de votre enfant.
- Les femmes enceintes ne doivent pas prendre Depakote pour empêcher les maux de tête de migraine.
- Toutes les femmes en âge de procréer (y compris les filles du début de la puberté) devraient parler à leur fournisseur de soins de santé de l'utilisation d'autres traitements possibles au lieu de Depakote. Si la décision est prise d'utiliser DePakote, vous devez utiliser un contraception efficace (contraception).
- Dites immédiatement votre professionnel de la santé si vous tombez enceinte en prenant Depakote. Vous et votre fournisseur de soins de santé devriez décider si vous continuerez à prendre Depakote pendant que vous êtes enceinte.
- Registre de grossesse: Si vous tombez enceinte en prenant Depakote, parlez à votre fournisseur de soins de santé de vous inscrire auprès du registre de grossesse antiépileptique nord-américain (NAAED). Vous pouvez vous inscrire à ce registre en appelant sans frais le 1-888-233-2334 ou en visitant le site Web https://www.aedpregnancyregistry.org/. Le but de ce registre est de collecter des informations sur la sécurité des médicaments antiépileptiques pendant la grossesse.
3. Gonflement (inflammation) et saignement (hémorragie) de votre pancréas qui peut provoquer la mort.
Appelez votre fournisseur de soins de santé immédiatement si vous présentez l'un de ces symptômes:
- Des douleurs à l'estomac sévères que vous pouvez également ressentir dans votre dos
- des nausées ou des vomissements qui ne disparaissent pas
- ne pas avoir faim
4. Comme les autres médicaments antiépileptiques, Depakote peut provoquer des pensées ou des actions suicidaires chez un très petit nombre de personnes environ 1 sur 500.
Appelez un fournisseur de soins de santé immédiatement si vous avez l'un de ces symptômes, surtout s'ils sont nouveaux pires ou vous inquiétez:
- Réflexions sur le suicide ou la mort
- tente de se suicider
- Dépression nouvelle ou pire
- Anxiété nouvelle ou pire
- Se sentir agité ou agité
- crises de panique
- Difficulté à dormir (insomnia)
- irritabilité nouvelle ou pire
- Agir agressif étant en colère ou violent
- Agissant sur des impulsions dangereuses
- Une augmentation extrême de l'activité et de la parole (manie)
- Autres changements inhabituels dans le comportement ou l'humeur
Comment puis-je surveiller les symptômes précoces des pensées et des actions suicidaires?
- Faites attention aux changements en particulier des changements soudains dans les pensées ou les sentiments des comportements d'humeur.
- Gardez toutes les visites de suivi avec votre fournisseur de soins de santé comme prévu.
Appelez votre fournisseur de soins de santé entre les visites au besoin, surtout si vous vous inquiétez des symptômes.
Les pensées ou les actions suicidaires peuvent être causées par des choses autres que les médicaments. Si vous avez des pensées ou des actions suicidaires, votre fournisseur de soins de santé peut vérifier d'autres causes.
Qu'est-ce que Depakote?
Depakote ER tablets Depakote delayed-release tablets et Depakote Sprinkle Capsules are prescription medicines used:
- seul ou avec d'autres médicaments à traiter:
- Saisies partielles complexes chez les adultes et les enfants de 10 ans et plus
- Saisies d'absence simples et complexes
- avec d'autres médicaments à traiter:
- les patients avec plusieurs types de crises qui incluent des crises d'absence
Depakote ER tablets et Depakote delayed-release tablets are also used to prevent migraine mal de têtes.
Depakote ER tablets are also used to treat acute manic or mixed episodes associated with trouble bipolaire with or without psychotic features.
Depakote delayed-release tablets are also used to treat manic episodes associated with trouble bipolaire.
Ne prenez pas Depakote si vous:
- avoir des problèmes de foie.
- avoir ou penser que vous avez un problème hépatique génétique causé par un trouble mitochondrial tel que le syndrome d'Alpers-Huttenlocher.
- sont allergiques au divalproex sodium valproïc acide sodium valproate ou à l'un des ingrédients de Depakote. Voir la fin de ce guide de médicaments pour une liste complète des ingrédients à Depakote.
- avoir un problème génétique appelé trouble du cycle de l'urée.
- le prennent pour empêcher les maux de tête de migraine et sont soit enceintes ou peuvent devenir enceintes parce que vous n'utilisez pas de contraception efficace (contraception).
Avant de prendre Depakote, dites à votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous:
- ont ou ont eu des problèmes de foie.
- avoir ou penser que vous avez un problème hépatique génétique causé par un trouble mitochondrial tel que le syndrome d'Alpers-Huttenlocher.
- boire de l'alcool.
- ont ou ont eu une dépression des pensées ou des comportements suicidaires des changements inhabituels d'humeur ou de pensées sur l'automutilation
- sont des hommes et prévoient de père un enfant. Depakote peut provoquer des problèmes de fertilité qui peuvent affecter votre capacité à adhérer à un enfant. Parlez à votre fournisseur de soins de santé si c'est un problème pour vous.
- sont enceintes ou peuvent devenir enceintes. Depakote peut nuire à votre bébé à naître. Voir 2. Depakote peut nuire à votre bébé à naître ci-dessus pour plus d'informations.
- allaitent. Depakote peut passer dans le lait maternel et peut nuire à votre bébé. Parlez à votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé si vous prenez Depakote.
Parlez à votre fournisseur de soins de santé de tous les médicaments que vous prenez y compris les médicaments sur ordonnance et en vente libre des vitamines et des suppléments à base de plantes.
Depakote may affect the way other medicines work et other medicines may affect how Depakote works. Using Depakote with other medicines can cause serious side effects. Ne pas start or stop other medicines without talking to your healthcare provider.
Parlez surtout de votre fournisseur de soins de santé si vous prenez:
- Médicaments qui peuvent affecter la façon dont le foie décompose d'autres médicaments (comme la phénytoïne carbamazépine felbamate rifampin de primidone phénobarbitale)
- aspirine carbapenem antibiotics or estrogen -containing hormonal contraceptives
- méthotrexate
- topiramate
- cannabidiol
Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien une liste de ces médicaments si vous n'êtes pas sûr.
Connaissez les médicaments que vous prenez. Gardez une liste d'entre eux et montrez-le à votre fournisseur de soins de santé et à votre pharmacien chaque fois que vous obtenez un nouveau médicament.
Comment dois-je prendre Depakote?
- Depakote comes in different dosage forms.
- Prenez Depakote exactement comme votre prestataire de soins de santé vous le dit. Votre fournisseur de soins de santé vous dira combien Depakote prendre et quand le prendre.
- Votre professionnel de la santé peut changer votre dose si nécessaire.
- Ne changez pas votre dose de Depakote sans parler à votre fournisseur de soins de santé.
- N'arrêtez pas de prendre Depakote sans d'abord parler à votre fournisseur de soins de santé. L'arrêt de Depakote peut soudainement causer de graves problèmes.
- Swallow Depakote er comprimés ou Depakote comprimés à libération retardée entiers. Ne les écrasez pas ou ne les mâchez pas. Dites à votre fournisseur de soins de santé si vous ne pouvez pas avaler des comprimés Depakote ER ou des comprimés de dépassement à libération retardée entièrement. Vous pouvez avoir besoin d'un médicament différent.
- Depakote Sprinkle Capsules may be swallowed whole or the capsule may be opened et the contents may be mixed into a small amount of soft food such as applesauce or pudding. Voir the Instructions for Use that comes with this Guide des médicaments for detailed instructions on how to use Depakote Sprinkle Capsules.
- Si vous manquez une dose de comprimés Depakote ER ou de comprimés de dépassement à libération retardée, prenez-le dès que vous vous en souvenez, à moins que ce soit presque le temps de votre prochaine dose. Prenez la prochaine dose à votre heure régulière. Ne prenez pas 2 doses en même temps.
- Si vous prenez trop Depakote, appelez immédiatement votre fournisseur de soins de santé ou votre centre de contrôle du poison.
Que dois-je éviter en prenant Depakote?
- Ne pas Buvez de l'alcool tout en prenant Depakote. Depakote et l'alcool peuvent s'affecter mutuellement, provoquant des effets secondaires tels que la somnolence et les étourdissements.
- Ne pas drive a car operate dangerous machinery or do dangerous activities until you know how Depakote affects you. Depakote can slow your thinking et motor skills et may affect your vision.
Quels sont les effets secondaires possibles de Depakote?
Appelez votre professionnel de la santé immédiatement si vous présentez l'un des symptômes énumérés ci-dessous. Votre fournisseur de soins de santé peut faire des tests supplémentaires avant et pendant votre traitement avec Depakote. Votre fournisseur de soins de santé peut réduire votre dose à arrêter temporairement ou à arrêter de façon permanente si vous avez certains effets secondaires.
Depakote can cause serious side effects including:
- Voir Quelles sont les informations les plus importantes que je devrais connaître sur DePakote?
- problèmes de saignement. Appelez votre fournisseur de soins de santé si vous avez des symptômes de saignement, notamment:
- Ecchyming ou taches rouges ou violettes sur votre peau
- vomissement blood or vomit that looks like coffee grounds
- Saignement de votre bouche ou de votre nez
- sang dans vos tabourets ou tabourets noirs (ressemble à du goudron)
- cracher du sang ou des caillots sanguins
- douleur et gonflement dans vos articulations
- Augmentation des niveaux d'ammoniac dans votre sang. Des niveaux élevés d'ammoniac peuvent sérieusement affecter vos activités mentales ralentissant votre vigilance qui vous fait vous sentir fatigué ou provoquer des vomissements (encéphalopathie). Cela s'est produit lorsque Depakote est pris seul ou avec un médicament appelé Topiramate. Appelez votre fournisseur de soins de santé si vous présentez l'un de ces symptômes.
- Basse température corporelle (hypothermie). Une baisse de votre température corporelle à moins de 95 ° F peut se produire pendant le traitement avec Depakote. Appelez votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants:
- Se sentir fatigué
- somnolence
- confusion
- coma
- perte de mémoire
- tremblement
- réactions multiorganiques sévères. Traitement with Depakote may cause severe multiorgan reactions that can be life-threatening or may lead to death. Stop taking Depakote et contact your healthcare provider or get medical help right away if you develop any of these symptoms of a severe skin reaction:
- fièvre
- cloques et éplucher de votre peau
- éruption cutanée
- gonflement de vos ganglions lymphatiques
- urticaire
- gonflement de ton visage eyes lips tongue or throat
- Des plaies dans votre bouche
- du mal à avaler ou à respirer
- somnolence or envie de dormir in the elderly. Cette somnolence extrême peut vous faire manger ou boire moins que vous ne le feriez normalement. Dites à votre fournisseur de soins de santé si vous n'êtes pas en mesure de manger ou de boire comme vous le faites normalement. Votre fournisseur de soins de santé peut vous déclencher à une dose plus faible de Depakote.
- résidu de médicaments dans vos tabourets. Dites à votre fournisseur de soins de santé si vous avez ou pensez que vous pouvez avoir des résidus de médicaments dans vos selles.
Les effets secondaires communs de Depakote comprennent:
- mal de tête
- perte d'appétit
- faiblesse
- perte de poids
- envie de dormir
- appétit accru
- vertiges
- prise de poids
- tremblements
- nausées / vomissements
- difficulté à marcher ou problèmes de coordination
- douleurs à l'estomac
- sonner dans vos oreilles
- diarrhée
- vision floue
- constipation
- double vision
- bronchite
- Mouvement oculaire inhabituel
- Symptômes pseudo-grippaux
- perte (alopecia)
- infection
- gonflement de vos bras ou jambes
Ce ne sont pas tous les effets secondaires possibles de Depakote.
Appelez votre médecin pour des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA1088.
Comment dois-je stocker Depakote?
- Stockez les comprimés Depakote ER à température ambiante entre 68 ° F à 77 ° F (20 ° C à 25 ° C).
- Stockez Depakote des comprimés de libération retardés en dessous de 86 ° F (30 ° C).
- Conservez les capsules de dépression Depakote en dessous de 77 ° F (25 ° C).
Gardez Depakote et tous les médicaments hors de portée des enfants.
Informations générales sur l'utilisation sûre et efficace de Depakote
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide de médicaments. N'utilisez pas Depakote pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas Depakote à d'autres personnes même s'ils présentent les mêmes symptômes que vous. Cela peut leur faire du mal.
Vous pouvez demander à votre pharmacien ou fournisseur de soins de santé pour des informations sur DePakote qui sont écrits pour les professionnels de la santé.
Quels sont les ingrédients de Depakote?
Ingrédient actif: divalproex sodium
Ingrédients inactifs:
- Depakote ER tablets: FD
- Depakote delayed-release tablets: Polymères cellulosiques Monoglycérides diacétylées Povidone Prégelatinisée Adons (contient du maïs Starch) Gel Talc TALC Titane Dioxyde et Vanilline.
- Les tablettes individuelles contiennent également:
- 125 mg comprimés: FD
- 250 mg de comprimés: FD
- 500 mg de comprimés: D
- Les tablettes individuelles contiennent également:
Depakote Sprinkle Capsules: polymères cellulosiques d