Patch exélon
Les Informations Présentées Sur Ce Site Ne Constituent Pas Un Avis Médical. Nous Ne Vendons Rien. L'Exactitude De La Traduction N'Est Pas Garantie. Clause De Non-Responsabilité
Résumé
Qu'est-ce que le patch Exelon?
Exélon Le patch (système transdermique de rivastigmine) est un inhibiteur réversible de la cholinestérase utilisée pour traiter les légers démence causée par la maladie d'Alzheimer ou de Parkinson.
Quels sont les effets secondaires du patch Exelon?
Les effets secondaires courants du patch exélon comprennent:
- nausée
- vomissement
- douleurs à l'estomac
- Perte d'appétit / perte de poids
- diarrhée
- faiblesse musculaire
- vertiges
- sensation de rotation
- mal de tête
- sentiment fatigué
- somnolence
- Problèmes de sommeil (insomnie)
- tremblement (tremblements)
- anxiété
- dépression et
- rougeur ou irritation de la peau où le patch exélon est porté.
Dites à votre médecin si vous avez des effets secondaires graves du patch Exelon, notamment:
- rythme cardiaque lent ou irrégulier
- évanouissement
- tabourets noirs
- Vomi qui ressemble à un marc de café
- Douleurs abdominales sévères ou abdominales
- convulsions ou
- difficulté à uriner.
Cherchez des soins médicaux ou appelez le 911 à la fois si vous avez les effets secondaires graves suivants:
- Des symptômes oculaires graves tels que la perte de vision soudaine floue du tunnel de vision de la vision de la vision des yeux ou de l'enflure ou de voir des halos autour des lumières;
- Symptômes cardiaques graves tels que les battements cardiaques rapides ou battants; flotter dans votre poitrine; essoufflement; et des étourdissements soudains étourdisseurs ou s'évanouissant;
- Maux de tête sévères Confusion Slurred Speech Bras ou Ligne Proulitude Trouble de la merde Perte de coordination Sentiment des muscles très rigides très rigides Fièvre élevée Propice ou des tremblements.
Ce document ne contient pas tous les effets secondaires possibles et d'autres peuvent survenir. Vérifiez auprès de votre médecin des informations supplémentaires sur les effets secondaires.
Dosage pour le patch exelon?
Exélon Patch dose is one 4.6 mg patch per 24 hours. Dose may be increased after a minimum of 4 weeks if needed et if the drug is well tolerated. The patch is intended for transdermal use only on intact skin.
Quelles substances ou suppléments de médicaments interagissent avec le patch exélon?
Certains produits qui peuvent interagir avec ce médicament comprennent aspirine AINSADS atropine benztropine méthscopolamine scopolamine bronchodilators glycopyrrolate mépenzolate vessie ou médicaments urinaires ou médicaments intestinaux irritables.
Exélon Patch During Grossesse et Breastfeeding
Pendant la grossesse, ce médicament ne doit être utilisé que lorsqu'il est prescrit par un médecin. On ne sait pas si ce médicament passe dans le lait maternel. Consultez votre médecin avant l'allaitement.
Exélon Patch During Grossesse et BreastfeedingInformations Complémentaires
Notre centre de médicaments à effets secondaires Exelon Patch offre une vue complète des informations sur les médicaments disponibles sur les effets secondaires potentiels lors de la prise de ce médicament.
Informations sur les médicaments de la FDA
- Description de la drogue
- Indications
- Effets secondaires
- Avertissements
- Surdosage
- Pharmacologie clinique
- Guide des médicaments
Description du patch exelon
Le patch exélon (système transdermique de rivastigmine) contient une rivastigmine A inhibiteur réversible de la cholinestérase connue chimiquement sous le nom de (s) -3- [1- (diméthylamino) éthyl] phényl éthylméthylcarbamate. Il a une formule empirique de C14H22N2O2 comme la base et un poids moléculaire de 250,34 (comme base). La rivastigmine est une claire visqueuse et incolore à un liquide jaune à très légèrement brun qui est avec parcimonie soluble dans l'eau et très soluble dans l'acétonitrile d'éthanol n-octanol et l'acétate d'éthyle.
Le coefficient de distribution à 37 ° C dans la solution de tampon N-octanol / phosphate pH 7 est de 4,27.
 |
Le patch Exelon est destiné à l'administration transdermique. Le patch est un stratifié à 4 couches contenant la matrice d'adhérence de la matrice de la couche de support et la doublure de libération qui se chevauchent (voir figure 1). La doublure de libération est supprimée et jetée avant utilisation.
Figure 1: section transversale du patch exélon
 |
Couche 1: film de support
Couche 2: Matrice de produits médicamenteux (acrylique)
Couche 3: matrice adhésive (silicone)
Couche 4: liner de libération (supprimé au moment d'utiliser)
Les excipients dans la formulation comprennent un adhérence en silicone en silicone poly (butylméthacrylate méthylméthacrylate) appliqué à un film de support en polymère flexible à l'huile de silicone et à la vitamine E.
Utilisations pour le patch Exelon
Maladie d'Alzheimer
Le patch Exelon est indiqué pour le traitement de la démence du type d'Alzheimer (AD). L’efficacité a été démontrée chez les patients atteints de maladie d’Alzheimer modérée légère et grave.
Démence de la maladie de Parkinson
Le patch Exelon est indiqué pour le traitement de la démence légère à modérée associée à la maladie de Parkinson (PDD).
Dosage pour le patch exélon
Dosage recommandéDose initiale
Lancer un traitement avec un patch exélon de 4,6 mg / 24 heures appliqué sur la peau une fois par jour [voir Instructions d'administration importantes ].
Titrage de dose
Augmentez la dose uniquement après un minimum de 4 semaines à la dose précédente et uniquement si la dose précédente a été tolérée. Pour les patients AD et PDD légers à modérés, continuent la dose efficace de 9,5 mg / 24 heures pendant aussi longtemps que le bénéfice thérapeutique persiste. Les patients peuvent ensuite être augmentés à une dose maximale efficace de 13,3 mg / 24 heures. Pour les patients atteints de 13,3 mg / 24 de l'AD sévères, c'est la dose efficace. Des doses supérieures à 13,3 mg / 24 heures ne conférent aucun avantage supplémentaire appréciable et sont associés à une augmentation de l'incidence des effets indésirables [voir Avertissements et précautions Effets indésirables ].
Maladie d'Alzheimer légère à modérée et démence de la maladie de Parkinson légère à modérée
La dose efficace du patch exélon est de 9,5 mg / 24 heures ou 13,3 mg / 24 heures administrée une fois par jour; Remplacez par un nouveau patch toutes les 24 heures.
Maladie d'Alzheimer sévère
La dose efficace du patch exélon chez les patients atteints de la maladie d'Alzheimer sévère est de 13,3 mg / 24 heures administrée une fois par jour; Remplacez par un nouveau patch toutes les 24 heures.
Interruption du traitement
Si le dosage est interrompu pendant 3 jours ou moins de traitement de redémarrage avec le même patch exélon de résistance. Si le dosage est interrompu pendant plus de 3 jours, redémarrez le traitement avec le patch exélon de 4,6 mg / 24 heures et titrer comme décrit ci-dessus.
Dosing dans des populations spécifiquesDossing Modifications chez les patients souffrant de troubles hépatiques
Envisagez d'utiliser le patch exélon de 4,6 mg / 24 heures comme dose initiale et d'entretien chez les patients atteints de score léger (score enfant-pugh 5 à 6) à une déficience hépatique modérée (enfant-pugh 7 à 9) [voir [voir Utiliser dans des populations spécifiques Pharmacologie clinique ].
Dossing Modifications chez les patients avec un faible poids corporel
Titre et surveillez soigneusement les patients avec un faible poids corporel (moins de 50 kg) pour les toxicités (par exemple, des vomissements de nausées excessives) et envisagez de réduire la dose d'entretien au patch exélon de 4,6 mg / 24 heures si ces toxicités se développent.
Passer à Exelon Patch à partir de capsules d'exélon ou de solution orale exélon
Les patients traités avec des capsules exélon ou une solution orale peuvent être passés à un patch exélon comme suit:
- Un patient qui est sur une dose quotidienne totale inférieure à 6 mg de rivastigmine orale peut être basculé au patch exélon de 4,6 mg / 24 heures.
- Un patient qui est sur une dose quotidienne totale de 6 mg à 12 mg de rivastigmine orale peut être passé au patch exélon de 9,5 mg / 24 heures.
Demandez aux patients ou aux soignants d'appliquer le premier patch le jour suivant la dernière dose orale.
Instructions d'administration importantes
Le patch Exelon est pour une utilisation transdermique sur une peau intacte.
- N'utilisez pas le patch si le joint de poche est cassé ou si le patch est coupé ou modifié de quelque manière que ce soit.
- Appliquez le patch Exelon une fois par jour.
- Appuyez fermement pendant 30 secondes jusqu'à ce que les bords collent bien lorsque vous appliquez sur une peau saine et saine sans poils sèches dans un endroit qui ne sera pas frotté par des vêtements serrés.
- Utilisez le haut ou le bas du dos comme site d'application car le patch est moins susceptible d'être supprimé par le patient. Si les sites à l'arrière ne sont pas accessibles, appliquez le patch sur le bras supérieur ou la poitrine.
- N'appliquez pas sur une zone de peau où la lotion à la crème ou la poudre a récemment été appliquée.
- N'appliquez pas sur la peau irritée rouge ou coupée.
- Remplacez le patch Exelon par un nouveau patch toutes les 24 heures. Demandez aux patients de ne porter qu'un seul patch à la fois (retirer le patch de la veille avant d'appliquer un nouveau patch) [voir Avertissements et précautions Surdosage ]. If a patch falls off or if a dose is missed apply a new patch immediately et then replace this patch the following day at the usual application time.
- Modifiez le site de l'application de correctifs quotidiennement pour minimiser l'irritation potentielle bien qu'un nouveau patch puisse être appliqué au même site anatomique général (par exemple, un autre endroit dans le haut du dos) les jours consécutifs. N'appliquez pas de nouveau patch au même endroit pendant au moins 14 jours.
- Peut porter le patch pendant le bain et par temps chaud. Évitez une longue exposition à des sources de chaleur externes (solariums excessifs de la lumière du soleil).
- Placez les patchs utilisés dans la pochette précédemment sauvée et jetez les ordures loin des animaux de compagnie ou des enfants.
- Lavez les mains avec du savon et de l'eau après avoir retiré le patch. En cas de contact avec les yeux ou si les yeux deviennent rouges après avoir manipulé le patch rincer immédiatement avec beaucoup d'eau et consultez un médecin si les symptômes ne se résolvent pas.
Comment fourni
Formes et forces posologiques
Patch exélon est disponible en 3 forces. Chaque patch a une couche de support beige étiquetée soit:
- Exélon® Patch 4,6 mg / 24 heures AMCX
- Exélon® Patch 9,5 mg / 24 heures BHDI
- Exélon® Patch 13.3 mg / 24 heures CNFU
Stockage et manipulationPatch exélon: 4,6 mg / 24 heures
Chaque patch de 5 cm2 contient 9 mg de base de rivastigmine avec en vain Taux de libération de 4,6 mg / 24 heures.
Carton de 30 .... NDC 0078-0501-15
Patch exélon: 9,5 mg / 24 heures
Chaque patch de 10 cm2 contient 18 mg de base de rivastigmine avec en vain Taux de libération de 9,5 mg / 24 heures.
Carton de 30 .... NDC 0078-0502-15
Patch exélon: 13,3 mg / 24 heures
Chaque patch de 15 cm2 contient 27 mg de base de rivastigmine avec en vain Taux de libération de 13,3 mg / 24 heures.
Carton de 30 .... NDC 0078-0503-15
Stocker à 20 ° C à 25 ° C (68 ° F à 77 ° F); Excursions autorisées entre 15 ° C et 30 ° C (59 ° F et 86 ° F) [voir Température ambiante contrôlée par l'USP ]. Keep Patch exélon in the individual sealed pouch until use. Each pouch contains 1 patch. Used systems should be folded with the adhesive surfaces pressed together et discarded safely.
Distribué par: Novartis Pharmaceuticals Corporation East Hanover New Jersey 07936. Révisé: mai 2024
Effets secondaires pour le patch exélon
Les effets indésirables cliniquement significatifs suivants sont décrits ci-dessous et ailleurs dans l'étiquetage:
- Réactions indésirables gastro-intestinales [voir Avertissements et précautions ]
- Réactions cutanées [voir Avertissements et précautions ]
- Autres réactions indésirables de l'augmentation de l'activité cholinergique [voir Avertissements et précautions ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions de réaction indésirables très variables observées dans les essais cliniques d'un médicament ne peuvent pas être directement comparées aux taux dans les essais cliniques d'un autre médicament et ne peuvent pas refléter les taux observés dans la pratique.
Patch exélon has been administered to 4516 patients with Alzheimer’s disease during clinical trials worldwide. Of these 3005 patients have been treated for at least 26 weeks 1771 patients have been treated for at least 52 weeks 974 patients have been treated for at least 78 weeks et 24 patients have been treated for at least 104 weeks.
Maladie d'Alzheimer légère à modéréeEssai international contrôlé de 24 semaines (étude 1)
Les effets indésirables les plus courants
Les réactions indésirables les plus courantes chez les patients administrés par un patch exélon dans l'étude 1 [voir Études cliniques ] Défini comme ceux qui se produisent à une fréquence d'au moins 5% dans le bras de patch exélon de 9,5 mg / 24 heures et à une fréquence à plus haut que dans le groupe placebo, des vomissements de nausées et de diarrhée. Ces réactions ont été liées à la dose, chacune étant plus fréquente chez les patients utilisant le patch exélon non approuvé de 17,4 mg / 24 heures que chez ceux utilisant le patch exélon de 9,5 mg / 24 heures.
Taux d'arrêt
Dans l'étude 1 qui a randomisé un total de 1195 patients, les proportions de patients dans le patch exélon 9,5 mg / 24 heures capsules d'exélon 6 mg deux fois par jour et les groupes placebo qui ont interrompu le traitement en raison d'événements indésirables étaient respectivement de 10% 8% et 5%.
Les effets indésirables les plus courants dans les groupes traités par patch exélon qui ont conduit à l'arrêt du traitement dans cette étude étaient les nausées et les vomissements. Les proportions de patients qui ont interrompu le traitement due à des nausées étaient de 0,7% 1,7% et 1,3% dans le patch exélon 9,5 mg / 24 heures capsules exélon 6 mg deux fois par jour et les groupes placebo respectivement. Les proportions de patients qui ont interrompu le traitement due aux vomissements étaient de 0% 2,0% et 0,3% dans le patch exélon 9,5 mg / 24 heures de capsules exélon 6 mg deux fois par jour et les groupes placebo respectivement.
Réactions indésirables observées à une incidence supérieure ou égale à 2%
Le tableau 1 répertorie les effets indésirables observés à une incidence supérieure à ou égale à 2% dans l'un ou l'autre groupe traité par patch exélon dans l'étude 1 et pour lequel le taux d'occurrence était plus élevé pour les patients traités avec cette dose de patch exélon que pour ceux traités avec un placebo. Le bras de patch exélon non approuvé de 17,4 mg / 24 heures est inclus pour démontrer l'augmentation des taux de réactions indésirables gastro-intestinales par rapport à celles observées avec le patch exélon de 9,5 mg / 24 heures.
Tableau 1: Proportion des effets indésirables observés avec une fréquence supérieure ou égale à 2% et se produisant à un rythme supérieur au placebo dans l'étude 1
| Réaction indésirable | Exélon CORRECTIF 9,5 mg / 24 heures | Exélon CORRECTIF 17,4 mg / 24 heures | Exélon Capsule 6 mg deux fois par jour | Placebo |
| Les patients totaux ont étudié | 291 | 303 | 294 | 302 |
| Pourcentage total de patients atteints d'ARS (%) | 51 | 66 | 63 | 46 |
| Nausée | 7 | 21 | 23 | 5 |
| Vomissement* | 6 | 19 | 17 | 3 |
| Diarrhée | 6 | 10 | 5 | 3 |
| Dépression | 4 | 4 | 4 | 1 |
| Mal de tête | 3 | 4 | 6 | 2 |
| Anxiété | 3 | 3 | 2 | 1 |
| Anorexie / appétit diminué | 3 | 9 | 9 | 2 |
| Le poids a diminué ** | 3 | 8 | 5 | 1 |
| Vertiges | 2 | 7 | 7 | 2 |
| Douleurs abdominales | 2 | 4 | 1 | 1 |
| Infection des voies urinaires | 2 | 2 | 1 | 1 |
| Asthénie | 2 | 3 | 6 | 1 |
| Fatigue | 2 | 2 | 1 | 1 |
| Insomnie | 1 | 4 | 2 | 2 |
| Douleurs abdominales upper | 1 | 3 | 2 | 2 |
| Vertige | 0 | 2 | 1 | 1 |
| Abréviation: réactions indésirables ARS. * Les vomissements étaient graves chez 0% des patients qui ont reçu un patch exélon 9,5 mg / 24 heures 1% des patients qui ont reçu un patch exélon 17,4 mg / 24 heures 1% of patients who received the Exélon Capsule at doses up to 6 mg deux fois par jour et 0% of those who received placebo. **Weight Decreased as presented in Table 1 is based upon clinical observations et/or adverse events reported by patients or caregivers. Body weight was also monitored at prespecified time points throughout the course of the clinical study. The proportion of patients who had perte de poids equal to or greater than 7% of their baseline weight was 8% of those treated with Patch exélon 9,5 mg / 24 heures 12% of those treated with Patch exélon 17,4 mg / 24 heures 11% of patients who received the Exélon Capsule at doses up to 6 mg deux fois par jour et 6% of those who received placebo. It is not clear how much of the perte de poids was associated with anorexia nausée vomissement et the diarrhée associated with the drug. |
Essai international actif international de 48 semaines (étude 2)
Les effets indésirables les plus courants
Dans l'étude 2 [voir Études cliniques ] Parmi les effets indésirables couramment observés (supérieurs ou égaux à 3% dans tout groupe de traitement) L'événement le plus fréquent dans le groupe Exelon Patch 13,3 mg / 24 heures a été des nausées suivies de la diarrhème de la chute de vomissements diminué par un érythème d'application (tableau 3). Le pourcentage de patients avec ces événements était plus élevé dans le groupe Exelon Patch 13,3 mg / 24 heures que dans le groupe Exelon Patch 9,5 mg / 24 heures. Les patients atteints de nausées vomissements de la diarrhée et une diminution de l'appétit ont connu ces réactions plus souvent au cours des 4 premières semaines de la phase de traitement en double aveugle. Ces réactions ont diminué au fil du temps dans chaque groupe de traitement. Le poids diminué aurait augmenté au fil du temps dans chaque groupe de traitement.
Taux d'arrêt
Le tableau 2 présente les effets indésirables les plus courants menant à l'arrêt pendant la phase de traitement en double aveugle de 48 semaines dans l'étude 2.
Tableau 2: Proportion des réactions indésirables les plus courantes (supérieures à 1% à n'importe quelle dose) entraînant l'arrêt pendant la phase de traitement en double aveugle de 48 semaines dans l'étude 2 >
| Réaction indésirable | Exélon CORRECTIF 13,3 mg / 24 heures | Exélon CORRECTIF 9,5 mg / 24 heures | Total |
| Les patients totaux ont étudié | 280 | 283 | 563 |
| Total percentage of patients with ARs leading to discontinuation (%) | 9.6 | 12.7 | 11.2 |
| Vomissement | 1.4 | 0.4 | 0.9 |
| Prurit de site d'application | 1.1 | 1.1 | 1.1 |
| Agression | 0.4 | 1.1 | 0.7 |
| Abréviation: réactions indésirables ARS. |
Les effets indésirables les plus courants Greater than or Equal to 3%
D'autres effets indésirables d'intérêt qui se sont produits moins fréquemment mais qui ont été observés dans un pourcentage nettement plus élevé de patients du groupe Exelon Patch 13,3 mg / 24 heures que dans le groupe Exelon Patch 9,5 mg / 24 heures dans l'étude 2 comprenaient des étourdissements et des douleurs abdominales supérieures. Le pourcentage de patients avec ces réactions a diminué au fil du temps dans chaque groupe de traitement (tableau 3). Le profil de gravité de la réaction indésirable était généralement similaire à la fois pour le patch exélon 13,3 mg / 24 heures et 9,5 mg / 24 heures.
Tableau 3: Proportion des effets indésirables au fil du temps dans la phase de traitement en double aveugle de 48 semaines (au moins 3% dans tout groupe de traitement) dans l'étude 2
| Réaction indésirable | Semaine cumulée 0 à 48 (Phase DB) | Semaine 0 à 24 (Phase DB) | Semaine> 24 à 48 (Phase DB) | |||
| Patch exélon 13,3 mg / 24 heures | Patch exélon 9,5 mg / 24 heures | Patch exélon 13,3 mg / 24 heures | Patch exélon 9,5 mg / 24 heures | Patch exélon 13,3 mg / 24 heures | Patch exélon 9,5 mg / 24 heures | |
| Les patients totaux ont étudié | 280 | 283 | 280 | 283 | 241 | 246 |
| Total percentage ofpatients with ARs (%) | 75 | 68 | 65 | 55 | 42 | 40 |
| Nausée | 12 | 5 | 10 | 4 | 4 | 2 |
| Vomissement | 10 | 5 | 9 | 3 | 3 | 2 |
| Automne | 8 | 6 | 4 | 4 | 4 | 3 |
| Le poids a diminué * 7 3 | 7 | 3 | 3 | 1 | 5 | 2 |
| Érythème du site d'application | 6 | 6 | 6 | 5 | 1 | 2 |
| Diminution de l'appétit | 6 | 3 | 5 | 2 | 2 | <1 |
| Diarrhée | 6 | 5 | 5 | 4 | 2 | <1 |
| Infection des voies urinaires | 5 | 4 | 3 | 3 | 3 | 2 |
| Agitation | 5 | 5 | 4 | 3 | 1 | 2 |
| Dépression | 5 | 5 | 3 | 3 | 3 | 2 |
| Vertiges | 4 | 1 | 3 | <1 | 2 | <1 |
| Prurit de site d'application | 4 | 4 | 4 | 3 | <1 | 1 |
| Mal de tête | 4 | 4 | 4 | 4 | <1 | <1 |
| Insomnie | 4 | 3 | 2 | 1 | 3 | 2 |
| Douleurs abdominales upper | 4 | 1 | 3 | 1 | 1 | <1 |
| Anxiété | 4 | 3 | 2 | 2 | 2 | 1 |
| Hypertension | 3 | 3 | 3 | 2 | 1 | 1 |
| Incontinence urinaire | 3 | 2 | 2 | 1 | 1 | <1 |
| Hyperactivité psychomotrice | 3 | 3 | 2 | 3 | 2 | 1 |
| Agression | 2 | 3 | 1 | 3 | 1 | 1 |
| Abréviations: DB double aveugle; Réactions indésirables ARS. * La diminution du poids présentée dans le tableau 3 est basée sur des observations cliniques et / ou des événements indésirables rapportés par les patients ou les soignants. Le poids corporel a été surveillé comme un signe vital à des moments pré-spécifiés tout au long de l'étude clinique. La proportion de patients qui avaient une perte de poids égale ou supérieure à 7% de leur poids de base était de 15,2% des personnes traitées avec un patch exélon 9,5 mg / 24 heures et 18.6% of those treated with Patch exélon 13,3 mg / 24 heures during the 48-week double-blind treatment period. |
Maladie d'Alzheimer sévère Essai contrôlé par les États-Unis de 24 semaines (étude 3)
Les réactions indésirables les plus souvent observées
Les réactions indésirables les plus courantes chez les patients administrés par un patch exélon dans l'essai clinique contrôlé défini comme ceux qui se produisent à une fréquence d'au moins 5% dans le patch exélon de 13,3 mg / 24 heures et à une fréquence plus élevée que dans le poids de 4,6 mg / 24 heures exélon. Les patients du groupe à basse dose ont signalé plus d'événements d'infection des voies urinaires d'agitation et d'hallucinations que les patients du groupe à dose plus élevée.
Taux d'arrêt
Dans l'étude 3 [voir Études cliniques ] Les proportions de patients dans le patch exélon 13,3 mg / 24 heures (n = 355) et le patch exélon 4,6 mg / 24 heures (n = 359) qui ont interrompu le traitement en raison de réactions indésirables étaient respectivement de 21% et 14%.
La réaction indésirable la plus fréquente conduisant à l'arrêt dans le groupe de traitement de 13,3 mg / 24 heures par rapport au groupe de traitement de 4,6 mg / 24 heures était l'agitation (2,8% contre 2,2%) suivie par des vomissements (2,5% et 1,1%) nausées (1,7% et 1,1%) ont diminué l'appétit (1,7% et 0%) (1% et 0,3%) chute (1,1% et 0,3 et 1,1% et 0,1%) chute (1,1% et 1,1%) et 1,1% et 0,3%) chute (1,1% et 0,3 et 1,1% et 1%). et 0,3%). Sinon, tous les EI conduisant à l'arrêt ont été signalés chez moins de 1% des patients.
Les réactions indésirables les plus souvent observées Greater than or Equal to 5%
D'autres réactions indésirables d'intérêt qui ont été observées dans un pourcentage plus élevé de patients du groupe Exelon Patch 13,3 mg / 24 heures que dans le groupe Exelon Patch 4,6 mg / 24 heures incluent le poids de l'érythème d'application, l'insomnie de la chute de la diarrhée a diminué et la nausée (tableau 4). Dans l'ensemble, la majorité des patients de cette étude ont connu des effets indésirables qui étaient légers (30,7%) ou modérés (32,1%) de gravité. Un peu plus de patients dans le groupe de patch de 4,6 mg / 24 heures a signalé des événements légers que dans le groupe de correctif de 13,3 mg / 24 heures tandis que le nombre de patients signalant des événements modérés était comparable entre les groupes. Des effets indésirables graves ont été signalés à un pourcentage légèrement plus élevé à la dose plus élevée (12,4%) qu'aux groupes de traitement à dose inférieure (10%). À l'exception des effets indésirables graves de l'agitation (13,3 mg: 1,1%; 4,6 mg: 1,4%) chute (13,3 mg: 1,1%) et une infection des voies urinaires (4,6 mg: 1,1%) toutes les réactions indésirables signalées comme sévères se sont produites chez moins de 1% des patients dans l'un ou l'autre groupe de traitement.
Tableau 4: Proportion des effets indésirables dans la phase de double aveugle de 24 semaines (au moins 5% dans tout groupe de traitement) dans l'étude 3
| Réaction indésirable | Patch exélon 13,3 mg / 24 heures | Patch exélon 4,6 mg / 24 heures |
| Total number of patients studied | 355 | 359 |
| Pourcentage total de patients atteints d'ARS (%) | 75 | 73 |
| Érythème du site d'application | 13 | 12 |
| Agitation | 12 | 14 |
| Infection des voies urinaires | 8 | 10 |
| Automne | 8 | 6 |
| Insomnie | 7 | 4 |
| Vomissement | 7 | 3 |
| Diarrhée | 7 | 5 |
| Le poids a diminué * | 7 | 3 |
| Nausée | 6 | 3 |
| Dépression | 5 | 4 |
| Diminution de l'appétit | 5 | 1 |
| Anxiété | 5 | 5 |
| Hallucination | 2 | 5 |
| Abréviation: réactions indésirables ARS. * Le poids diminué comme présenté dans le tableau 4 est basé sur des observations cliniques et / ou des événements indésirables rapportés par les patients ou les soignants. Le poids corporel a été surveillé en tant que signe vital à des moments prédéfinis tout au long de l'étude clinique. La proportion de patients ayant une perte de poids égale ou supérieure à 7% de leur poids de base était de 11% des personnes traitées avec un patch exélon 4,6 mg / 24 heures et 14,1% des personnes traitées avec un patch exélon 13,3 mg / 24 heures pendant le traitement en double aveugle de 24 semaines. |
Réactions du site d'application
Des réactions cutanées du site d'application conduisant à l'arrêt ont été observées chez moins de 2,3% des patients atteints de patch exélon. Ce nombre était de 4,9% et 8,4% dans la population chinoise et la population japonaise respectivement.
Les cas d'irritation cutanée ont été capturés séparément sur une échelle d'irritation cutanée évaluée par les chercheurs. L'irritation cutanée lorsqu'elle était observée était principalement légère ou légère de gravité et a été considérée comme sévère dans moins que ou égal à 2,2% des patients atteints de patch exélon dans une étude contrôlée en double aveugle et dans moins ou égal à 3,7% des patients atteints de patch exélon dans une étude contrôlée en double aveugle chez les patients japonais.
Démence de la maladie de ParkinsonEssai international de 76 semaines en ouvert (étude 4)
Patch exélon has been administered to 288 patients with mild-to-moderate Démence de la maladie de Parkinson in a single 76-week open-label active-comparator safety study. Of these 256 have been treated for at least 12 weeks 232 for at least 24 weeks et 196 for at least 52 weeks.
Le traitement avec un patch exélon a été initié à 4,6 mg / 24 heures et si elle est tolérée, la dose a été augmentée après 4 semaines à 9,5 mg / 24 heures. La capsule d'exélon (dose d'entretien cible de 12 mg / jour) a servi de comparateur actif et a été administré à 294 patients. Les effets indésirables sont présentés dans le tableau 5.
Tableau 5: Proportion des effets indésirables rapportés à un taux supérieur ou égal à 2% au cours de la période initiale de 24 semaines dans l'étude 4
| Réaction indésirable | Patch exélon |
| Les patients totaux ont étudié | 288 |
| Pourcentage (%) | |
| Troubles psychiatriques | |
| Insomnie | 6 |
| Dépression | 6 |
| Anxiété | 5 |
| Agitation | 3 |
| Troubles du système nerveux | |
| Tremblement | 7 |
| Vertiges | 6 |
| Somnolence | 4 |
| Hypokinésie | 4 |
| Bradykinésie | 4 |
| Rigidité de la roue de régime | 3 |
| Dyskinésie | 3 |
| Troubles gastro-intestinaux | |
| Douleurs abdominales | 2 |
| Troubles vasculaires | |
| Hypertension | 3 |
| Troubles généraux et conditions d'administration | |
| Automne | 12 |
| Érythème du site d'application | 11 |
| Éruption de prurit d'irritation du site d'application | 3; 5; 2 |
| Fatigue | 4 |
| Asthénie | 2 |
| Perturbation de la marche | 4 |
Des réactions indésirables supplémentaires observées au cours de l'étude prospective de 76 semaines en plein essor chez des patients atteints de démence associée à la maladie de Parkinson traités avec un patch exélon: fréquent (ceux qui se produisent chez au moins 1/100 patients): le poids de la déshydratation a diminué l'hallucination d'agression.
Chez les patients atteints de démence associée à la maladie de Parkinson, les effets indésirables suivants n'ont été observés que dans les essais cliniques avec des capsules d'exélon: fréquentes: les nausées vomissements diminuaient l'agitation de l'appétit aggravant la maladie de la maladie de Parkinson augmentée; Peu fréquent (ceux qui se produisent entre 1/100 à 1/1000 patients): Bloc autreoventriculaire de fibrillation auriculaire de la dystonie.
Expérience de commercialisation de la poste
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation des capsules exélones solution orale exélon ou patch exélon. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Troubles cardiaques: Tachycardia QTc prolongation torsades de pointes
Troubles hépatobiliaires: La fonction hépatique anormale teste l'hépatite
Troubles du système nerveux: La maladie de Parkinson (aggravation) Tremor de crise
Qu'est-ce que la ciprofloxacine 500 utilisée pour
Troubles psychiatriques: cauchemars
Troubles de la peau et des tissus sous-cutanés: Dergique Dergique Application Site Hypersensibilité Blister Dergique Dergique Dergique Syndrome de Stevens-Johnson Urticaire
Troubles vasculaires: Hypertension
Interactions médicamenteuses pour le patch exélon
Métoclopramide
En raison du risque d'additifs indésirables extra-pyramidaux, l'utilisation concomitante du métoclopramide et du patch exélon n'est pas recommandée.
Médicaments cholinomimétiques et anticholinergiques
Patch exélon may increase the cholinergic effects of other cholinomimetic medications et may also interfere with the activity of anticholinergic medications (e.g. oxybutynin tolterodine). Concomitant use of Patch exélon with medications having these pharmacologic effects is not recommended unless deemed clinically necessary [see Avertissements et précautions ].
Bêta-bloquants
Des effets bradycardiques additifs entraînant une syncope peuvent se produire lorsque l'exélon est utilisé concomitamment avec les bêta-bloquants, en particulier les bêta-bloquants cardiosélectifs (y compris l'aténolol). L'utilisation concomitante n'est pas recommandée lorsque des signes de bradycardie, y compris la syncope, sont présents.
Avertissements pour le patch exelon
Inclus dans le cadre du 'PRÉCAUTIONS' Section
Précautions pour le patch exelon
Erreurs de médicament entraînant une surdose
Les erreurs de médicament avec un patch exélon ont entraîné de graves réactions indésirables; Certains cas ont nécessité une hospitalisation et ont rarement conduit à la mort. La majorité des erreurs de médicament ont impliqué de ne pas supprimer l'ancien patch lorsqu'ils en mettront un nouveau et l'utilisation de plusieurs patchs à la fois.
Instruire les patients et leurs soignants sur les instructions d'administration importantes pour les patchs exélon [voir Posologie et administration ].
Effets indésirables gastro-intestinaux
Le patch Xelon peut provoquer des réactions indésirables gastro-intestinales, notamment des nausées de nausées significatives, l'anorexie diarrhée / diminution de l'appétit et de la perte de poids. La déshydratation peut résulter de vomissements prolongés ou de diarrhée et peut être associé à de graves résultats. L'incidence et la gravité de ces réactions sont liées à la dose [voir Effets indésirables ]. For this reason initiate treatment with Patch exélon at a dose of 4,6 mg / 24 heures et titrate to a dose of 9,5 mg / 24 heures et then to a dose of 13,3 mg / 24 heures if appropriate [see Posologie et administration ].
Si le traitement est interrompu pendant plus de 3 jours en raison de l'intolérance, réinitialisez le patch exélon avec la dose de 4,6 mg / 24 heures pour réduire la possibilité de vomissements graves et ses séquelles potentiellement graves. Un rapport de marché postal a décrit un cas de vomissements sévères avec rupture œsophagienne après une réinitiation inappropriée du traitement d'une formulation orale de rivastigmine sans rétriété après 8 semaines d'interruption du traitement.
Informer les soignants pour surveiller les effets indésirables gastro-intestinaux et informer le médecin s'ils se produisent. Il est essentiel d'informer les soignants que si la thérapie a été interrompue pendant plus de 3 jours en raison de l'intolérance, la dose suivante ne doit pas être administrée sans contacter le médecin concernant une rétroaction appropriée.
Réactions cutanées
Les réactions du site d'application de la peau peuvent se produire avec un patch exélon. Ces réactions ne sont pas en elles-mêmes une indication de sensibilisation. Cependant, l'utilisation du patch de rivastigmine peut entraîner une dermatite de contact allergique.
La dermatite de contact allergique doit être suspectée si les réactions du site d'application se propagent au-delà de la taille du patch s'il existe des preuves d'une réaction locale plus intense (par exemple, l'augmentation des vésicules de papules d'œdème d'érythème) et si les symptômes ne s'améliorent pas significativement dans les 48 heures après l'élimination des patchs. Dans ces cas, le traitement doit être interrompu [voir Contre-indications ].
Chez les patients qui développent des réactions de sites applicables à des patchs exélon, suggérant une dermatite de contact allergique et qui nécessitent toujours un traitement à la rivastigmine ne doit être passé à la rivastigmine orale uniquement après des tests d'allergies négatifs et sous surveillance médicale étroite. Il est possible que certains patients sensibilisés à la rivastigmine par exposition au patch rivastigmine ne puissent pas prendre la rivastigmine sous quelque forme que ce soit.
Il y a eu des rapports post-commercialisation isolés de patients souffrant de dermatite allergique disséminée lors de l'administration de rivastigmine, quelle que soit la voie d'administration (orale ou transdermique). Dans ces cas, le traitement doit être interrompu [voir Contre-indications ]. Patients et caregivers should be instructed accordingly.
Autres effets indésirables de l'augmentation de l'activité cholinergiqueEffets neurologiques
Symptômes extrapyramidaux
Les cholinomimétiques, y compris la rivastigmine peuvent exacerber ou induire des symptômes extrapyramidaux. L'aggravation des symptômes parkinsoniens en particulier des tremblements a été observée chez les patients atteints de démence associée à la maladie de Parkinson qui ont été traitées avec des capsules d'exélon.
Crises
Les médicaments qui augmentent l'activité cholinergique auraient un certain potentiel pour provoquer des crises. Cependant, l'activité de crise peut également être une manifestation de la maladie d'Alzheimer.
Ulcères gastro-dites / saignements gastro-intestinaux
Les inhibiteurs de la cholinestérase, y compris la rivastigmine peuvent augmenter la sécrétion d'acide gastrique en raison de l'augmentation de l'activité cholinergique. Surveillez les patients à l'aide d'un patch exélon pour les symptômes de saignements gastro-intestinaux actifs ou occultes, en particulier ceux qui ont un risque accru de développement d'ulcères, par exemple Ceux qui ont des antécédents d'ulcères ou ceux qui reçoivent des anti-inflammatoires non stéroïdiens simultanés (AINS). Les études cliniques de la rivastigmine n'ont montré aucune augmentation significative par rapport au placebo dans l'incidence de l'ulcère gastro-duodénal ou des saignements gastro-intestinaux.
Utiliser avec l'anesthésie
La rivastigmine en tant qu'inhibiteur de la cholinestérase est susceptible d'exagérer la relaxation musculaire de type succinylcholine pendant l'anesthésie.
Effets de la conduction cardiaque
Parce que la rivastigmine augmente l'activité cholinergique que l'utilisation du patch exélon peut avoir des effets vagotoniques sur la fréquence cardiaque (par exemple la bradycardie). Le potentiel de cette action peut être particulièrement important chez les patients atteints du syndrome des sinus malades ou d'autres conditions de conduction cardiaque supraventriculaire.
Effets génito-urinaires
Bien que non observé dans les essais cliniques de médicaments à la rivastigmine qui augmentent l'activité cholinergique peuvent provoquer une obstruction urinaire
Effets pulmonaires
Les médicaments qui augmentent l'activité cholinergique, y compris le patch exélon, doivent être utilisés avec soin chez les patients ayant des antécédents d'asthme ou de maladie pulmonaire obstructive.
Altération de la conduite ou de l'utilisation des machines
La démence peut entraîner une altération progressive des performances de conduite ou compromettre la possibilité d'utiliser des machines. L'administration de rivastigmine peut également entraîner des effets indésirables nuisibles à ces fonctions. Pendant le traitement avec des patchs Exelon, évaluez systématiquement la capacité du patient à continuer de conduire ou d'exploiter des machines.
Informations de conseil des patients
Conseiller au patient de lire l'étiquetage des patients approuvé par la FDA ( Informations et instructions pour les patients pour une utilisation ).
Importance de l'utilisation correcte
Informer les patients ou les soignants de l'importance d'appliquer la bonne dose sur la bonne partie du corps. Ils doivent être invités à faire pivoter le site d'application afin de minimiser l'irritation cutanée. Le même site ne doit pas être utilisé dans les 14 jours. Le patch de la veille doit être retiré avant d'appliquer un nouveau patch à un autre emplacement pour la peau. Le patch Exelon doit être remplacé toutes les 24 heures et l'heure de la journée doit être cohérente. Il peut être utile que cela fasse partie d'une routine quotidienne comme le bain ou la douche quotidien. Un seul patch doit être porté à la fois [voir Posologie et administration Avertissements et précautions ].
Demandez aux patients ou aux soignants d'éviter l'exposition du patch à des sources de chaleur externes (saunas de lumière du soleil excessive) pendant de longues périodes. Instruire les patients qui ont manqué une dose pour appliquer un nouveau patch immédiatement. Ils peuvent appliquer le prochain patch à l'heure habituelle le lendemain. Demandez aux patients de ne pas appliquer 2 patchs pour compenser 1 manqué.
Informez le patient ou le soignant pour contacter le médecin pour les instructions de rétablissement si le traitement a été interrompu.
Jeter les correctifs utilisés
Demandez aux patients ou aux soignants de plier le patch en deux après une utilisation, renvoyez le patch utilisé dans sa poche d'origine et jetez-le hors de la portée et de la vue des enfants et des animaux de compagnie. Ils doivent également être informés que le médicament reste encore dans le patch après une utilisation 24 heures sur 24. Ils devraient être invités à éviter le contact visuel et à se laver les mains après la manipulation du patch. En cas de contact accidentel avec les yeux ou si leurs yeux deviennent rouges après avoir manipulé le patch, ils devraient être invités à rincer immédiatement avec beaucoup d'eau et à consulter un médecin si les symptômes ne résolvent pas [voir Posologie et administration ].
Effets indésirables gastro-intestinaux
Informer les patients ou les soignants des effets indésirables gastro-intestinaux potentiels tels que les vomissements de nausées et la diarrhée, y compris la possibilité de déshydratation due à ces symptômes. Expliquez que le patch Exelon peut affecter l'appétit du patient et / ou le poids du patient. Les patients et les soignants doivent être invités à rechercher ces effets indésirables en particulier lorsque le traitement est initié ou que la dose est augmentée. Demandez aux patients et aux soignants d'informer un médecin si ces effets indésirables persistent [voir Avertissements et précautions ].
Réactions cutanées
Informer les patients ou les soignants sur le potentiel de réactions de dermatite à contact allergique pour se produire. Les patients ou les soignants doivent être invités à informer un médecin si les réactions du site d'application se propagent au-delà de la taille des patchs en cas de preuve d'une réaction locale plus intense (par exemple, l'augmentation des vésicules de papules d'œdème érythème) et si les symptômes ne s'améliorent pas significativement dans les 48 heures suivant l'enlèvement des patchs [voir Avertissements et précautions ].
Utilisation concomitante de médicaments avec action cholinergique
Informer les patients ou les soignants que, même si le port de patients exélones ne devrait pas prendre de capsules d'exécutions ou de solution orale exélon ou d'autres médicaments avec des effets cholinergiques [voir Avertissements et précautions ].
Grossesse
Conseillez aux patients de notifier leur fournisseur de soins de santé s'ils sont enceintes ou prévoient de devenir enceintes.
Toxicologie non cliniqueCarcinogenèse Mutagenèse A trouble de la fertilitéCancérogenèse
Cancérogenèse
Dans les études de cancérogénicité orale menées à des doses allant jusqu'à 1,1 mg / kg / jour chez le rat et 1,6 mg / kg / jour chez les souris, la rivastigmine n'était pas cancérigène.
Dans une étude de cancérogénicité cutanée menée à des doses jusqu'à 0,75 mg de base / kg / jour chez la souris, la rivastigmine n'était pas cancérigène. L'exposition moyenne au plasma de rivastigmine (ASC) à cette dose était inférieure à celle chez l'homme à la dose humaine maximale recommandée (13,3 mg / 24 heures).
Mutagenèse
La rivastigmine était classique en in vitro Dosages d'aberration chromosomiques dans les cellules de mammifères en présence mais pas l'absence d'activation métabolique. La rivastigmine était négative dans un in vitro Mutation bactérienne inverse (AMES) in vitro Test HGPRT et dans un en vain Test de micronucléus de souris.
Altération de la fertilité
Aucune étude de fertilité ou de reproduction de la rivastigmine dermique n'a été menée chez les animaux. La rivastigmine n'a eu aucun effet sur la fertilité ou les performances de reproduction chez le rat à des doses orales jusqu'à 1,1 mg / kg / jour.
Utiliser dans des populations spécifiquesGrossesseRésumé des risques
Résumé des risques
Il n'y a pas de données adéquates sur les risques de développement associés à l'utilisation de l'exélon chez les femmes enceintes. Chez les animaux, aucun effet indésirable sur le développement des embryons-foetal n'a été observé à des doses orales 2 à 4 fois la dose humaine maximale recommandée (MRHD) (voir Données ).
Le risque de fond de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnue. Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est respectivement de 2% à 4% et 15% à 20%.
Données
Données sur les animaux
L'administration orale de rivastigmine à des rats et lapins enceintes dans toute l'organogenèse n'a produit aucun effet indésirable sur le développement embryo-fœtal jusqu'à la dose la plus élevée (2,3 mg / kg / jour), ce qui est respectivement 2 et 4 fois le MRHD de 12 mg par jour sur une surface corporelle (Mg / m respectivement (Mg / M2) base.
LactationRésumé des risques
Il n'y a pas de données sur la présence de rivastigmine dans le lait maternel les effets sur le nourrisson allaité ou les effets de la rivastigmine sur la production de lait. La rivastigmine et ses métabolites sont excrétés dans le lait de rat après l'administration orale de rivastigmine; Les niveaux de rivastigmine plus les métabolites dans le lait de rat sont environ 2 fois dans le plasma maternel.
Les avantages du développement et de la santé de l'allaitement doivent être pris en compte ainsi que le besoin clinique de la mère d'exélon et tout effet indésirable potentiel sur le nourrisson allaité à partir d'exélon ou de l'état maternel sous-jacent.
Usage pédiatrique
La sécurité et l'efficacité des patients pédiatriques n'ont pas été établies. L'utilisation du patch exélon chez les patients pédiatriques (moins de 18 ans) n'est pas recommandée.
Utilisation gériatrique
Sur le nombre total de patients dans les études cliniques sur le patch exélon, 88% étaient de 65 ans et plus, tandis que 55% étaient de 75 ans. Aucune différence globale de sécurité ou d'efficacité n'a été observée entre ces patients et les patients plus jeunes et d'autres expériences cliniques signalées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains personnes âgées ne peut être exclue.
Trouble hépatique
Une exposition accrue à la rivastigmine a été observée chez les patients présentant une déficience hépatique légère ou modérée avec une rivastigmine orale. Les patients présentant une déficience hépatique légère ou modérée peuvent ne être en mesure de tolérer que des doses plus faibles [voir Posologie et administration Pharmacologie clinique ]. No data are available on the use of rivastigmine in patients with severe hepatic impairment.
Poids corporel faible ou élevé
Parce que les taux sanguins de rivastigmine varient en poids avec un titrage et une surveillance prudents doivent être effectués chez les patients présentant des poids corporels faibles ou élevés [voir Posologie et administration Pharmacologie clinique ].
Informations sur la surdose pour le patch exelon
Une surdose avec un patch exelon a été signalée dans le paramètre de bourse de poste [voir Avertissements et précautions ]. Overdoses have occurred from application of more than one patch at one time et not removing the previous day’s patch before applying a new patch. The symptoms reported in these overdose cases are similar to those seen in cases of overdose associated with rivastigmine oral formulations.
acide ellagique
Étant donné que les stratégies de gestion de la surdose évoluent continuellement, il est conseillé de contacter un centre de contrôle des poisons pour déterminer les dernières recommandations pour la gestion d'une surdose de tout médicament. Comme la rivastigmine a une demi-vie plasmatique d'environ 3,4 heures après l'administration du patch et une durée d'inhibition de l'acétylcholinestérase d'environ 9 heures, il est recommandé que, dans les cas de surdose asymptomatique, le patch soit immédiatement retiré et qu'aucun autre patch ne soit appliqué pour les 24 prochaines heures.
Comme dans tous les cas de surdose, des mesures de soutien générales devraient être utilisées.
Le surdosage avec les inhibiteurs de la cholinestérase peut entraîner une crise cholinergique caractérisée par de graves nausées vomissements de salivation transpirant la bradycardie hypotension dépression respiratoire et convulsions. L'augmentation de la faiblesse musculaire est une possibilité et peut entraîner la mort si des muscles respiratoires sont impliqués. Des réponses atypiques de la pression artérielle et de la fréquence cardiaque ont été signalées avec d'autres médicaments qui augmentent l'activité cholinergique lorsqu'ils sont co-administrés avec des anticholinergiques quaternaires tels que le glycopyrrolate. Les symptômes supplémentaires associés à une surdose de rivastigmine sont la diarrhée douleurs abdominales étourdissements pour les maux de tête du tremblement somnolence de l'état confusion hyperhidrose hypertension hallucinations et malaise. En raison de l'élimination du plasma court, la demi-vie de la rivastigmine après la dialyse de l'administration des patchs (dialyse péritonéale de l'hémodialyse ou hémofiltration) ne serait pas cliniquement indiquée en cas de surdose.
Dans une surdose accompagnée de nausées graves et de vomissements, l'utilisation d'antiémétiques doit être envisagée. Un résultat mortel a rarement été signalé avec une surdose de rivastigmine.
Contre-indications pour le patch exelon
Patch exélon is contraindicated in patients with:
- Hypersensibilité connue à la rivastigmine d'autres dérivés de carbamate ou autres composants de la formulation [voir DESCRIPTION ]
- Antécédents de réactions de sites applicables avec le patch transdermique de rivastigmine suggérant une dermatite de contact allergique [voir Avertissements et précautions ].
Des cas isolés de réactions cutanées généralisées ont été décrites dans l'expérience de la post-commercialisation [voir Effets indésirables ].
Pharmacologie clinique for Exélon Patch
Mécanisme d'action
Bien que le mécanisme d'action précis de la rivastigmine soit inconnu, on pense qu'il exerce son effet thérapeutique en améliorant la fonction cholinergique. Ceci est accompli en augmentant la concentration de l'acétylcholine par inhibition réversible de son hydrolyse par la cholinestérase. L'effet de la rivastigmine peut diminuer à mesure que le processus pathologique progresse et moins de neurones cholinergiques restent fonctionnellement intacts. Il n'y a aucune preuve que la rivastigmine modifie le cours du processus de dément sous-jacent.
Pharmacodynamique
Après une dose orale de 6 mg de rivastigmine chez l'homme, l'activité anticholinestérase est présente dans le liquide céphalo-rachidien pendant environ 10 heures avec une inhibition maximale d'environ 60% 5 heures après le dosage.
In vitro et en vain Des études démontrent que l'inhibition de la cholinestérase par la rivastigmine n'est pas affectée par l'administration concomitante d'antagoniste des récepteurs N-méthyl-D-aspartate Mémantine.
PharmacocinétiqueAbsorption
Après l'application initiale du patch exélon, il y a un temps de retard de 0,5 à 1 heure dans l'absorption de la rivastigmine. Les concentrations augmentent ensuite lentement en atteignant généralement un maximum après 8 heures, bien que des valeurs maximales (CMAX) puissent également se produire plus tard (à 10 à 16 heures). Après les concentrations plasmatiques maximales, diminuent lentement sur le reste de la période d'application 24 heures sur 24. À l'état d'équilibre, les niveaux de creux sont d'environ 60% à 80% des niveaux de pointe.
Patch exélon 9,5 mg / 24 heures gave exposure approximately the same as that provided by an oral dose of 6 mg deux fois par jour (i.e. 12 mg/day). Inter-subject variability in exposure was lower (43% to 49%) for the Patch exélon formulation as compared with the oral formulations (73% to 103%). Fluctuation (between Cmax et Cmin) is less for Patch exélon than for the oral formulation of rivastigmine.
La figure 2 affiche des concentrations plasmatiques de rivastigmine sur 24 heures pour les 3 forces de patch disponibles.
Figure 2: Concentrations plasmatiques de rivastigmine après application cutanée 24 heures sur 24
Plus d'une application cutanée 24 heures sur 24, environ 50% du contenu médicamenteux du correctif est libéré du système.
La zone d'exposition sous la courbe de concentration plasmatique du temps zéro à l'infini (Auc∞) à la rivastigmine (et au métabolite NAP226-90) était la plus élevée lorsque le patch a été appliqué sur la poitrine arrière supérieure ou le haut du bras. Deux autres sites (abdomen et cuisse) pourraient être utilisés si aucun des 3 autres sites n'est disponible, mais le praticien doit être conscient que l'exposition au plasma de rivastigmine associée à ces sites était d'environ 20% à 30% inférieure.
Il n’y avait aucune accumulation pertinente de rivastigmine ou le métabolite NAP226-90 dans le plasma chez les patients atteints de la maladie d’Alzheimer avec un dosage quotidien.
Le profil pharmacocinétique des patchs transdermiques de rivastigmine était comparable chez les patients atteints de la maladie d'Alzheimer et chez les patients atteints de démence associée à la maladie de Parkinson.
Distribution
La rivastigmine est faiblement liée aux protéines plasmatiques (environ 40%) sur la plage thérapeutique. Il traverse facilement la barrière hémato-encéphalique atteignant les concentrations de pic du CSF en 1,4 à 2,6 heures. Il a un volume apparent de distribution dans la plage de 1,8 à 2,7 L / kg.
Métabolisme
La rivastigmine est largement métabolisée principalement via une hydrolyse médiée par la cholinestérase à la métabolite décarbamylée NAP226-90. In vitro Ce métabolite montre une inhibition minimale de l'acétylcholinestérase (moins de 10%). En fonction des preuves de in vitro et animal studies the major cytochrome P450 isoenzymes are minimally involved in rivastigmine metabolism.
Le rapport AUC ∞ métabolite / parent était d'environ 0,7 après l'application de patch exélon contre 3,5 après l'administration orale, ce qui indique que beaucoup moins de métabolisme s'est produit après un traitement cutané. Moins de NAP226-90 est formé à la suite d'une application de correctifs vraisemblablement en raison du manque de métabolisme présystémique (premier passe hépatique). Basé sur in vitro Études qu'aucune voie métabolique unique n'a été détectée dans la peau humaine.
Élimination
L'excrétion rénale des métabolites est la principale voie d'élimination. La rivastigmine inchangée se trouve en quantité de traces dans l'urine. Après l'administration d'élimination rénale de 14C-rivastigmine a été rapide et essentiellement complète (supérieure à 90%) dans les 24 heures. Moins de 1% de la dose administrée est excrétée dans les excréments. La demi-vie apparente d'élimination dans le plasma est environ 3 heures après l'élimination du patch. La clairance rénale était d'environ 2,1 à 2,8 l / h.
Âge
Âge had no impact on the exposure to rivastigmine in Alzheimer’s disease patients treated with Patch exélon.
Genre et race
Aucune étude pharmacocinétique spécifique n'a été menée pour étudier l'effet du sexe et de la race sur la disposition du patch exélon. Une analyse pharmacocinétique de la population de la rivastigmine orale a indiqué que ni le sexe (n = 277 hommes et 348 femmes) ni la race (n = 575 caucasien 34 noir 4 asiatique et 12 autres) ont affecté la clairance du médicament. Des résultats similaires ont été observés avec des analyses des données pharmacocinétiques obtenues après l'administration de patch exélon.
Poids corporel
Une relation entre l'exposition au médicament à l'état stationnaire (rivastigmine et métabolite NAP226-90) et le poids corporel a été observée chez les patients atteints de démence d'Alzheimer. L'exposition aux rivastigmine est plus élevée chez les sujets avec un faible poids corporel. Comparé à un patient ayant un poids corporel de 65 kg, les concentrations à l'état d'équilibre rivastigmine chez un patient avec un poids corporel de 35 kg seraient approximativement doublées tandis qu'un patient avec un poids corporel de 100 kg, les concentrations seraient approximativement réduites [voir Posologie et administration ].
Trouble rénal
Aucune étude n'a été menée avec des patchs exélon chez des sujets souffrant de troubles rénaux. Sur la base de l'analyse de la population, la clairance de la créatinine n'a montré aucun effet clair sur les concentrations en régime permanent de rivastigmine ou de son métabolite.
Trouble hépatique
Aucune étude pharmacocinétique n'a été menée avec des patchs exélon chez des sujets souffrant de troubles hépatiques. Après une seule dose de 3 mg, la clairance orale moyenne de la rivastigmine était de 60% plus faible chez les patients atteints de souffrance hépatique (n = 10 biopsie prouvé) que chez les sujets sains (n = 10). Après plusieurs mg de 6 mg deux fois par jour, le dosage oral La clairance moyenne de la rivastigmine était 65% inférieure en score léger (n = 7 enfant-Pugh 5 à 6) et modéré (n = 3 score d'enfant-PUGH 7 à 9) des patients atteints de saine (voir la biopsie cirrhosis du foie) que chez les sujets sains (n = 10) [voir la biopsie Posologie et administration Utiliser dans des populations spécifiques ].
Fumeur
Après l'administration de rivastigmine orale (jusqu'à 12 mg / jour) avec une analyse pharmacocinétique de la population de nicotine a montré une clairance orale accrue de la rivastigmine de 23% (n = 75 fumeurs et 549 non-fumeurs).
Études d'interaction médicamenteuse
Aucune étude d'interaction spécifique n'a été menée avec Exelon Patch. Les informations présentées ci-dessous proviennent d'études avec une rivastigmine orale.
Effet de la rivastigmine sur le métabolisme d'autres médicaments
La rivastigmine est principalement métabolisée par hydrolyse par les estérases. Le métabolisme minimal se produit via les principales isoenzymes du cytochrome P450. Basé sur in vitro Études Aucune interaction pharmacocinétique des médicaments avec les médicaments métabolisés par les systèmes d'isoenzymes suivants est attendu: CYP1A2 CYP2D6 CYP3A4 / 5 CYP2E1 CYP2C9 CYP2C8 CYP2C19 ou CYP2B6.
Aucune interaction pharmacocinétique n'a été observée entre la rivastigmine prise par voie orale et la diazépam de la digoxine de digoxine ou la fluoxétine dans des études sur des volontaires sains. L'augmentation du temps de prothrombine induit par la warfarine n'est pas affectée par l'administration de rivastigmine.
Effet d'autres médicaments sur le métabolisme de la rivastigmine
Les médicaments qui induisent ou inhibent le métabolisme du CYP450 ne devraient pas modifier le métabolisme de la rivastigmine.
Population pharmacokinetic analysis with a database of 625 patients showed that the pharmacokinetics of rivastigmine taken orally were not influenced by commonly prescribed medications such as antacids (n = 77) antihypertensives (n = 72) beta-blockers (n = 42) calcium channel blockers (n = 75) antidiabetics (n = 21) nonsteroidal anti-inflammatory drugs (n = 79) œstrogènes (n = 70) analgésiques de salicylate (n = 177) antianginaux (n = 35) et antihistaminiques (n = 15).
Études cliniques
L'efficacité du patch exélon dans la démence du type d'Alzheimer et de la démence associée à la maladie de Parkinson était basée sur les résultats de 3 essais contrôlés de patch exélon chez les patients atteints de la maladie d'Alzheimer (études 1 2 et 3) (voir ci-dessous )); 3 essais contrôlés de rivastigmine orale chez les patients atteints de démence du type d'Alzheimer; et 1 essai contrôlé de rivastigmine orale chez les patients atteints de démence associée à la maladie de Parkinson. Voir les informations de prescription pour la rivastigmine orale pour plus de détails sur les quatre études de la rivastigmine orale.
Maladie d'Alzheimer légère à modérée
Étude internationale de 24 semaines du patch exélon dans la démence du type d'Alzheimer (étude 1)
Cette étude était une étude clinique factieuse en double aveugle randomisée chez les patients atteints de la maladie d'Alzheimer [diagnostiqué par l'examen de statut mini-mental NINCDS-ADRDA et DSM-IV (étude 1). L'âge moyen des patients participant à cet essai était de 74 ans avec une fourchette de 50 à 90 ans. Environ 67% des patients étaient des femmes et 33% étaient des hommes. La distribution raciale était en cas de dénigrement 75% noir 1% asiatique 9% et autres courses de 15%.
L'efficacité du patch Exelon a été évaluée dans l'étude 1 en utilisant une stratégie d'évaluation des résultats double évaluant les changements à la fois dans les performances cognitives et l'effet clinique global.
La capacité du patch exélon à améliorer les performances cognitives a été évaluée avec la sous-échelle cognitive de l'échelle d'évaluation de la maladie d'Alzheimer (ADAS-COG) Un instrument multi-éléments qui a été largement validé dans les cohortes longitudinales des patients atteints d'Alzheimer. L'ADAS-COG examine les aspects sélectionnés des performances cognitives, y compris les éléments de l'attention de l'orientation de la mémoire, le langage et la praxis. La plage de notation ADAS-COG est de 0 à 70 avec des scores plus élevés indiquant une plus grande déficience cognitive. Les adultes normaux âgés peuvent marquer aussi bas que 0 ou 1, mais il n'est pas inhabituel pour les adultes non démentes de marquer légèrement plus.
La capacité du patch exélon à produire un effet clinique global a été évaluée à l'aide de l'étude coopérative de la maladie d'Alzheimer, une impression globale mondiale de changement (ADCS-CGIC). L'ADCS-CGIC est une forme plus standardisée de l'impression basée sur les entretiens du clinicien de changement-plus (CIBIC-plus) et est également notée comme une note catégorique à 7 points; Les scores vont de 1 indiquant nettement amélioré à 4, ce qui indique aucun changement à 7 indiquant une aggravation marquée.
Dans l'étude 1 1195, les patients ont été randomisés à 1 des 4 traitements suivants: Patch exélon 9,5 mg / 24 heures Patch exélon 17,4 mg / 24 heures capsules d'exélon dans une dose de 6 mg deux fois par jour ou un placebo. Cette étude de 24 semaines a été divisée en une phase de titration de 16 semaines, suivie d'une phase de maintenance de 8 semaines. Dans le traitement actif, les bras de cette étude des doses inférieurs à la dose cible ont été autorisés pendant la phase d'entretien en cas de mauvaise tolérabilité.
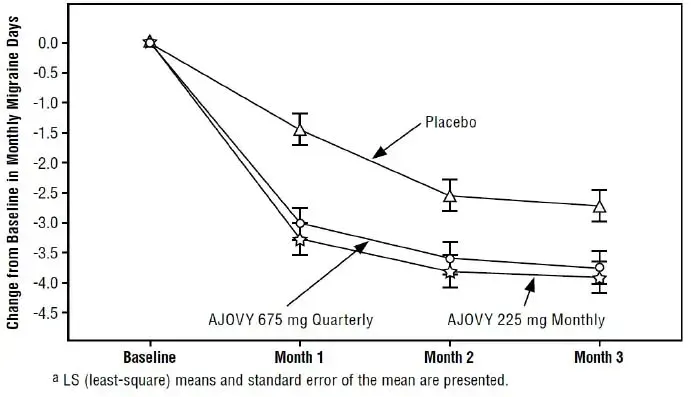
La figure 3 illustre l'évolution du temps pour le changement par rapport à la ligne de base dans les scores ADAS-COG pour les 4 groupes de traitement au cours de l'étude de 24 semaines. À 24 semaines, les différences moyennes dans les scores de changement ADAS-COG pour les patients traités par exélon par rapport aux patients sur placebo étaient de 1,8 2,9 et 1,8 unités pour le patch exélon 9,5 mg / 24 heures Patch exélon 17,4 mg / 24 heures et les groupes de capsule exélon 6 mg deux fois par jour des groupes par jour. La différence entre chacun de ces groupes et le placebo était statistiquement significative. Bien qu'une légère amélioration ait été observée avec le patch de 17,4 mg / 24 heures par rapport au patch de 9,5 mg / 24 heures sur cette mesure de résultat, aucune différence significative entre les deux n'a été observée lors de l'évaluation globale (voir Figure 4 ).
Figure 3: Évolution dans le temps du changement par rapport à la ligne de base dans le score ADAS-COG pour les patients observés à chaque instant dans l'étude 1
Figure 4 presents the distribution of patients’ scores on the ADCS-CGIC for all 4 treatment groups. At 24 weeks the mean difference in the ADCS-CGIC scores for the comparison of patients in each of the Exélon-treated groups with the patients on placebo was 0.2 units. The difference between each of these groups et placebo was statistically significant.
Figure 4: Distribution of ADCS-CGIC Scores for Patients Completing Study 1
Étude internationale de 48 semaines du patch exélon dans la démence du type d'Alzheimer (étude 2)
Cette étude était une étude clinique en double aveugle randomisée chez les patients atteints de la maladie d'Alzheimer [diagnostiqués par le score de l'examen de l'État mini-mental NINCDS-ADRDA et DSM-IV supérieur ou égal à 10 et moins ou égal à 24] (étude 2). L'âge moyen des patients participant à cet essai était de 76 ans avec une fourchette de 50 à 85 ans. Environ 65% des patients étaient des femmes et 35% étaient des hommes. La distribution raciale était approximativement du Caucasien à 97% noir 2% asiatique 0,5% et d'autres races 1%. Environ 27% des patients prenaient de la mémantine pendant toute la durée de l'étude.
Les patients atteints de la maladie d'Alzheimer qui ont reçu 24 à 48 semaines de traitement ouvert avec un patch exélon 9,5 mg / 24 et qui ont démontré un déclin fonctionnel et cognitif ont été randomisés en traitement avec un patch exélon 9,5 mg / 24 heures ou une phase de traitement exélon 13,3 mg / 24 heures dans une phase de traitement à double coup de 48 semaines. Le déclin fonctionnel a été évalué par l'investigateur et le déclin cognitif a été défini comme une diminution du score MMSE de plus ou égal à 2 points de la visite précédente ou une diminution de plus ou égale à 3 points de la ligne de base.
L'étude 2 a été conçue pour comparer l'efficacité du patch exélon 13,3 mg / 24 heures par rapport à celui du patch exélon 9,5 mg / 24 heures pendant la phase de traitement en double aveugle de 48 semaines.
La capacité du patch exélon 13,3 mg / 24 heures à améliorer les performances cognitives par rapport à celle fournie par le patch exélon 9,5 mg / 24 a été évaluée par la sous-échelle cognitive de l'échelle d'évaluation de la maladie d'Alzheimer (ADAS-COG) [voir Études cliniques ].
La capacité du patch exélon 13,3 mg / 24 heures à améliorer la fonction globale par rapport à celle fournie par le patch exélon 9,5 mg / 24 heures a été évaluée par la sous-échelle instrumentale de la maladie de la maladie d'Alzheimer des activités d'étude coopérative de la vie quotidienne (ADCS-IADL). La sous-échelle ADCS-IADL est composée d'articles 7 à 23 de l'échelle ADCS-ADL basée sur les soignants. L'ADCS-IADL évalue des activités telles que celles nécessaires pour communiquer et interagir avec d'autres personnes qui entretiennent un ménage et menant des passe-temps et des intérêts. Un score de somme est calculé en ajoutant les scores des éléments individuels et peut aller de 0 à 56 avec des scores plus élevés indiquant moins de troubles.
Sur un total de 1584 patients inscrits à la phase ouverte initiale de l'étude, 567 patients ont été classés comme déclin et ont été randomisés dans la phase de traitement en double aveugle de 48 semaines de l'étude. Deux cent quatre-vingt-sept (287) patients sont entrés dans le groupe de patchs exélon de 9,5 mg / 24 heures et 280 patients sont entrés dans le groupe de patchs exélon de 133,3 mg / 24 heures.
La figure 5 illustre l'évolution temporelle du changement moyen par rapport à la ligne de base en double aveugle dans les scores ADCS-IADL pour chaque groupe de traitement au cours de la phase de traitement de 48 semaines de l'étude. La baisse du score ADCSIADL moyen de la ligne de base en double aveugle pour l'intention de traiter l'observation-allonge reportée (ITT-LOCF) était moindre à chaque point de cale du groupe de patchs exélon de 13,3 mg / 24 heures que dans le groupe de traitements de patch exélon de 9,5 mg / 24 heures. La dose de 13,3 mg / 24 heures était statistiquement significativement supérieure à la dose de 9,5 mg / 24 heures aux semaines 16 24 32 et 48 (critère d'évaluation primaire).
La figure 6 illustre l'évolution temporelle du changement moyen par rapport à la ligne de base en double aveugle dans les scores ADAS-COG pour les deux groupes de traitement au cours de la phase de traitement de 48 semaines. La différence entre le groupe entre les traitements pour le patch exélon 13,3 mg / 24 heures par rapport au patch exélon 9,5 mg / 24 heures était nominalement significatif statistiquement à la semaine 24 (p = 0,027) mais pas à la semaine 48 (p = 0,227) qui était le principal critère d'évaluation.
Figure 5: Évolution dans le temps du changement par rapport à la base de référence en double aveugle dans le score ADCS-IADL pour les patients observés à chaque instant de l'étude 2
| X: P<0.05 for Exélon Patch 13.3 mg/24hr vs. 9.5 mg/24hr |
Figure 6: Évolution dans le temps du changement par rapport à la ligne de base en double aveugle dans le score ADAS-COG pour les patients observés à chaque instant de l'étude 2
| X: P<0.05 for Exélon Patch 13.3 mg/24hrvs. 9.5 mg/ 24hr Weeks of treatment |
Maladie d'Alzheimer sévère
Étude des États-Unis de 24 semaines avec un patch exélon dans la maladie d'Alzheimer sévère (étude 3)
Il s'agissait d'une étude clinique en double aveugle randomisée de 24 semaines chez les patients atteints de la maladie d'Alzheimer sévère [diagnostiquée par le score de l'examen de l'État mini-mental NINDDS-ADRDA et DSM-IV supérieur à 3 et moins ou égal à 12]. L'âge moyen des patients participant à cet essai était de 78 ans avec une fourchette de 51 à 96 ans avec 62% de plus de 75 ans. Environ 65% des patients étaient des femmes et 35% étaient des hommes. La distribution raciale était approximativement caucasienne 87% noir 7% asiatique 1% et autres courses 5%. Les patients avec une dose stable de mémantine ont été autorisés à entrer dans l'étude. Environ 61% des patients de chaque groupe de traitement prenaient une mémantine pendant toute la durée de l'étude.
Effets secondaires communs de la crème Estrace
L'étude a été conçue pour comparer l'efficacité du patch exélon 13,3 mg / 24 heures par rapport à celui du patch exélon 4,6 mg / 24 heures pendant la phase de traitement en double aveugle de 24 semaines.
La capacité du patch exélon de 13,3 mg / 24 heures à améliorer les performances cognitives par rapport à celles fournies par le patch exélon de 4,6 mg / 24 heures a été évaluée avec la batterie sévère de déficience (SIB) qui utilise une échelle validée de 40 éléments développée pour l'évaluation de la gravité de la dysfonction cognitive chez les patients ADA plus avancés. Les domaines évalués comprenaient l'interaction sociale Langage du langage Orientation de l'attention Praxis Construction des capacités visuospatiales et orientation vers le nom. La SIB a été notée de 0 à 100 avec des scores plus élevés reflétant des niveaux plus élevés de capacité cognitive.
La capacité du patch exélon de 13,3 mg / 24 heures à améliorer la fonction globale par rapport à celle fournie par le patch exélon de 4,6 mg / 24 heures a été évaluée avec la maladie de l'étude coopérative de la maladie d'Alzheimer de la version quotidienne de la vie de la vie (ADCS-ADL-SIV) qui est une échelle ADL basée sur les soins, composée de 19 éléments développés dans les études cliniques de dissex. Il est conçu pour évaluer les performances du patient des activités de base et instrumentales de la vie quotidienne telles que celles nécessaires aux soins personnels communiquant et interagissant avec d'autres personnes qui entretiennent un ménage conduisant des passe-temps et des intérêts et en faisant des jugements et des décisions. Un score de somme est calculé en ajoutant les scores des éléments individuels et peut varier de 0 à 54 avec des scores plus élevés indiquant une déficience moins fonctionnelle. Dans cette étude, 716 patients ont été randomisés dans l'un des traitements suivants: Patch Exelon 13,3 mg / 24 heures ou patch exélon 4,6 mg / 24 heures dans un rapport 1: 1. Cette étude de 24 semaines a été divisée en une phase de titration de 8 semaines suivie d'une phase de maintenance de 16 semaines. Dans le traitement actif, les bras de cette étude, les ajustements de dose temporaire en dessous de la dose cible ont été autorisés pendant la phase de titrage et d'entretien en cas de mauvaise tolérabilité.
La figure 7 illustre l'évolution temporelle du changement moyen par rapport aux scores de base de SiB pour chaque groupe de traitement au cours de la phase de traitement de 24 semaines de l'étude. La baisse du score SIB moyen à partir de la ligne de base pour l'analyse de l'observation complète de l'analyse complète modifiée (MFAS) reportée (LOCF) était moindre à chaque point de calendrier dans le groupe de patch de patch de patch de 13,3 mg / 24 heures que dans le groupe de patch de patch de 4,6 mg / 24 heures. La dose de 13,3 mg / 24 heures était statistiquement significativement supérieure à la dose de 4,6 mg / 24 heures aux semaines 16 et 24 (critère d'évaluation primaire).
La figure 8 illustre l'évolution temporelle du changement moyen par rapport à la ligne de base dans les scores ADCS-ADL-SIV pour chaque groupe de traitement au cours de la phase de traitement de 24 semaines de l'étude. La baisse du score ADCS-ADLSIV moyen de la ligne de base pour l'analyse MFAS-LOCF était moindre à chaque point de cale du groupe de 13,3 mg / 24 heures de patch de patch de traitement que dans le groupe de traitements de patch Exelon de 4,6 mg / 24 heures. La dose de 13,3 mg / 24 heures était statistiquement significativement supérieure à la dose de 4,6 mg / 24 heures aux semaines 16 et 24 (critère d'évaluation primaire).
Figure 7: Évolution dans le temps du changement par rapport à la ligne de base dans le score SIB pour les patients observés à chaque instant (analyse complète modifiée set-locf)
| Les moyens des moindres carrés (moyennes LS) et les erreurs standard des moyennes LS (STE) sont basées sur une analyse du modèle de covariance ajusté pour le centre groupé et la ligne de base • indiquant une signification statistique à un niveau de 0,05 |
Figure 8: Évolution dans le temps du changement par rapport à la ligne de base dans le score ADCS-ADL-SIV pour les patients observés à chaque point dans le temps (ensemble d'analyse complète modifiée - LOCF)
| Les moyennes des moindres carrés (moyennes LS) et les erreurs standard des moyennes LS (STE) sont basées sur une analyse du modèle de covariance ajusté pour le centre et la ligne de base regroupés. * indiquant une signification statistique à un niveau de 0,05 |
Informations sur le patient pour le patch Exelon
Exélon® CORRECTIF
(ECS-El-on)
(Système transdermique Rivastigmine)
Quelles sont les informations les plus importantes que je devrais connaître sur Exelon Patch?
Patch exélon is for skin use only.
Qu'est-ce que le patch Exelon?
Patch exélon is a prescription medicine used to treat:
- Des problèmes de mémoire modérés et graves (démence) associés à la maladie d'Alzheimer.
- Problèmes de mémoire légers à modérés (démence) associés à la maladie de Parkinson (PD).
Sur la base des essais cliniques menés sur 6 à 12 mois, un patch Exelon a été montré pour aider à la cognition qui comprend (compréhension de la mémoire et le raisonnement) et à effectuer des tâches quotidiennes. Exelon Patch ne fonctionne pas de la même manière chez tout le monde. Certaines personnes traitées avec Exelon Patch peuvent:
- Sembler bien meilleur
- S'améliorez de petites manières ou restez le même
- Empirer mais plus lent que prévu
- Ne pas changer et ensuite empirer comme prévu
Certains patients ne bénéficieront pas d'un traitement avec un patch exélon. Le patch Exelon ne guérit pas la maladie d'Alzheimer. Tous les patients atteints de la maladie d'Alzheimer empirent avec le temps.
Patch exélon comes as a transdermal system that delivers rivastigmine (the medicine in Patch exélon) through the skin.
On ne sait pas si le patch Exelon est sûr ou efficace chez les enfants de moins de 18 ans.
Qui ne devrait pas utiliser Patch Exelon?
N'utilisez pas le patch Exelon si vous:
- sont allergiques aux dérivés de carbamate de rivastigmine ou à l'un des ingrédients du patch exélon. Voir la fin de cette brochure pour une liste complète des ingrédients dans le patch Exelon.
- ont eu une réaction cutanée qui:
- répartir au-delà de la taille du patch exélon
- des cloques ont augmenté les rougeurs ou l'enflure de la peau
- ne s'est pas amélioré dans les 48 heures après avoir supprimé le patch Exelon
Demandez à votre fournisseur de soins de santé si vous ne savez pas si vous devez utiliser Exelon Patch.
Que dois-je dire à mon fournisseur de soins de santé avant d'utiliser Exelon Patch?
Avant d'utiliser Exelon Patch, dites à votre fournisseur de soins de santé si vous:
- ont ou ont eu un ulcère d'estomac
- envisagent de subir une intervention chirurgicale
- ont ou ont eu des problèmes avec votre cœur
- avoir des problèmes de passage de l'urine
- ont ou ont eu des crises
- avoir des problèmes de mouvement (tremblements)
- avoir des problèmes d'asthme ou de respiration
- avoir une perte d'appétit ou perdre du poids
- ont eu une réaction cutanée à la rivastigmine (le médicament en patch exélon) dans le passé
- avoir d'autres conditions médicales
- sont enceintes ou prévoient de devenir enceintes. On ne sait pas si le médicament en patch Exelon nuira à votre bébé à naître. Parlez à votre fournisseur de soins de santé si vous êtes enceinte ou prévoyez de devenir enceinte.
- allaitent ou prévoient d'allaiter. On ne sait pas si le médicament en patch exélon passe dans votre lait maternel. Parlez à votre médecin de la meilleure façon de nourrir votre bébé si vous prenez des patchs exélon.
Parlez à votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris des vitamines et des suppléments à base de plantes sur ordonnance et en vente libre.
Parlez surtout de votre fournisseur de soins de santé si vous prenez:
- Un médicament utilisé pour traiter l'inflammation [anti-inflammatoires non stéroïdiens (AINS)]
- D'autres médicaments utilisés pour traiter la maladie d'Alzheimer ou de la maladie de Parkinson
- Un médicament anticholinergique tel qu'une allergie ou un médicament contre le rhume un médicament pour traiter les spasmes de la vessie ou de l'intestin ou certains médicaments contre l'asthme ou certains médicaments pour empêcher le mouvement ou le mal des déplacements
- Métoclopramide Un médicament donné pour soulager les symptômes de la maladie du reflux gastro-œsophagien (RGO) ou des nausées et vomissements après une chirurgie ou un traitement de chimiothérapie
- Si vous subissez une intervention chirurgicale pendant que vous utilisez Exelon Patch, informez votre médecin, car le patch Exelon peut exagérer les effets de l'anesthésie ou les effets d'un bêta-bloquant un type de médicament donné pour une maladie cardiaque à haute pression artérielle et d'autres conditions médicales
Demandez à votre fournisseur de soins de santé si vous ne savez pas si votre médicament est répertorié ci-dessus.
Connaissez les médicaments que vous prenez. Gardez une liste d'entre eux à montrer à votre fournisseur de soins de santé et à votre pharmacien lorsque vous obtenez un nouveau médicament.
Comment dois-je utiliser Exelon Patch?
- Utilisez Exelon Patch exactement car votre fournisseur de soins de santé vous dit de l'utiliser.
- Patch exélon comes in 3 different dosage strengths.
- Votre fournisseur de soins de santé peut changer votre dose au besoin.
- Portez seulement 1 patch Exelon à la fois.
- Exélon Patch is for skin use only.
- Appliquez uniquement un patch exélon sur une peau saine qui est propre à sec et exempte de rougeur, des brûlures ou des coupes.
- Évitez d'appliquer un patch exélon sur des zones de votre corps qui seront frottées contre les vêtements serrés.
- N'appliquez pas de patch exélon sur la peau qui contient de la lotion à la crème ou de la poudre.
- Changez votre patch Exelon toutes les 24 heures au même moment de la journée. Vous pouvez écrire la date et l'heure que vous mettez sur le patch Exelon avec un stylo à bille avant d'appliquer le patch pour vous aider à vous rappeler quand le retirer.
- Modifiez votre site d'application tous les jours pour éviter l'irritation cutanée. Vous pouvez utiliser la même zone mais n'utilisez pas exactement le même endroit pendant au moins 14 jours après votre dernière application.
- Vérifiez si le patch Exelon est devenu lâche lorsque vous baignez la natation ou la douche.
- Patch exélon is designed to deliver medication during the time it is worn. If your Patch exélon falls off before its usual replacement time put on a new Patch exélon right away. Replace the new patch the next day at the same time as usual. Do not use overlays betages or tape to secure an Patch exélon that has become loose or try to reapply an Patch exélon that has fallen off.
- Si vous manquez une dose ou oubliez de modifier votre patch Exelon, appliquez votre prochain correctif Exelon dès que vous vous en souvenez. N'appliquez pas 2 correctifs d'exélon pour compenser la dose manquée.
- Si vous manquez plus de 3 doses d'application de Patch Exelon, appelez votre fournisseur de soins de santé avant de mettre un nouveau patch Exelon. Vous devrez peut-être redémarrer le patch Exelon à une dose inférieure.
- Retirez toujours l'ancien patch Exelon de la veille avant d'en appliquer un nouveau.
- Avoir plus d'un patch exélon sur votre corps en même temps peut vous faire obtenir trop de médicaments. Si vous utilisez accidentellement plus d'un patch Exelon à la fois, appelez immédiatement votre fournisseur de soins de santé. Si vous n'êtes pas en mesure de rejoindre votre fournisseur de soins de santé, appelez votre centre de contrôle du poison local au 1-800-222-1222 ou allez immédiatement à la salle d'urgence de l'hôpital le plus proche.
Que dois-je éviter lors de l'utilisation du patch Exelon?
- Ne touchez pas vos yeux après avoir touché le patch Exelon. En cas de contact accidentel avec vos yeux ou si vos yeux deviennent rouges après avoir manipulé le patch rincer immédiatement avec beaucoup d'eau et consultez un médecin si les symptômes ne se résolvent pas.
- Patch exélon can cause somnolence vertiges weakness or évanouissement. Do not drive operate heavy machinery or do other dangerous activities until you know how Patch exélon affects you.
- Évitez l'exposition à des sources de chaleur telles que les saunas de soleil excessives ou les vérandas pendant de longues périodes.
Quels sont les effets secondaires possibles du patch Exelon?
Patch exélon may cause serious side effects including:
- Overdose de médicaments. L'hospitalisation et rarement la mort peuvent se produire lorsque les gens portent accidentellement plus d'un patch en même temps. Il est important que l'ancien patch Exelon soit supprimé avant d'appliquer un nouveau. Ne portez pas plus de 1 patch Exelon à la fois.
- Problèmes d'estomac ou d'intestin (intestinal), notamment:
- nausée
- vomissement
- diarrhée
- déshydratation
- perte d'appétit
- perte de poids
- saignement dans votre estomac (ulcères)
- Réactions cutanées. Certaines personnes ont eu une réaction de peau grave appelée dermatite de contact allergique (ACD) lors de l'utilisation du patch exélon. Arrêtez d'utiliser un patch Exelon et appelez votre fournisseur de soins de santé immédiatement si vous ressentez des réactions qui se propagent au-delà de la taille du patch sont de nature intense et ne s'améliorent pas dans les 48 heures suivant la suppression du patch. Les symptômes de l'ACD peuvent être intenses et inclure:
- démangeaisons rougeur la chaleur ou la sensibilité de la peau
- peeling ou cloques de la peau qui peut suinter un égout ou une croûte
- Problèmes cardiaques
- Crises
- Problèmes de mouvement (tremblements)
Les effets secondaires les plus courants du patch exélon comprennent:
- dépression
- mal de tête
- anxiété
- vertiges
- douleurs à l'estomac
- infections des voies urinaires
- faiblesse musculaire
- fatigue
- Difficulté à dormir
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles du patch exélon. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou à votre pharmacien.
Appelez votre médecin pour des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je stocker des patchs Exelon?
- Stockez un patch exélon entre 68 ° F à 77 ° F (20 ° C à 25 ° C).
- Gardez le patch Exelon dans la pochette scellée jusqu'à ce qu'elle soit prête à l'emploi.
Gardez le patch Exelon et tous les médicaments hors de portée des enfants.
Informations générales sur l'utilisation sûre et efficace du patch exelon.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans la brochure d'information du patient. N'utilisez pas le patch Exelon pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas de patch exélon à d'autres personnes même s'ils présentent les mêmes symptômes que vous. Cela peut leur faire du mal. Ce dépliant d'information du patient résume les informations les plus importantes sur le patch Exelon. Si vous souhaitez plus d'informations, parlez avec votre fournisseur de soins de santé. Vous pouvez demander à votre pharmacien ou fournisseur de soins de santé pour des informations sur Exelon Patch qui est écrit pour les professionnels de la santé.
Pour plus d'informations, rendez-vous sur www.exelonpatch.com ou appelez le 1-888-669-6682.
Quels sont les ingrédients du patch Exelon?
Ingrédient actif: rivastigmine
Les excipients comprennent: Copolymère acrylique poly (butylméthacrylate méthylméthacrylate) Adhésif en silicone appliqué à un film de sauvetage en polymère flexible huile de silicone et vitamine E.
Instructions pour une utilisation
Exélon®
(ECS-€ ˜el-on) Patch (système transdermique Rivastigmine)
Vous aurez besoin des fournitures suivantes (voir la figure A):
Patch exélon is supplied in cartons containing 30 patches (See Figure A)
Figure A
- Patch exélon is a thin beige plastic patch that sticks to the skin. Each Patch exélon is sealed in a pouch that protects it until you are ready to put it on (See Figure A).
- Un seul patch Exelon doit être porté à la fois. N'appliquez pas plus d'un patch exélon à la fois au corps.
- N'ouvrez pas la pochette et ne retirez pas le patch Exelon jusqu'à ce que vous soyez prêt à l'appliquer.
Utilisation du patch Exelon:
Étape 1. Choisissez une zone pour appliquer le patch Exelon (voir la figure B).
- Instructions pour les soignants: Appliquez un patch exélon sur le haut ou le bas du dos s'il est probable que le patient le retire. Si ce n'est pas une préoccupation, le patch exélon peut être appliqué à la place sur le haut du bras ou de la poitrine. N'appliquez pas le patch exélon sur les zones où il peut être déteint par des vêtements serrés ou des ceintures.
- Appliquez uniquement le patch exélon sur une peau saine qui est propre à sec et sans rougeur, des brûlures ou des coupes.
Figure B
Le diagramme représente des zones sur le corps où le patch exélon peut être appliqué. Un seul patch doit être porté à la fois. N'appliquez pas plusieurs patchs sur le corps.
Étape 2. Retirez le patch Exelon de la poche (voir figure C).
Coupez soigneusement la poche le long de la ligne pointillée pour ouvrir et retirer le patch Exelon. Enregistrez la pochette pour une utilisation ultérieure.
Figure C
- Ne coupez ni ne pliez le patch exélon lui-même.
Étape 3. Retirez 1 côté de la doublure adhésive (voir figure D).
- Une doublure protectrice couvre le côté collant (adhésif) du patch exélon. Décoller 1 côté du couvercle de protection. Ne touchez pas la partie collante du patch Exelon avec vos doigts.
Figure D
Étape 4. Appliquez le patch exélon sur votre peau (voir figure E).
- Appliquez le côté collant (adhésif) du patch exélon sur la zone de peau choisie, puis décollez de l'autre côté de la couverture de protection.
Figure E
- Appuyez fermement sur le patch Exelon pendant 30 secondes pour vous assurer que les bords collent à votre peau (voir figure F).
Figure F
Étape 5: Lavez-vous immédiatement les mains avec du savon et de l'eau.
Note:
- Si votre patch Exelon tombe, sélectionnez une nouvelle zone et répétez les étapes 2 à 5 pour appliquer un nouveau patch Exelon.
- Assurez-vous de remplacer le nouveau patch Exelon le lendemain en même temps que d'habitude.
Suppression de votre patch Exelon:
Étape 6. Retirez le patch exélon de la peau (voir figure G).
- Tirez doucement sur 1 bord du patch Exelon pour le retirer de votre peau.
Figure G
Jetant le patch Exelon utilisé:
Étape 7. Jetez le patch exélon utilisé (voir figure H).
- Pliez le patch exélon utilisé en deux (avec les côtés collants ensemble) et remettez-le dans la pochette que vous avez enregistrée.
Figure H
- Jetez le patch exélon d'occasion en toute sécurité et hors de la portée des enfants et des animaux de compagnie.
- Certains médicaments restent dans le patch pendant 24 heures après l'avoir utilisé et doivent être pliés ensemble (côté collant ensemble) et jeté en toute sécurité. N'essayez pas de réutiliser les correctifs d'exélon.
Étape 8: Lavez-vous immédiatement les mains avec du savon et de l'eau.
- Après avoir retiré le patch exélon si un adhésif reste sur votre peau, vous pouvez utiliser du savon et de l'eau ou une substance à base d'huile (comme l'huile pour bébé) pour éliminer l'adhésif. L'alcool ou d'autres liquides de dissolution (comme le dissolvant du vernis à ongles) ne doivent pas être utilisés.
Ces instructions d'utilisation ont été approuvées par la Food and Drug Administration des États-Unis.