Combipatch
Les Informations Présentées Sur Ce Site Ne Constituent Pas Un Avis Médical. Nous Ne Vendons Rien. L'Exactitude De La Traduction N'Est Pas Garantie. Clause De Non-Responsabilité
Résumé
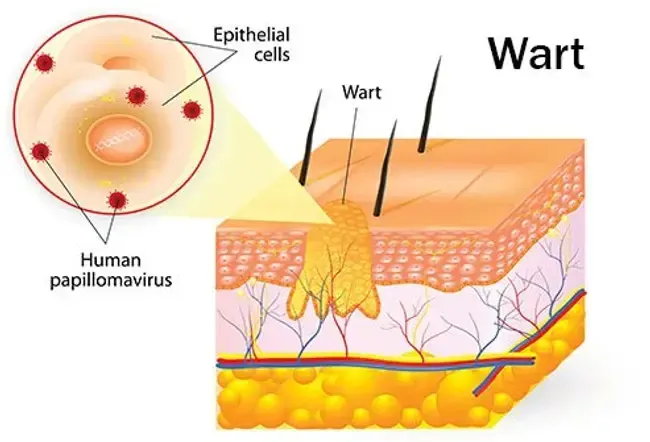
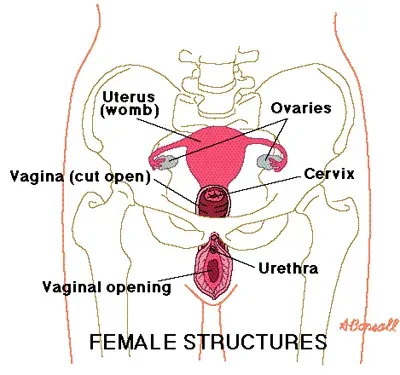
Qu'est-ce que combipatch?
Le combipatch (système transdermique d'estradiol norethindrone acétate) est une combinaison d'hormones féminines utilisées pour traiter les symptômes de ménopause comme des sentiments de chaleur dans le cou et la poitrine ou des sorts soudains de chaleur et de transpiration ('' bouffées de chaleur «ou« rinçages chauds »); pour traiter les changements vulvaires et vaginaux (démangeaisons brûlant la sécheresse dans ou autour vagin difficulté ou brûler avec une miction) causée par la ménopause; et pour remplacer les œstrogènes dans des conditions telles que l'élimination de l'hypogonadisme des ovaires ou une insuffisance ovarienne primaire qui entraînent un manque d'oestrogène.
Quels sont les effets secondaires de combipatch?
Les effets secondaires courants de la combipatch comprennent:
- Redness / irritation / éruption cutanée sur le site d'application
- douleurs abdominales
- nausée
- vomissement
- ballonnements
- sensibilité ou élargissement des seins
- faiblesse
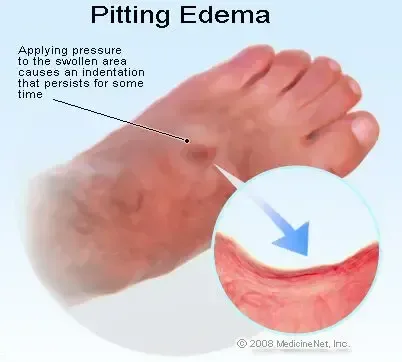
- gonflement des mains ou des pieds
- Abussant tacheté de la peau (en particulier sur le visage)
- difficulté à porter des lentilles de contact
- vaginl irritation ou discomfout
- changements dans le cycle menstruel
- menstruations douloureuses
- saignement révolutionnaire
- Maux de tête ou
- changements de poids.
Dites à votre médecin si vous avez des effets secondaires graves de combipatch, notamment:
- changements mentaux / d'humeur (comme la perte de mémoire de dépression)
- bosses
- augmentation ou nouvelle démangeaison vaginale / odeur / débit
- Douleurs abdominales sévères ou abdominales
- nausées ou vomissements persistants
- les yeux ou la peau jaunissent
- urine sombre
- les mains / chevilles gonflées ou
- accrue soif ou miction.
Le combipatch peut provoquer des effets secondaires graves, notamment:
- urticaire
- difficulté à respirer
- gonflement de ton visage lèvres langue ou gorge
- douleur à la poitrine ou pression
- Douleur se propageant à votre mâchoire ou à votre épaule
- nausée
- transpiration
- maux de tête sévères
- vision floue
- battant dans votre cou ou vos oreilles
- anxiété
- saignement de nez
- Engourdissement soudain ou faiblesse (surtout d'un côté du corps)
- Maux de tête soudains graves
- discours
- Problèmes de vision ou d'équilibre
- perte de vision soudaine
- Douleur thoracique poignardée
- essoufflement
- cracher du sang
- douleur ou chaleur dans une ou les deux jambes
- gonflement ou sensibilité dans votre estomac
- jaunissement de la peau ou des yeux (jaunisse)
- saignement vaginal inhabituel
- douleur pelvienne
- bosse de sein
- problèmes de mémoire
- confusion
- comportement inhabituel
- vomissement
- constipation
- accrue soif ou miction
- faiblesse musculaire
- douleur osseuse et
- manque d'énergie
Obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus.
Cherchez des soins médicaux ou appelez le 911 à la fois si vous avez les effets secondaires graves suivants:
- Des symptômes oculaires graves tels que la perte de vision soudaine floue du tunnel de vision de la vision de la vision des yeux ou de l'enflure ou de voir des halos autour des lumières;
- Symptômes cardiaques graves tels que les battements cardiaques rapides ou battants; flotter dans votre poitrine; essoufflement; et des étourdissements soudains, de la légèreté ou de l'évanouissement;
- Maux de tête sévères Confusion Slurred Speech Bras ou Ligne Proulitude Trouble de la merde Perte de coordination Sentiment des muscles très rigides très rigides Fièvre élevée Propice ou des tremblements.
Ce document ne contient pas tous les effets secondaires possibles et d'autres peuvent survenir. Vérifiez auprès de votre médecin des informations supplémentaires sur les effets secondaires.
Dosage pour combipatch
Deux systèmes de livraison transdermiques de combipatch sont disponibles: 0,05 mg d'estradiol avec 0,14 mg de NetA par jour (9 cm) et 0,05 mg d'estradiol avec 0,25 mg de NetA par jour (16 carrés). La dose efficace la plus faible doit être utilisée.
Quelles substances ou suppléments de médicaments interagissent avec combipatch?
Le combipatch peut interagir avec les anticoagulants (anticoagulants). Dites à votre médecin tous les médicaments que vous utilisez.
Combipatch pendant la grossesse et l'allaitement
Le combipatch ne doit pas être utilisé pendant la grossesse. Si vous tombez enceinte ou pensez que vous pourriez être enceinte, dites à votre médecin. Ce médicament passe dans le lait maternel. Il peut réduire la qualité et la quantité de lait maternel produit. Consultez votre médecin avant l'allaitement.
Informations Complémentaires
Notre combipatch (système d'estradiol norethindrone acétate Système transdermique) Effets secondaires Drug Drug fournit une vue complète des informations de médicament disponibles sur les effets secondaires potentiels lors de la prise de ce médicament.
Informations sur les médicaments de la FDA
- Description de la drogue
- Indications
- Effets secondaires
- Interactions médicamenteuses
- Avertissements
- Précautions
- Surdosage
- Pharmacologie clinique
- Guide des médicaments
AVERTISSEMENT
Troubles cardiovasculaires du cancer du sein cancer de l'endomètre et démence probable
Thérapie progestative œstrogène plus
Troubles cardiovasculaires et démence probable
Le traitement progestatif œstrogène plus ne doit pas être utilisé pour la prévention des maladies cardiovasculaires ou de la démence. (Voir Études cliniques et AVERTISSEMENTS Troubles cardiovasculaires et démence probable).
L'Initiative de santé des femmes (WI) œstrogènes plus la sous-étude progestative a signalé un risque accru d'embolie pulmonaire (PE) et d'infarctus du myocarde (MI) chez les femmes postménopausées (50 à 79 ans) pendant 5,6 ans de traitement par des œstrères oraux quotidiens (CE) [0,625 MG] combiné avec des œstrères médroxy-arrogènes (CE). acétate (MPa) [2,5 mg] par rapport au placebo. (Voir Études cliniques et AVERTISSEMENTS Troubles cardiovasculaires).
L'étude de la mémoire WI (POURMES) ESTROGEN plus une étude acquise progestative du WHI a rapporté un risque accru de développer une démence probable chez les femmes ménopausées de 65 ans ou plus pendant 4 ans de traitement avec un CE quotidien (0,625 mg) combiné avec du MPA (2,5 mg) par rapport au placement du placebo. On ne sait pas si cette constatation s'applique aux jeunes femmes ménopausées. (Voir Études cliniques et AVERTISSEMENTS Démence probable et PRÉCAUTIONS Utilisation gériatrique).
Cancer du sein
La sous-étude progestative Whi œstrogène plus a démontré un risque accru de cancer du sein invasif. (Voir Études cliniques et AVERTISSEMENTS Néoplasmes malins cancer du sein).
En l'absence de données comparables, ces risques doivent être supposés être similaires pour d'autres doses de CE et de MPA et d'autres combinaisons et des formes posologiques d'œstrogènes et de progestations.
Les œstrogènes avec ou sans progestatifs doivent être prescrits aux doses efficaces les plus faibles et pour la durée la plus courte conforme aux objectifs de traitement et aux risques pour la femme individuelle.
Thérapie œstrogène-allonge
Cancer de l'endomètre
Il existe un risque accru de cancer de l'endomètre chez une femme atteinte d'un utérus qui utilise des œstrogènes sans opposition. Il a été démontré que l'ajout d'un progestatif à la thérapie par les œstrogènes réduit le risque d'hyperplasie endométriale qui peut être un précurseur du cancer de l'endomètre. Des mesures diagnostiques adéquates, y compris un échantillonnage endométrial dirigé ou aléatoire, lorsqu'ils sont indiqués, doivent être entrepris pour exclure une tumeinte chez les femmes ménopausées avec des saignements génitaux anormaux persistants ou récurrents non diagnostiquants. (Voir AVERTISSEMENTS Néoplasmes malins du cancer de l'endomètre).
Troubles cardiovasculaires et démence probable
Le traitement par œstrogène-alone ne doit pas être utilisé pour la prévention des maladies cardiovasculaires ou de la démence. (Voir Études cliniques et AVERTISSEMENTS Troubles cardiovasculaires et démence probable).
La sous-étude des œstrogènes-œstrogènes a signalé des risques accrus d'AVC et de TVP chez les femmes ménopausées (50 à 79 ans) pendant 7,1 ans de traitement avec un CE oral quotidien (0,625 mg) par rapport au placebo. (Voir Études cliniques et AVERTISSEMENTS Troubles cardiovasculaires).
L'étude aux prises avec des œstrogènes sur les WHI a signalé un risque accru de développer une démence probable chez les femmes ménopausées de 65 ans ou plus pendant 5,2 ans de traitement avec un CE quotidien (0,625 mg) par rapport au placebo. On ne sait pas si cette constatation s'applique aux jeunes femmes ménopausées. (Voir Études cliniques et AVERTISSEMENTS Démence probable et PRÉCAUTIONS Utilisation gériatrique).
En l'absence de données comparables, ces risques doivent être supposés être similaires pour d'autres doses de CE et d'autres formes posologiques d'œstrogènes.
Les œstrogènes avec ou sans progestatifs doivent être prescrits aux doses efficaces les plus faibles et pour la durée la plus courte conforme aux objectifs de traitement et aux risques pour la femme individuelle.
Description de combipatch
Combipatch® (Système transdermique d'estradiol / norethindrone acétate) est un patch transdermique matriciel à base d'adhésif conçu pour libérer à la fois l'estradiol un œstrogène et l'acétate de noréthindrone (NetA) un agent progestatif en continu lors de l'application à une peau intacte.
Deux systèmes sont disponibles pour fournir les éléments suivants en vain Taux de livraison de l'estradiol et du NEA.
| Taille du système | Estradiol (Mg) | Filet1 (Mg) | Taux de livraison nominal2 (Mg par jour) Estradiol / Filet |
| 9 cm2 rond | 0.62 | 2.7 | 0,05 / 0,14 |
| 16 cm2 rond | 0.51 | 4.8 | 0,05 / 0,25 |
| 1Filet=nouethindrone acetate. 2Basé sur en vain / in vitro La livraison des données de flux des deux composants par jour via la peau de perméabilité moyenne (la variation interindividuelle de la perméabilité cutanée est d'environ 20%). |
Estradiol USP (estradiol) is a white to creamy white odouless crystalline powder chemically described as estra-135(10)-triene-317 β -diol. Le poids moléculaire de l'estradiol est de 272,39 et la formule moléculaire est C18H24O2.
Filet USP is a white to creamy white odouless crystalline powder chemically described as 17-hydroxy-19nou- 17α-pregn-4-en-20-yn-3-one acetate. The molecular weight of Filet is 340.47 et the molecular foumula is C22H28O3.
Les formules structurelles pour l'estradiol et le neta sont:
 |
 |
Combipatch is comprised of 3 layers. Proceeding from the visible surface toward the surface attached to the skin these layers are (1) a translucent polyolsiin film backing (2) an adhesive layer containing estradiol Filet acrylic adhesive silicone adhesive oleic acid NF povidone USP et dipropylene glycol et (3) a polyester release protective liner which is attached to the adhesive surface et must be removed bsioue the system can be used.
 |
Les composants actifs du système sont l'estradiol USP et NETA USP. Les composants restants du système sont pharmacologiquement inactifs.
Utilisations pour combipatch
Combipatch is indicated in a woman with a uterus fou:
- Traitement des symptômes vasomotrices modérés à sévères dus à la ménopause.
- Traitement des symptômes modérés à graves de l'atrophie vulvaire et vaginale due à la ménopause. Lors de la prescription uniquement du traitement des symptômes de l'atrophie vulvaire et des produits vaginaux topiques vulvaires doit être pris en compte.
- Traitement de l'hypoestrogénisme en raison de la castration de l'hypogonadisme ou de l'insuffisance ovarienne primaire.
Dosage pour combipatch
Généralement, lorsque le traitement par œstrogène est prescrit pour une femme ménopausique avec un utérus, un progestatif doit être considéré comme réduisant le risque de cancer de l'endomètre. Une femme sans utérus n'a généralement pas besoin d'un progestatif. Dans certains cas, cependant, les femmes hystérectomisées ayant des antécédents d'endométriose peuvent nécessiter un progestatif. L'utilisation d'oestrogène-alone ou en combinaison avec un progestatif devrait être avec la dose efficace la plus faible et pour la durée la plus courte conforme aux objectifs de traitement et aux risques pour la femme individuelle. Les femmes ménopausées doivent être réévaluées périodiquement comme cliniquement appropriées pour déterminer si le traitement est toujours nécessaire. Des mesures de diagnostic adéquates telles que l'échantillonnage endométrial dirigé ou aléatoire, lorsque cela est indiqué, doit être entreprise pour exclure une tumeinte chez une femme ménopausique avec un utérus avec un saignement génital anormal persistant ou récurrent non diagnostiqué.
Initiation de la thérapie
Les patients doivent être démarrés à la dose la plus faible. Les œstrogènes avec ou sans progestatifs doivent être prescrits aux doses efficaces les plus faibles et pour la durée la plus courte conforme aux objectifs de traitement et aux risques pour la femme individuelle. La dose efficace de combipatch la plus faible n'a pas été déterminée dans les essais cliniques.
Les femmes n'utilisant pas actuellement les œstrogènes ou l'oestrogène combinés et la thérapie progestatif peuvent commencer le traitement avec combipatch à tout moment. Cependant, les femmes qui utilisent actuellement des œstrogènes ou des combinaisons d'oestrogène et un traitement progestatif à l'œstrogène et à la combinaison devraient terminer le cycle actuel du traitement avant de lancer une combipatch.
Les femmes éprouvent souvent des saignements de sevrage à la fin du cycle. Le premier jour de ce saignement serait un moment approprié pour commencer la combipatch.
Schémas thérapeutiques
Les schémas de progestation des œstrogènes plus combinés sont indiqués pour les femmes atteintes d'un utérus intact. Deux systèmes de livraison transdermiques de combipatch (estradiol / neta) sont disponibles: 0,05 mg d'estradiol avec 0,14 mg de NetA par jour (9 cm2) et 0,05 mg d'estradiol avec 0,25 mg de NetA par jour (16 cm2). La dose efficace la plus faible doit être utilisée. Pour tous les régimes, les femmes doivent être réévaluées à des intervalles de 3 à 6 mois pour déterminer si les changements dans l'hormonothérapie ou si l'hormonothérapie est appropriée.
Régime combiné continu
Combipatch 0.05 mg estradiol/0.14 mg Filet per day (9 cm2) Le système transdermique matriciel est utilisé pour un traitement continu ininterrompu appliqué deux fois par semaine dans le bas de l'abdomen. Un nouveau système doit être appliqué sur la peau tous les 3 à 4 jours (deux fois par semaine) pendant un cycle de 28 jours.
De plus, une dose de 0,05 mg d'estradiol / 0,25 mg de NetA (16 cm2 Système) est disponible si une dose progestative plus importante est souhaitée. Des saignements irréguliers peuvent survenir en particulier au cours des six premiers mois, mais diminuent généralement avec le temps et souvent à un état amenorrhéique.
Régime séquentiel continu
Combipatch can be applied as a sequential regimen in combination with an estradiol-only transdermal delivery system.
Dans ce schéma de traitement, 0,05 mg par jour (taux de livraison nominal) système transdermique estradiol (vivelle-dot®) est porté pendant les 14 premiers jours d'un cycle de 28 jours en remplacement du système tous les 3 à 4 jours (deux fois par semaine) selon les instructions du produit.
Pour les 14 jours restants du cycle de 28 jours combipatch 0,05 mg estradiol / 0,14 mg neta par jour (9 cm2) Le système transdermique doit être porté en continu dans le bas de l'abdomen. Le système combipatch doit être remplacé tous les 3 à 4 jours (deux fois par semaine) au cours de cette période de 14 jours au cours du cycle de 28 jours.
De plus, une dose de 0,05 mg d'estradiol / 0,25 mg de NetA (16 cm2 Système) est disponible si une dose progestative plus importante est souhaitée. Les femmes doivent être informées que les saignements mensuels de sevrage se produisent souvent.
Qu'est-ce que Ramipril 5 mg utilisé pour
Application du système
Sélection du site
Combipatch should be placed on a smooth (fold-free) clean dry area of the skin on the lower ABdomen. Combipatch should not be applied to ou near the breasts . La zone sélectionnée ne doit pas être grasse (qui peut altérer l'adhésion du système) endommagée ou irritée. La taille doit être évitée car les vêtements serrés peuvent frotter le système ou modifier l'administration de médicaments. Les sites d'application doivent être tournés avec un intervalle d'au moins une semaine autorisé entre les applications au même site.
Application
Après avoir ouvert la poche, retirez 1 côté de la doublure protectrice, prenant soin de ne pas toucher la partie adhésive du système de livraison transdermique avec les doigts. Appliquez immédiatement le système de livraison transdermique à une zone de peau lisse (sans pli) dans le bas de l'abdomen. Retirez le deuxième côté de la doublure protectrice et appuyez fermement sur le système avec la main pendant au moins 10 secondes en vous assurant qu'il y a un bon contact, en particulier autour des bords.
Il faut veiller à ce que le système ne soit pas délogé pendant le bain et d'autres activités. Si un système doit tomber, le même système peut être réappliqué dans une autre zone du bas de l'abdomen. Si nécessaire, un nouveau système transdermique peut être appliqué auquel cas le calendrier de traitement d'origine doit être poursuivi. Un seul système doit être porté à tout moment pendant l'intervalle de dosage de 3 à 4 jours.
Une fois en place, le système transdermique ne doit pas être exposé au soleil pendant des périodes prolongées.
Suppression du système
L'élimination du système doit être effectuée avec soin et lentement pour éviter l'irritation de la peau. Si un adhésif reste sur la peau après le retrait du système, permettez à la zone de sécher pendant 15 minutes. Frottez ensuite doucement la zone avec une crème ou une lotion à base d'huile pour éliminer le résidu adhésif.
Comment fourni
Combipatch Le système de livraison transdermique estradiol / NETA est disponible en:
| Système | Taux de livraison nominal* | |||
| Taille | Estradiol/ Filet | Présentation | NDC | Marques |
| 9 cm2 | 0,05 / 0,14 mg par jour | 8 systèmes par carton | 68968-0514-8 | Combipatch 0,05 / 0,14 mg par jour |
| 16 cm2 | 0,05 / 0,25 mg par jour | 8 systèmes par carton | 68968-0525-8 | Combipatch 0,05 / 0,25 mg par jour |
| * Taux de livraison nominal décrit. Voir DESCRIPTION Pour plus de détails sur la livraison de médicaments. |
Conditions de stockage
Conservez la combipatche au réfrigérateur à 36 ° F à 46 ° F (2 ° C à 8 ° C).Stocker les systèmes dans le scellé Poux en papier d'aluminium.
Ne stockez pas le système dans les zones où des températures extrêmes peuvent se produire.
Gardez ceci et tous les médicaments hors de portée des enfants.
Fabriqué par: Nomen Pharmaceuticals Inc. Miami FL 33186. Révisé: déc. 2021
Effets secondaires fou Combipatch
Voir Avertissement de boîte AVERTISSEMENTS et PRÉCAUTIONS .
Étant donné que les essais cliniques sont menés dans des conditions de réaction indésirables très variables observées dans les essais cliniques d'un médicament ne peuvent pas être directement comparées aux taux dans les essais cliniques d'un autre médicament et ne peuvent pas refléter les taux observés dans la pratique.
Tableau 9. Tous les effets indésirables quelle que soit la relation signalée à une fréquence de plus ou égale à 5% avec combipatch
| Études de symptômes vasomoteurs | |||
| Combipatch 0,05 / 0,14 Mg par jour † | Combipatch 0,05 / 0,25 mg par jour† | Placebo | |
| n = 113 | n = 112 | n = 107 | |
| Le corps dans son ensemble | 46% | 48% | 41% |
| 7% | 6% | 4% | |
| 4% | 5% | 8% | |
| 8% | 12% | 4% | |
| 11% | 9% | 5% | |
| 9% | 5% | 7% | |
| 18% | 20% | 20% | |
| 6% | 4% | 9% | |
| Digestif | 19% | 23% | 24% |
| 4% | 5% | 7% | |
| 1% | 5% | 5% | |
| 4% | 5% | 4% | |
| 11% | 8% | 7% | |
| Nerveux | 16% | 28% | 28% |
| 3% | 5% | 9% | |
| 3% | 6% | 7% | |
| 3% | 5% | 1% | |
| Respiratoire | 24% | 38% | 26% |
| 4% | 10% | 2% | |
| 7% | 12% | 7% | |
| 7% | 13% | 9% | |
| 4% | 9% | 9% | |
| Peau et appendices | 8% | 17% | 16% |
| 2% | 6% | 4% | |
| Urogénital | 54% | 63% | 28% |
| 25% | 31% | 7% | |
| 20% | 21% | 5% | |
| 5% | 5% | 3% | |
| 6% | 12% | 2% | |
| 8% | 4% | 5% | |
| 6% | 13% | 5% | |
| †Représente des milligrammes d'estradiol / neta livrés quotidiennement par chaque système. * Les réactions du site d'application comprennent des ecchymoses de saignement localisées brûlant l'inconfort séchesse eczéma œdème érythème inflammation de l'irritation PAPULES PAPELOSIE PRURITUS Discoloration cutanée Pigmentation cutanée Pigmentation de la peau Urticaire et vésicules. |
Tableau 10. Tous les effets indésirables quelle que soit la relation signalée à une fréquence de plus ou égale à 5% avec combipatch
| Études d'hyperplasie endométriale | |||
| Combipatch 0,05 / 0,14 mg par jour† | Combipatch 0,05 / 0,25 mg par jour† | Vivelle 0.05 mg par jour | |
| n = 325 | n = 312 | n = 318 | |
| Le corps dans son ensemble | 61% | 60% | 59% |
| 12% | 14% | 16% | |
| 10% | 11% | 8% | |
| 10% | 13% | 11% | |
| 15% | 14% | 13% | |
| 14% | 10% | 7% | |
| 25% | 17% | 21% | |
| 5% | 3% | 3% | |
| 19% | 15% | 13% | |
| Digestif | 42% | 32% | 31% |
| 2% | 5% | 3% | |
| 14% | 9% | 7% | |
| 8% | 6% | 5% | |
| 7% | 5% | 6% | |
| 8% | 12% | 11% | |
| 6% | 4% | 1% | |
| Troubles métaboliques et nutritionnels | 12% | 13% | 11% |
| 6% | 6% | 5% | |
| Musculo-squelettique | 17% | 17% | 15% |
| 6% | 6% | 5% | |
| Nerveux | 33% | 30% | 28% |
| 8% | 9% | 8% | |
| 6% | 7% | 5% | |
| 8% | 6% | 4% | |
| 5% | 6% | 3% | |
| Respiratoire | 45% | 43% | 40% |
| 5% | 3% | 4% | |
| 9% | 9% | 8% | |
| 13% | 9% | 13% | |
| 19% | 22% | 17% | |
| 10% | 12% | 12% | |
| Peau et appendices | 38% | 37% | 31% |
| 4% | 5% | 4% | |
| 20% | 23% | 17% | |
| 6% | 5% | 3% | |
| Urogénital | 71% | 79% | 74% |
| 2% | 7% | 2% | |
| 34% | 48% | 40% | |
| 30% | 31% | 19% | |
| 10% | 8% | 9% | |
| 2% | 5% | 9% | |
| 17% | 19% | 14% | |
| 3% | 6% | 12% | |
| 9% | 13% | 13% | |
| †Représente des milligrammes d'estradiol / neta livrés quotidiennement par chaque système. * Les réactions du site d'application comprennent des ecchymoses de saignement localisées brûlant l'inconfort séchesse eczéma œdème érythème inflammation de l'irritation PAPULES PAPELOSIE PRURITUS Discoloration cutanée Pigmentation cutanée Pigmentation de la peau Urticaire et vésicules. |
Expérience de commercialisation de la poste
Les effets indésirables supplémentaires suivants ont été identifiés lors de l'utilisation post-approbation de combipatch. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Système génito-urinaire
Hyperplasie endométriale Léiomyomate tube de Fallope Spasmes kystes utérins.
Sein
Sein cancer.
Cardiovasculaire
Varicose d'hypertension.
Gastro-intestinal
Jaunisse Trouble des troubles de la vallage cholentatique de la cholelitase biliaire a augmenté.
Peau
Peau discolouation.
Système nerveux central
Affectez les troubles de la libido de la labière migraine vertige paresthésie.
Divers
Le poids de l'hypersensibilité de l'œdème angio-œdème a augmenté.
Quelle classe d'antibiotique est la ciprofloxacine
Interactions médicamenteuses fou Combipatch
- Temps de prothrombine accéléré Temps de thromboplastine partielle et temps d'agrégation plaquettaire; Augmentation du nombre de plaquettes; Facteurs accrus II VII Antigène VIII Antigène VIII Activité coagulante IX X XII VII-X complexe complexe IIVIi- x; et bêta-thromboglobuline; diminution des niveaux d'anti-facteurs XA et antithrombine III; diminution de l'activité de l'antithrombine III; des niveaux accrus d'activité de fibrinogène et de fibrinogène; augmentation de l'antigène du plasminogène et de l'activité.
- Une augmentation du TBG entraînant une augmentation de l'hormone thyroïdienne totale circulante telle que mesurée par l'iode lié aux protéines (PBI) T4 niveaux (par colonne ou par radio-immunodosage) ou t3 Niveaux par radio-immunodosage. T3 L'absorption de résine est diminuée en reflétant le TBG élevé. Gratuit t4 et free T3 Les concentrations sont inchangées. Les femmes sous thérapie de remplacement thyroïdienne peuvent nécessiter des doses plus élevées d'hormone thyroïdienne.
- D'autres protéines de liaison peuvent être élevées dans le sérum (c'est-à-dire la globuline de liaison aux corticostéroïdes [CBG] SHBG) entraînant une augmentation des corticostéroïdes circulants et des stéroïdes sexuels respectivement. Des concentrations d'hormones libres telles que testostérone et estradiol may be decreased. Other plasma proteins may be increased (angiotensinogen/renin substrate alpha-1-antitrypsin ceruloplasmin).
- Une augmentation des concentrations de sous-fraction de lipoprotéines à haute densité (HDL) et de sous-fraction HDL-2 réduite triglycérides niveaux.
- Tolérance altérée au glucose.
Avertissements fou Combipatch
Voir Avertissement de boîte .
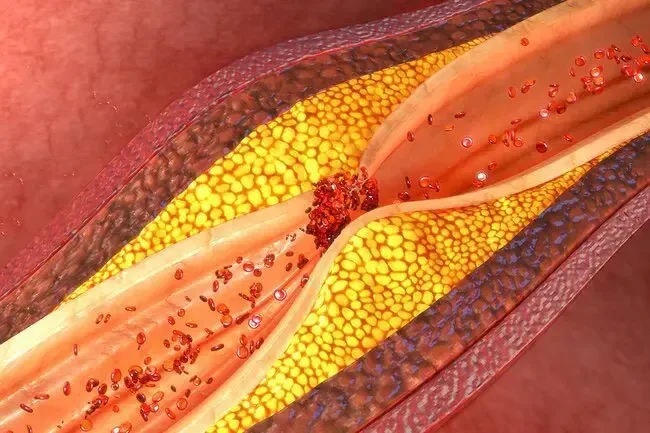
Cardiovasculaire Disouders
Un risque accru d'AVC de PE DVT et d'IM a été signalé avec l'oestrogène plus un traitement progestatif. Un risque accru d'AVC et de TVP a été signalé avec un traitement par œstrogènes. Si l'un d'eux survient ou est suspecté d'oestrogène avec ou sans traitement progestatif doit être interrompu immédiatement.
Facteurs de risque de maladie vasculaire artérielle (par exemple l'hypertension diabète sucré Le tabac utilise une hypercholestérolémie et obésité ) et / ou la thromboembolie veineuse (TEV) (par exemple les antécédents personnels ou les antécédents familiaux de l'obésité de la TEV et du lupus érythémateux systémique) doivent être gérés de manière appropriée.
Accident vasculaire cérébral
Dans la substitution whistrogène plus progestatif, un risque accru statistiquement significatif d'AVC a été signalé chez les femmes de 50 à 79 ans recevant une CE quotidienne (0,625 mg) plus l'AMP (2,5 mg) par rapport aux femmes du même groupe d'âge recevant un placebo (33 contre 25 pour 10000 femmes-années). (Voir Études cliniques ) L'augmentation du risque a été démontrée après la première année et a persisté.1 Si un accident vasculaire cérébral se produit ou être suspecté les œstrogènes plus le traitement progestatif doit être interrompu immédiatement.
Dans la sous-étude des œstrogènes, un risque accru statistiquement significatif d'AVC a été signalé chez les femmes de 50 à 79 ans recevant une CE quotidienne (0,625 mg) par rapport aux femmes du même groupe d'âge recevant un placebo (45 contre 33 pour 10000 femmes-années). (Voir Études cliniques ) L'augmentation du risque a été démontrée au cours de l'année 1 et a persisté. Si un accident vasculaire cérébral se produit ou être suspecté le traitement des œstrogènes-œstrogènes doit être interrompu immédiatement.
Les analyses de sous-groupes de femmes de 50 à 59 ans ne suggèrent aucun risque accru d'AVC pour les femmes recevant de la CE (0,625 mg) à celles qui reçoivent un placebo (18 contre 21 pour 10000 femmes-années).1
Maladie coronarienne
Dans la sous-étude progestative whi œstrogène plus il y avait un risque accru statistiquement non significatif de Coronarcha Événements (définis comme une mort si silencieuse non mortel non mortel) signalé chez les femmes recevant une CE quotidienne (0,625 mg) plus un MPA (2,5 mg) par rapport aux femmes recevant un placebo (41 contre 34 pour 10000 années de femmes).1 Une augmentation du risque relatif a été démontrée au cours de l'année 1 et une tendance à la diminution du risque relatif a été signalée au cours des années 2 à 5 (voir Études cliniques ).
Dans la sous-étude des œstrogènes, aucun effet global sur les événements CHD n'a été signalé chez les femmes recevant des œstrogènes-alone par rapport au placebo.2 (Voir Études cliniques ).
Les analyses des sous-groupes de femmes de 50 à 59 ans suggèrent une réduction statistiquement non significative des événements de la maladie coronarienne (CE [0,625 mg] -alon par rapport au placebo) chez les femmes moins de 10 ans depuis 10 ans depuis ménopause (8 contre 16 pour 10000 années pour femmes).1
Chez les femmes ménopausées atteintes d'une maladie cardiaque documentée (n = 2763 moyenne de 66,7 ans) dans un essai clinique contrôlé de prévention secondaire des maladies cardiovasculaires (étude cardiaque et œstrogène / progestatif progestatif; Hers) avec un traitement quotidien (0,625 mg) plus l'AMP (2,5 mg) n'a montré aucun avantage cardiovasculaire. Au cours d'un suivi moyen de 4,1 ans, le traitement avec CE Plus MPA n'a pas réduit le taux global d'événements de coronaropathie chez les femmes ménopausées avec une maladie coronarienne établie. Il y a eu plus d'événements de CHD dans le groupe traité par CE Plus MPA que dans le groupe placebo en première année mais pas au cours des années suivantes. Deux mille trois cent vingt et un (2321) femmes du procès Hers original ont accepté de participer à une extension ouverte de la sienne II. Le suivi moyen dans Hers II a été de 2,7 ans supplémentaire pour un total de 6,8 ans dans l'ensemble. Les taux d'événements CHD étaient comparables chez les femmes du groupe CE Plus MPA et le groupe placebo dans les Hers II et dans l'ensemble.
Thromboembolie veineuse
Dans la sous-étude des œstrogènes et progestatifs, un taux statistiquement significatif 2 fois plus élevé de TEV (TVP et PE) a été signalé chez les femmes recevant un CE quotidien (0,625 mg) plus un MPA (2,5 mg) par rapport au placebo (35 contre 17 pour 10000 femmes-années). Des augmentations statistiquement significatives du risque pour la TVP (26 contre 13 pour 10000 femmes-années) et le PE (18 contre 8 pour 10000 années de femmes) ont également été démontrées. L'augmentation du risque de TEV a été démontrée au cours de la première année et a persisté.3 (Voir Études cliniques ) Si une TEV se produit ou être suspectée d'œstrogènes plus le traitement progestatif doit être interrompu immédiatement.
Dans la sous-étude des œstrogènes-œstrogènes, le risque de TEV aurait augmenté pour les femmes recevant une CE quotidienne (0,625 mg) - les femmes recevant un placebo (30 contre 22 pour 10000 femmes-années), bien que le risque accru de TVP ait atteint une signification statistique (23 contre 15 pour 10000 ans d'années). L'augmentation du risque de TEV a été démontrée au cours des 2 premières années.4 (Voir Études cliniques ) Si une TEP se produit ou être suspectée un traitement œstrogène-œstrogène doit être interrompue immédiatement.
Si les œstrogènes réalisables doivent être interrompus au moins 4 à 6 semaines avant la chirurgie du type associé à un risque accru de thromboembolie ou pendant les périodes d'immobilisation prolongée.
Néoplasmes malins
Cancer du sein
L'essai clinique randomisé le plus important fournissant des informations sur le cancer du sein chez les utilisateurs d'œstrogènes plus progestatifs est la substitution de la CE quotidienne (0,625 mg) plus du MPA (2,5 mg). Après un suivi moyen de 5,6 ans, l'oestrogène plus la sous-étude progestative a signalé un risque accru de cancer du sein invasif chez les femmes qui ont pris le CE plus du MPA. Dans cette sous-étude, l'utilisation antérieure de traitement progestatif œstrogène-œstrogène ou œstrogène plus a été signalée par 26% des femmes. Le risque relatif de cancer du sein invasif était de 1,24 et le risque absolu était de 41 contre 33 cas pour 10000 années pour femmes pour CE plus MPA par rapport au placebo. Parmi les femmes qui ont signalé une utilisation antérieure de l'hormonothérapie, le risque relatif de cancer du sein invasif était de 1,86 et le risque absolu était de 46 contre 25 cas pour 10000 femmes pour les femmes pour CE plus MPA par rapport au placebo. Parmi les femmes qui n'ont signalé aucune utilisation préalable de l'hormonothérapie, le risque relatif de cancer du sein invasif était de 1,09 et le risque absolu était de 40 contre 36 cas pour 10000 femmes pour les femmes pour CE plus MPA par rapport au placebo. Dans la même sous-étude, les cancers du sein invasifs étaient plus importants étaient plus susceptibles d'être positifs et ont été diagnostiqués à un stade plus avancé dans le groupe CE (0,625 mg) plus MPA (2,5 mg) par rapport au groupe placebo. La maladie métastatique était rare sans différence apparente entre les 2 groupes. D'autres facteurs pronostiques tels que le statut de grade de sous-type histologique et le statut des récepteurs hormonaux ne différaient pas entre les groupes. (Voir) L'essai clinique randomisé le plus important fournissant des informations sur le cancer du sein chez les utilisateurs d'œstrogènes et les utilisateurs progestatifs est la sous-étude de la CE quotidienne (0,625 mg) plus MPA (2,5 mg). Après un suivi moyen de 5,6 ans, l'oestrogène plus la sous-étude progestative a signalé un risque accru de cancer du sein invasif chez les femmes qui ont pris le CE plus du MPA. Dans cette sous-étude, l'utilisation antérieure de traitement progestatif œstrogène-œstrogène ou œstrogène plus a été signalée par 26% des femmes. Le risque relatif de cancer du sein invasif était de 1,24 et le risque absolu était de 41 contre 33 cas pour 10000 années pour femmes pour CE plus MPA par rapport au placebo. Parmi les femmes qui ont signalé une utilisation antérieure de l'hormonothérapie, le risque relatif de cancer du sein invasif était de 1,86 et le risque absolu était de 46 contre 25 cas pour 10000 femmes pour les femmes pour CE plus MPA par rapport au placebo. Parmi les femmes qui n'ont signalé aucune utilisation préalable de l'hormonothérapie, le risque relatif de cancer du sein invasif était de 1,09 et le risque absolu était de 40 contre 36 cas pour 10000 femmes pour les femmes pour CE plus MPA par rapport au placebo. Dans la même sous-étude, les cancers du sein invasifs étaient plus importants étaient plus susceptibles d'être positifs et ont été diagnostiqués à un stade plus avancé dans le groupe CE (0,625 mg) plus MPA (2,5 mg) par rapport au groupe placebo. La maladie métastatique était rare sans différence apparente entre les 2 groupes. D'autres facteurs pronostiques tels que le statut de grade de sous-type histologique et le statut des récepteurs hormonaux ne différaient pas entre les groupes. (Voir Études cliniques )
L'essai clinique randomisé le plus important fournissant des informations sur le cancer du sein chez les utilisateurs œstrogènes est la sous-étude de la CE (0,625). Dans la sous-étude de l'estrogénalone après un suivi moyen de 7,1 ans, le CE-Alone par jour n'était pas associé à un risque accru de cancer du sein invasif (risque relatif [RR] 0,80). (Voir) L'essai clinique randomisé le plus important fournissant des informations sur le cancer du sein chez les utilisateurs d'œstrogènes est la sous-étude de la CE (0,625). Dans la sous-étude de l'estrogénalone après un suivi moyen de 7,1 ans, le CE-Alone par jour n'était pas associé à un risque accru de cancer du sein invasif (risque relatif [RR] 0,80). (Voir Études cliniques )
Conformément aux études d'observation des essais cliniques WHI, ont également signalé un risque accru de cancer du sein pour les œstrogènes plus un traitement progestatif et un risque accru de traitement œstrogène-œstrogène après plusieurs années d'utilisation. Le risque a augmenté avec la durée d'utilisation et a semblé revenir à la base de référence sur environ 5 ans après l'arrêt du traitement (seules les études d'observation ont des données substantielles sur le risque après l'arrêt). Les études observationnelles suggèrent également que le risque de cancer du sein était plus élevé et est devenu apparente plus tôt avec l'œstrogène plus un traitement progestatif par rapport au traitement par œstrogènes. Cependant, ces études n'ont pas trouvé de variation significative dans le risque de cancer du sein parmi différentes doses ou voies d'administration d'oestrogène plus progestatifs. Le risque a augmenté avec la durée d'utilisation et a semblé revenir à la base de référence sur environ 5 ans après l'arrêt du traitement (seules les études d'observation ont des données substantielles sur le risque après l'arrêt). Les études observationnelles suggèrent également que le risque de cancer du sein était plus élevé et est devenu apparente plus tôt avec l'œstrogène plus un traitement progestatif par rapport au traitement par œstrogènes. Cependant, ces études n'ont pas trouvé de variation significative du risque de cancer du sein parmi les différentes doses ou voies d'administration des combinaisons d'œstrogènes plus progestantes.
Il a été rapporté que l'utilisation de progestation œstrogène-alone et œstrogène plus entraînant une augmentation des mammographies anormales nécessitant une évaluation plus approfondie. L'utilisation de l'estrogénalone et de l'œstrogène plus le progestation a été signalée par une augmentation des mammographies anormales nécessitant une évaluation supplémentaire.
Toutes les femmes devraient recevoir des examens des seins annuels par un fournisseur de soins de santé et effectuer des auto-examinations mensuelles mammaires. De plus, les examens de mammographie devraient être programmés en fonction des facteurs de risque d'âge des patients et des résultats de mammographie antérieurs. Toutes les femmes devraient recevoir des examens des seins annuels par un fournisseur de soins de santé et effectuer des auto-examen des seins mensuels. De plus, les examens de mammographie devraient être programmés en fonction des facteurs de risque d'âge du patient et des résultats de mammographie antérieurs.
Cancer de l'endomètre
Un risque accru de cancer de l'endomètre a été signalé avec l'utilisation d'une thérapie aux œstrogènes sans opposition chez une femme avec un utérus. Le risque de cancer de l'endomètre signalé chez les utilisateurs d'oestrogène sans opposition est d'environ 2 à 12 fois supérieur à celui des non-utilisateurs et semble dépendant de la durée du traitement et de la dose d'œstrogènes. La plupart des études ne montrent aucun risque accru significatif associé à l'utilisation d'œstrogènes pendant moins d'un an. Le plus grand risque semble associé à une utilisation prolongée à des risques accrus de 15 à 24 fois pendant 5 à 10 ans ou plus et ce risque a été démontré pendant au moins 8 à 15 ans après que le traitement par œstrogène est interrompu. Un risque accru de cancer de l'endomètre a été signalé avec l'utilisation d'une thérapie œstrogène non opposée chez une femme atteinte d'un uterus. Le risque de cancer de l'endomètre signalé chez les utilisateurs d'oestrogène sans opposition est d'environ 2 à 12 fois supérieur à celui des non-utilisateurs et semble dépendant de la durée du traitement et de la dose d'œstrogènes. La plupart des études ne montrent aucun risque accru significatif associé à l'utilisation d'œstrogènes pendant moins d'un an. Le plus grand risque apparaît associé à une utilisation prolongée à des risques accrus de 15 à 24 fois pendant 5 à 10 ans ou plus et ce risque a été démontré pendant au moins 8 à 15 ans après l'arrêt du traitement des œstrogènes. La surveillance clinique de toutes les femmes utilisant un traitement progestatif à œstrogènes ou œstrogènes plus est importante. Des mesures diagnostiques adéquates, y compris un échantillonnage endométrial dirigé ou aléatoire, lorsqu'ils sont indiqués, doivent être entrepris pour exclure une tumeinte chez les femmes ménopausées avec des saignements génitaux anormaux persistants ou récurrents non diagnostiquants. Il n'y a aucune preuve que l'utilisation d'œstrogènes naturels se traduit par un profil de risque endométrial différent de celui des œstrogènes synthétiques d'une dose d'œstrogènes équivalente. Il a été démontré que l'ajout d'un progestatif à la thérapie par les œstrogènes réduit le risque d'hyperplasie endométriale qui peut être un précurseur du cancer de l'endomètre. La surveillance clinique de toutes les femmes utilisant un traitement progestatif à œstrogènes ou œstrogènes plus est importante. Des mesures diagnostiques adéquates, y compris un échantillonnage endométrial dirigé ou aléatoire, lorsqu'ils sont indiqués, doivent être entrepris pour exclure une tumeinte chez les femmes ménopausées avec des saignements génitaux anormaux persistants ou récurrents non diagnostiquants. Il n'y a aucune preuve que l'utilisation d'œstrogènes naturels se traduit par un profil de risque endométrial différent de celui des œstrogènes synthétiques d'une dose d'œstrogènes équivalente. Il a été démontré que l'ajout d'un progestatif à la thérapie par les œstrogènes réduit le risque d'hyperplasie endométriale qui peut être un précurseur du cancer de l'endomètre.Cancer de l'ovaire
La sous-étude progestative Whi œstrogène plus a signalé un risque accru statistiquement non significatif de cancer de l'ovaire. Après un suivi moyen de 5,6 ans, le risque relatif de cancer de l'ovaire pour CE plus MPA par rapport au placebo était de 1,58 (IC à 95% de 0,77 à 3,24). Le risque absolu pour CE Plus MPA par rapport au placebo était de 4 contre 3 cas pour 10000 années pour femmes. La sous-étude progestative Whi œstrogène plus a signalé un risque accru statistiquement non significatif de cancer de l'ovaire. Après un suivi moyen de 5,6 ans, le risque relatif de cancer de l'ovaire pour CE plus MPA par rapport au placebo était de 1,58 (IC à 95% de 0,77 à 3,24). Le risque absolu pour CE Plus MPA par rapport au placebo était de 4 contre 3 cas pour 10000 années pour femmes.7Une méta-analyse de 17 études d'épidémiologie prospectives et 35 rétrospectives a révélé que les femmes qui utilisaient un thérapie hormonale pour les symptômes de la ménopause avaient un risque accru de cancer de l'ovaire. L'analyse principale utilisant des comparaisons cas-témoins comprenait 12110 cas de cancer des 17 études prospectives. Les risques relatifs associés à l'utilisation actuelle de l'hormonothérapie étaient de 1,41 (intervalle de confiance à 95% [IC] 1,32 à 1,50); Il n'y avait aucune différence dans les estimations des risques par durée de l'exposition (moins de 5 ans [médiane de 3 ans] contre plus de 5 ans [médiane de 10 ans] d'utilisation avant le diagnostic du cancer). Le risque relatif associé à l'utilisation combinée actuelle et récente (utilisation abandonnée dans les 5 ans avant le diagnostic du cancer) était de 1,37 (IC à 95% 1,27-1,48) et le risque élevé était significatif pour les produits à l'œstrogène-œlone et l'œstrogène ainsi que les produits progestatifs. La durée exacte de l'utilisation de l'hormonothérapie associée à un risque accru de cancer de l'ovaire est cependant inconnue.
Démence probable
Dans les gérins œstrogènes plus la sous-étude accidentelle progestative de Whi une population de 4532 femmes ménopausées généralement en bonne santé de 65 à 79 ans ont été randomisées pour CE quotidien (0,625 mg) plus MPA (2,5 mg) ou placebo.
Après un suivi moyen de 4 ans, 40 femmes dans le groupe CE Plus MPA et 21 femmes du groupe placebo ont reçu un diagnostic de démence probable. Le risque relatif pour CE Plus MPA par rapport au placebo était de 2,05 (IC à 95% de 1,21 à 3,48). Le risque absolu de démence probable pour CE plus MPA par rapport au placebo était de 45 contre 22 cas pour 10000 années pour femmes.8 (Voir Études cliniques et PRÉCAUTIONS Utilisation gériatrique )
Dans l'étude aux prises avec les œstrogènes, une étude auxiliaire de Whi une population de 2947 femmes hystérectomisées de 65 à 79 ans a été randomisée pour la CE quotidienne (0,625 mg) -alone ou le placebo. Après un suivi moyen de 5,2 ans, 28 femmes du groupe œstrogène-œstrogène et 19 femmes dans le groupe placebo ont reçu un diagnostic de démence probable. Le risque relatif de démence probable pour CE-Alone par rapport au placebo était de 1,49 (IC à 95% 0,83 à 2,66). Le risque absolu de démence probable pour CE-Alone par rapport au placebo était de 37 contre 25 cas pour 10000 femmes pour femmes.8 (Voir Études cliniques et PRÉCAUTIONS Utilisation gériatrique )
Lorsque les données des 2 populations des caprices d'œstrogènes et d'œstrogènes et d'études progestantes auxiliaires ont été regroupées comme prévu dans le protocole des caprices, le risque relatif global signalé de démence probable était de 1,76 (IC à 95% 1,19 à 2,60). Étant donné que les deux études auxiliaires ont été menées chez les femmes de 65 à 79 ans, on ne sait pas si ces résultats s'appliquent aux femmes ménopausées plus jeunes.8 (Voir PRÉCAUTIONS Utilisation gériatrique )
Maladie de la vésicule biliaire
Une augmentation de 2 à 4 fois du risque de maladie de la vésicule biliaire nécessitant une intervention chirurgicale chez les femmes ménopausées recevant des œstrogènes a été signalée.
Hypercalcémie
L'administration des œstrogènes peut entraîner une hypercalcémie sévère chez les patientes atteintes d'un cancer du sein et des métastases osseuses. Si une hypercalcémie se produit, l'utilisation du médicament doit être arrêtée et les mesures appropriées prises pour réduire le taux de calcium sérique.
Anomalies visuelles
Une thrombose vasculaire rétinienne a été signalée chez les femmes recevant des œstrogènes. Interrompre les médicaments en attendant l'examen s'il y a une perte de vision partielle ou complète soudaine ou un début soudain de proptose diplopie ou de migraine. Si l'examen révèle un œdème papier ou des lésions vasculaires rétiniennes les œstrogènes doivent être interrompus de façon permanente.
Œdème de l'angio
Œdème de l'angio involving eye/eyelid face larynx Longue et extrémité du pharynx (mains des jambes des mains et doigts) avec ou sans urticaire nécessitant une intervention médicale se sont produites dans l'expérience post-commercialisation de l'utilisation de combipatch. Si l'œdème de l'angio-œdème implique la langue que la glotte ou l'obstruction des voies respiratoires du larynx peuvent se produire. Les femmes qui développent l'œdème de l'angio-œdème à tout moment au cours du traitement avec combipatch ne devraient pas la recevoir à nouveau. Les œstrogènes exogènes peuvent exacerber les symptômes de l'œdème de l'angio-œdème chez les femmes atteintes d'œdème héréditaire.
Réactions anaphylactiques / anaphylactoïdes sévères
Des cas de réactions anaphylactiques / anaphylactoïdes qui se sont développés à tout moment au cours du traitement de la combipatche et ont nécessité une gestion médicale d'urgence ont été signalés dans le cadre du marché postal. L'implication de la peau (l'urgence prurittus est notée aux lèvres gonflées) et aux voies respiratoires (compromis respiratoire) ou au tractus gastro-intestinal (vomissements de douleur abdominale).
Précautions fou Combipatch
Général
Ajout d'un progestatif lorsqu'une femme n'a pas eu d'hystérectomie
Des études sur l'ajout d'un progestatif pendant 10 jours ou plus d'un cycle d'administration des œstrogènes ou quotidiennement avec des œstrogènes dans un régime continu ont signalé une incidence abaissée d'hyperplasie endométriale que ce qui serait induit par un traitement aux œstrogènes seul. L'hyperplasie endométriale peut être un précurseur du cancer de l'endomètre.
Il existe cependant des risques possibles qui peuvent être associés à l'utilisation de progestatifs avec des œstrogènes par rapport aux schémas œstrogènes. Il s'agit notamment d'un risque accru de cancer du sein.
Tension artérielle élevée
Dans un petit nombre de rapports de cas, des augmentations substantielles de la pression artérielle ont été attribuées aux réactions idiosyncratiques aux œstrogènes. Dans un grand essai clinique contrôlé par placebo randomisé, un effet généralisé de la thérapie par les œstrogènes sur la pression artérielle n'a pas été observé.
Hypertriglycéridémie
Chez les femmes atteintes d'hypertriglycéridémie œstrogène, une thérapie par œstrogène peut être associée à des élévations de triglycérides plasmatiques conduisant à une pancréatite. Envisagez l'arrêt du traitement en cas de pancréatite.
Troubles hépatiques et / ou histoire passée de la jaunisse cholestatique
Bien que la thérapie par œstrogènes administrée par transder, évite les œstrogènes du métabolisme hépatique de premier passage peut être mal métabolisé chez les femmes ayant une fonction hépatique altérée. Pour les femmes ayant des antécédents de jaunisse cholestatique associés à l'utilisation des œstrogènes antérieurs ou à la prudence de la grossesse, il faut exercer et, dans le cas des médicaments de récidive, doit être interrompu.
Hypothyroïdie
L'administration des œstrogènes entraîne une augmentation des niveaux de globuline de liaison à la thyroïde (TBG). Les femmes ayant une fonction thyroïdienne normale peuvent compenser l'augmentation du TBG en faisant plus d'hormones thyroïdien4 et T3 Concentrations sériques dans la plage normale. Les femmes dépendant de l'hormonothérapie de l'hormone thyroïdienne qui reçoivent également des œstrogènes peuvent nécessiter des doses accrues de leur thérapie de remplacement thyroïdienne. Ces femmes devraient faire surveiller leur fonction thyroïdienne afin de maintenir leurs niveaux d'hormones thyroïdiens libres dans une gamme acceptable.
Rétention d'eau
Les œstrogènes et les progestatifs peuvent provoquer un certain degré de rétention de liquide. Les femmes atteintes de conditions qui pourraient être influencées par ce facteur telles que les troubles cardiaques ou rénales garantissent une observation attentive lorsque les œstrogènes et les progestatifs sont prescrits.
Hypocalcémie
La thérapie par œstrogène doit être utilisée avec prudence chez les femmes atteintes d'hypoparathyroïdie car une hypocalcémie induite par les œstrogènes peut se produire.
Exacerbation de l'endométriose
Quelques cas de transformation maligne d'implants endométriaux résiduels ont été signalés chez les femmes traitées après l'hystérectomie par traitement des œstrogènes. Pour les femmes connues comme ayant une endométriose résiduelle après l'hystérectomie, l'ajout de progestatif doit être pris en compte.
Exacerbation d'autres conditions
La thérapie par l'œstrogène peut provoquer une exacerbation de l'asthme diabète sucré migraine épilepsie ou de porphyrie lupus érythémateux et hémangiomes hépatiques et doit être utilisé avec prudence chez les femmes souffrant de ces conditions.
Informations sur les patients
Il est conseillé aux médecins de discuter du contenu de la Informations sur les patients dépliant et Instructions pour une utilisation avec les patients pour lesquels ils prescrivent le combipatch.
Tests de laboratoire
Il n'a pas été démontré que les taux sériques de FSH et d'estradiol ne sont pas utiles dans la gestion de symptômes vasomoteurs modérés à sévères et de symptômes modérés à sévères d'atrophie vulvaire et vaginale.
Les paramètres de laboratoire peuvent être utiles pour guider le dosage pour le traitement de l'hypoestrogénisme en raison de la castration de l'hypogonadisme et de l'insuffisance ovarienne primaire.
Carcinogenèse Mutagenèse A trouble de la fertilité
L'administration continue à long terme d'œstrogènes naturels et synthétiques dans certaines espèces animales augmente la fréquence des carcinomes des testicules de vagin du col de l'utérus du sein et du foie.
Filet was not mutagenic in a battery of in vitro ou en vain tests de toxicité génétique.
Grossesse
Combipatch should not be used during pregnancy. (Voir Contre-indications .) Il semble y avoir peu ou pas de risque accru de malformations congénitales chez les enfants nés de femmes qui ont utilisé des œstrogènes et des progestatifs comme contraceptive orale par inadvertance en début de grossesse.
Mères qui allaitent
Combipatch should not be used during lactation. Estrogen administration to nursing women has been shown to decrease the quantity et quality of the breast milk. DetectABle amounts of estrogens et progestins have been identified in the breast milk of women receiving these drugs. Caution should be exercised when Combipatch is administered to a nursing woman.
Usage pédiatrique
Combipatch is not indicated in children. Clinical studies have not been conducted in the pediatric population.
Utilisation gériatrique
Il n'y a pas eu un nombre suffisant de femmes gériatriques impliquées dans des études utilisant un combipatch pour déterminer si ceux de plus de 65 ans diffèrent des sujets plus jeunes dans leur réponse à la combipatch.
Les études de l'initiative de santé des femmes
Dans la sous-étude progestative Whi œstrogène plus (CE quotidien [0,625 mg] plus MPA [2,5 mg] par rapport au placebo), il y avait un risque relatif plus élevé d'AVC non mortel et d'un cancer du sein invasif chez les femmes de plus de 65 ans. (Voir Études cliniques .)
Dans la sous-étude des œstrogènes (CE quotidien [0,625 mg] par rapport au placebo), il y avait un risque relatif plus élevé d'AVC chez les femmes de plus de 65 ans. (Voir Études cliniques .)
L'étude de mémoire de l'initiative de santé des femmes
Dans les études aux prises avec les femmes ménopausées de 65 à 79 ans, il y avait un risque accru de développer une démence probable chez les femmes recevant des œstrogènes plus le progestatif ou les œstrogènes par rapport au placebo. (Voir Études cliniques et AVERTISSEMENTS Démence probable .)
Étant donné que les deux études auxiliaires ont été menées chez les femmes de 65 à 79 ans, on ne sait pas si ces résultats s'appliquent aux femmes ménopausées plus jeunes. (Voir Études cliniques et AVERTISSEMENTS Démence probable.)
Références
1. Rossouw Je et al. Hormonothérapie postménopausique et risque de maladie cardiovasculaire par âge et années depuis la ménopause. Jama. 2007; 297: 1465-1477.
2. Hsia J et al. Œstrogènes équins conjugués et maladie coronarienne. Arch int med. 2006; 166: 357-365.
3. Cushman M et al. Œstrogène plus progestatif et risque de thrombose veineuse. Jama. 2004; 292: 1573-1580.
4. Curb JD et al. Thrombose veineuse et œstrogènes équins conjugués chez les femmes sans utérus. Arch int med. 2006; 166: 772-780.
5. Chlebowski RT et al. Influence de l'œstrogène plus progestatif sur le cancer du sein et la mammographie chez les femmes ménopausées saines. Jama. 2003; 289: 3234-3253.
6. Stefanick ML et al. Effets des œstrogènes équins conjugués sur le cancer du sein et le dépistage de la mammographie chez les femmes ménopausées atteints d'hystérectomie. Jama. 2006; 295: 1647-1657.
7. Anderson GL et al. Effets de l'œstrogène plus progestatif sur les cancers gynécologiques et les procédures de diagnostic associées. Jama. 2003; 290: 1739-1748.
8. Shumaker SA et al. Œstrogènes équins conjugués et incidence de la démence probable et des troubles cognitifs légers chez les femmes ménopausées. Jama. 2004; 291: 2947-2958.
Informations sur la surdose pour combipatch
Un surdosage des œstrogènes ou des œstrogènes plus le progestatif peut provoquer des nausées vomissements de la sensibilité mammaire, la somnolence et la fatigue et la fatigue et les saignements de sevrage peuvent se produire chez les femmes. Le traitement de la surdose consiste en l'arrêt de la combipatch thérapie avec une institution de soins symptomatiques appropriés
Contre-indications pour combipatch
Combipatch is contraindicated in women with any of the following conditions:
- Saignement génital anormal non diagnostiqué.
- Soupçonné ou antécédent de cancer du sein.
- Néoplasie connu ou suspectée des œstrogènes.
- DVT actif ou historique de ces conditions.
- Maladie thromboembolique artérielle active (par exemple AVC et IM) ou antécédents de ces conditions.
- Réaction anaphylactique connue ou œdème de l'angio-œdème ou hypersensibilité avec combipatch.
- Troubles du foie connus ou maladie.
- Protéine C connue C ou carence en antithrombine ou autres troubles thrombophiles connus
- Grossesse connue ou suspectée.
Pharmacologie clinique fou Combipatch
Les œstrogènes endogènes sont largement responsables du développement et du maintien du système reproducteur féminin et des caractéristiques sexuelles secondaires. Bien que les œstrogènes circulants existent dans un équilibre dynamique des interconversions métaboliques L'œstradiol est le principal œstrogène humain intracellulaire et est sensiblement plus puissant que ses métabolites œstrone et œstriol au niveau des récepteurs.
La principale source d'oestrogène chez les femmes adultes normalement à vélo est le follicule ovarien qui sécrète 70 à 500 mcg d'estradiol quotidiennement en fonction de la phase du cycle menstruel. Après la ménopause, la plupart des œstrogènes endogènes sont produits par la conversion de l'androstènedione sécrétée par le cortex surrénal en œstrone dans les tissus périphériques. Ainsi, l'estrone et la forme conjuguée au sulfate de sulfate d'oestrone sont les œstrogènes circulants les plus abondants chez les femmes ménopausées.
Strengt de prescription acide salicylique pour les verrues
Les œstrogènes agissent par la liaison aux récepteurs nucléaires dans les tissus sensibles aux œstrogènes. À ce jour, 2 récepteurs des œstrogènes ont été identifiés. Celles-ci varient en proportion du tissu aux tissus.
Les œstrogènes circulants modulent la sécrétion hypophysaire des gonadotrophines lutéinisant l'hormone (LH) et l'hormone stimulante des follicules (FSH) par un mécanisme de rétroaction négative. Les œstrogènes agissent pour réduire les niveaux élevés de ces hormones observées chez les femmes ménopausées.
Pharmacocinétique
Absorption
Estradiol
Les œstrogènes utilisés en hormonothérapie sont bien absorbés par les muqueuses cutanées et les voies gastro-intestinales. L'administration de combipatch tous les 3 à 4 jours chez les femmes ménopausées produit des concentrations de sérum d'estradiol à l'état d'équilibre moyen de 45 à 50 pg / ml, ce qui équivaut aux gammes normales observées au début de la phase folliculaire chez les femmes préménopausées. Ces concentrations sont obtenues dans les 12 à 24 heures suivant l'application de combipatch. Des fluctuations minimales dans les concentrations sériques d'estradiol sont observées après l'application combipatch indiquant une livraison hormonale cohérente sur l'intervalle d'application.
Dans 1 étude, les concentrations sériques de l'estradiol ont été mesurées chez 40 femmes ménopausées saines dans 3 applications de combipatch consécutives à l'abdomen (chaque dose a été appliquée pour trois périodes de 3,5 jours). Les paramètres pharmacocinétiques correspondants sont résumés dans le tableau 1.
Tableau 1. Moyenne (SD) Concentrations sériques d'estradiol et d'estrone (PG / ml) à l'état d'équilibre (non corrigé pour les niveaux de base)
| Estradiol | ||||
| Taille du système | Dose estradiol / net (Mg par jour) | Cmax | Cmin | Cavage |
| 9 cm2 | 0,05 / 0,14 | 71 (32) | 27 (17) | 45 (21) |
| 16 cm2 | 0,05 / 0,25 | 71 (30) | 37 (17) | 50 (21) |
| Œstrone | ||||
| 9 cm2 | 0,05 / 0,14 | 72 (23) | 49 (19) | 54 (19) |
| 16 cm2 | 0,05 / 0,25 | 78 (22) | 58 (22) | 60 (18) |
Nocethindrone
Les progestatifs utilisés dans l'hormonothérapie sont bien absorbés par les muqueuses cutanées et les voies gastro-intestinales. Les concentrations à l'état d'équilibre de Norethindrone sont atteintes dans les 24 heures suivant l'application des systèmes de livraison transdermiques combipatch. Des fluctuations minimales dans les concentrations sériques de noréthindrone sont observées après un traitement combipatch indiquant une administration hormonale cohérente sur l'intervalle d'application. Les concentrations sériques de Norethindrone augmentent linéairement avec des doses croissantes de NetA.
Dans 1 étude, les concentrations sériques de noréthindrone ont été mesurées chez 40 femmes ménopausées saines sur 3 applications de combipatch consécutives à l'abdomen (chaque dose a été appliquée pour trois périodes de 3,5 jours). Les paramètres pharmacocinétiques correspondants sont résumés dans le tableau 2.
Tableau 2. Concentrations de Norethindrone en sérum moyenne (SD) à l'état d'équilibre
| Taille du système | Dose estradiol / net (Mg par jour) | Cmax | Cmin | Cavage |
| 9 cm2 | 0,05 / 0,14 | 617 (341) | 386 (137) | 489 (244) |
| 16 cm2 | 0,05 / 0,25 | 1060 (543) | 686 (306) | 840 (414) |
Distribution
Estradiol
La distribution des œstrogènes exogènes est similaire à celui des œstrogènes endogènes. Les œstrogènes sont largement distribués dans le corps et se trouvent généralement à des concentrations plus élevées dans les organes cibles de l'hormone sexuelle. Les œstrogènes circulent dans le sang en grande partie liés à la globuline de liaison aux hormones sexuelles (SHBG) et à l'albumine.
Nocethindrone
Dans le plasma, Norethindrone est lié à environ 90% au SHBG et à l'albumine.
Métabolisme
Estradiol
Les œstrogènes exogènes sont métabolisés de la même manière que les œstrogènes endogènes. Les œstrogènes circulants existent dans un équilibre dynamique des interconversions métaboliques. Ces transformations se déroulent principalement dans le foie. L'estradiol est converti de manière réversible en œstrone et les deux peuvent être convertis en œstriol qui est un métabolite urinaire majeur. Les œstrogènes subissent également une recirculation entérohépatique par conjugaison de sulfate et de glucuronide dans la sécrétion biliaire hépatique de conjugués dans l'intestin et l'hydrolyse dans l'intestin suivie d'une réabsorption. Chez les femmes ménopausées, une partie importante des œstrogènes circulants existent en tant que conjugués de sulfate, en particulier le sulfate d'oestrone qui sert de réservoir en circulation pour la formation d'œstrogènes plus actifs.
Nocethindrone
Filet is hydrolyzed to the active moiety nouethindrone in most tissues including skin et blood. Nocethindrone is primarily metABolized in the liver.
Excrétion
Estradiol
Estradiol estrone et estriol are excreted in the urine along with glucuronide et sulfate conjugates. Estradiol has a shout elimination half-life of approximately 2 to 3 hours; thersioue a rapid decline in serum levels is observed after the Combipatch estradiol/Filet transdermal system is removed. Within 4 to 8 hours serum estradiol concentrations return to untreated postmenopausal levels (less than 20 pg/mL).
Les données de concentration des essais cliniques indiquent que la pharmacocinétique de l'estradiol n'a pas changé au fil du temps, ne suggérant aucune preuve de l'accumulation d'estradiol après des périodes prolongées d'usure des patchs (jusqu'à 1 an).
Nocethindrone
La demi-vie d'élimination de Norethindrone serait de 6 à 8 heures. Les concentrations de sérum de Norethindrone diminuent rapidement et sont inférieures à 50 pg / ml dans les 48 heures suivant le retrait du système de livraison transdermique combipatch.
Les données de concentration des essais cliniques indiquent que la pharmacocinétique de la noréthindrone n'a pas changé au fil du temps, ne suggérant aucune preuve de l'accumulation de noétrone après des périodes prolongées d'usure des patchs (jusqu'à 1 an).
Populations spéciales
Aucune étude pharmacocinétique n'a été menée dans des populations spéciales, notamment des patients souffrant de troubles rénaux ou hépatiques.
Interactions médicamenteuses
Aucune étude d'interaction médicamenteuse n'a été menée avec combipatch. In vitro et en vain Des études ont montré que les œstrogènes sont métabolisés partiellement par le cytochrome P450 3A4 (CYP3A4). Par conséquent, les inducteurs ou les inhibiteurs du CYP3A4 peuvent affecter le métabolisme des médicaments œstrogènes. Inducteurs de CYP3A4 comme le millepertuis ( Hypericum perforatum ) Les préparations anticonvulsivants (par exemple phénobarbital phénytoïne et carbamazépine) phénylbutazone et anti-infectives (par exemple, rifampin rifabutin névirapine et efavirenz) peuvent réduire les concentrations en plasma d'isrogènes éventuellement résultant de la diminution des effets thérapeutiques et / ou des modifications du profil de balancement utérine. Les inhibiteurs du CYP3A4 tels que l'érythromycine clarithromycine kétoconazole itraconazole ritonavir nelfinavir et le jus de pamplemousse peuvent augmenter les concentrations plasmatiques d'œstrogènes et peuvent entraîner des effets secondaires.
Adhésion
La moyenne de 6 essais cliniques d'une durée de 3 mois à 1 an sur 1287 patients traités par des systèmes transdermiques combipatches a complètement adhéré à la peau près de 90% du temps au cours de la période d'usure de 3 à 4 jours. Moins de 2% des patients ont nécessité une réapplication ou un remplacement des systèmes en raison de levage ou du détachement. Deux patients (0,2%) ont interrompu le traitement au cours des essais cliniques en raison de l'échec de l'adhésion.
Études cliniques
Effets sur les symptômes vasomoteurs
Dans 2 essais cliniques conçus pour évaluer le degré de soulagement des symptômes vasomotrices modérés à sévères chez les femmes ménopausées (n = 332), une combipatche a été administrée pour 3 cycles de 28 jours dans Continu combiné ou Séquentiel continu schémas de traitement par rapport au placebo. Dans le Continu combiné Le régiment de régimes a été appliqué tout au long des 3 cycles remplaçant le système deux fois par semaine. Dans le Séquentiel continu régime un système transdermique uniquement estradiol (vivelle® 0,05 mg) a été appliqué deux fois par semaine au cours des 14 premiers jours d'un cycle de 28 jours; La combipatch a été appliquée pour les 14 jours restants du cycle et remplacés deux fois par semaine également. Le nombre moyen de rinçages chauds à la ligne de base était de 10 à 11 par jour et de 11 à 12 par jour dans le Continu combiné et Séquentiel continu Régimes essais respectivement. Le nombre moyen et l'intensité des rinçages à chaud quotidien (population en intention de traiter) ont été considérablement réduits de la ligne de base au point final avec le Continu combiné ou Séquentiel continu Administration de combipatch à toutes les doses par rapport au placebo (population en intention de traiter). (Voir les tableaux 3 et 4)
Tableau 3. Changement moyen ajusté du nombre de rinçages chauds et de l'intensité quotidienne des bouffées de chaud Continu combiné Thérapie transdermique
| Changement moyen ajusté de la ligne de base1 | Combipatch Continu combiné | Placebo | |
| 0,05 / 0,14 mg par jour2 n = 57 | 0,05 / 0,25 mg par jour2 n = 52 | n = 51 | |
| Nombre de bouffées chaudes3 | -9.35 | -8.95 | -6.2 |
| Intensité quotidienne des rinçages chauds34 | -4.656 | -5.05 | -2.87 |
| 1Les moyennes ont été ajustées pour le déséquilibre entre les groupes de traitement et les enquêteurs (les moindres carrés moyens de l'ANOVA). 2Représente les milligrammes d'estradiol / neta livrés quotidiennement par chaque système. 3La population représente les patients qui ont eu des observations de référence et de point final. 4L'intensité des rinçages chauds a été évaluée sur une échelle de 0 à 9 (aucune = 0 douce = 1-3 modérée = 4-6 sévère = 7-9). 5Valeur p versus placebo = <0.001. 6Le nombre total de patients avec des données disponibles est de 56. 7Le nombre total de patients avec des données disponibles est de 50. |
Tableau 4. Changement moyen ajusté du nombre de rinçages chauds et de l'intensité quotidienne des bouffées de chaud Séquentiel continu Thérapie transdermique
| Changement moyen ajusté de la ligne de base1 | Combipatch Séquentiel continu | Placebo | |
| 0,05 / 0,14 mg par jour2 n = 54 | 0,05 / 0,25 mg par jour2 n = 59 | n = 53 | |
| Nombre de bouffées chaudes3 | -9.35 | -9.55 | -5.5 |
| Intensité quotidienne des rinçages chauds34 | -4.45 | -4.55 | -2.1 |
| 1Les moyennes ont été ajustées pour le déséquilibre entre les groupes de traitement et les enquêteurs (les moindres carrés moyens de l'ANOVA). 2Représente les milligrammes d'estradiol / neta livrés quotidiennement par chaque système. 3La population représente les patients qui ont eu des observations de référence et de point final. 4L'intensité des rinçages chauds a été évaluée sur une échelle de 0 à 9 (aucune = 0 douce = 1-3 modérée = 4-6 sévère = 7-9). 5Valeur p versus placebo = <0.001. |
Effets sur l'endomètre
L'utilisation d'une thérapie aux œstrogènes sans opposition a été associée à un risque accru d'hyperplasie endométriale un précurseur possible de l'adénocarcinome endométrial. Les progestatifs contrecarrent les effets œstrogéniques en diminuant le nombre de récepteurs nucléaires de l'estradiol et en supprimant la synthèse de l'ADN épithélial dans le tissu endométrial.
Les études cliniques indiquent que l'ajout d'un progestatif à un régime d'oestrogène au moins 12 jours par cycle réduit l'incidence de l'hyperplasie endométriale et le risque potentiel d'adénocarcinome chez les femmes atteintes d'Uteri intactes. Il n'a pas été démontré que l'ajout d'un progestatif à un régime d'œstrogènes interfère avec l'efficacité de la thérapie aux œstrogènes pour ses indications approuvées.
Combipatch was sifective in reducing the incidence of estrogen-induced endometrial hyperplasia after 1 year of therapy in two clinical trials. Nine hundred fifty-five (955) postmenopausal women (with intact uteri) were treated with (i) a continuous regimen of Combipatch alone ( Continu combiné régime) (ii) un régime séquentiel avec un système transdermique d'estradiol (Vivelle 0,05 mg) suivi d'un système transdermique combipatch ( Séquentiel continu régime) ou (iii) régime continu avec un système transdermique uniquement estradiol (Vivelle 0,05 mg). L'incidence de l'hyperplasie endométriale (critère d'évaluation primaire) était significativement inférieure après 1 an de thérapie avec l'un ou l'autre des régimes de combipatch qu'avec le système transdermique uniquement sur l'estradiol. Les tableaux 5 et 6 résument ces résultats (populations en intention de traiter).
Tableau 5. Incidence de l'hyperplasie endométriale dans un régime combiné combiné continu
| Combipatch Séquentiel continu | Vivelle Continu | ||
| 0,05 / 0,14 mg par jour1 | 0,05 / 0,25 mg par jour1 | 0.05 mg par jour | |
| Nombre de patients atteints de biopsies2 | 123 | 98 | 103 |
| Nombre (%) des patients atteints d'hyperplasie | 1 (<1%)3 | 1 (1%)34 | 39 (38%)5 |
| 1Représente des milligrammes d'estradiol / neta livrés quotidiennement par chaque système. 2Biopsie après 12 cycles de traitement ou d'hyperplasie avant le cycle 12. 3La comparaison du régime combiné continu contre le patch uniquement estradiol était significatif (P <0.001). 4Ce patient avait une hyperplasie au départ. 5L'un des 39 patients avait une hyperplasie dans un polype endométrial. |
Tableau 6. Incidence de l'hyperplasie endométriale dans un Séquentiel continu Combipatch Regimen
| Combipatch Séquentiel continu | Vivelle Continu | ||
| 0,05 / 0,14 mg par jour1 | 0,05 / 0,25 mg par jour1 | 0.05 mg par jour | |
| Nombre de patients atteints de biopsies2 | 117 | 114 | 115 |
| Nombre (%) des patients atteints d'hyperplasie | 1 (<1%)34 | 1 (<1%)35 | 23 (20%) |
| 1Représente des milligrammes d'estradiol / neta livrés quotidiennement par chaque système. 2Biopsie après 12 cycles de traitement ou d'hyperplasie avant le cycle 12. 3La comparaison du régime séquentiel continu par rapport au patch uniquement en estradiol était significatif (P <0.001). 4Ce patient avait une hyperplasie au départ. 5Ce patient avait une hyperplasie dans un polype endométrial. |
Effets sur les saignements ou les taches utérins
Avec Continu combiné Le régime des femmes traités par combipatch et qui a terminé l'étude à 1 an l'incidence de l'aménorrhée cumulative (l'absence de saignement ou de repérage pendant un cycle de 28 jours et soutenu jusqu'à la fin de l'étude) au fil du temps. L'incidence de l'aménorrhée du cycle 10 à 12 était de 53% et 39% pour le combipatche 0,05 / 0,14 mg par jour et le combipatche 0,05 / 0,25 mg par jour de traitement respectivement. Les femmes qui ont connu des saignements l'ont généralement caractérisée comme une lumière (intensité de 1,3 sur une échelle de 1 à 4) avec une durée de 4 et 6 jours pour le combipatch 0,05 / 0,14 mg par jour et le combipatch 0,05 / 0,25 mg par jour de traitement des groupes de traitement respectivement. (Voir figure 1)
Figure 1. Incidence de l'aménorrhée cumulative * dans le combipatch Continu combiné Thérapie transdermique by Cycle Over a 1-Year Period (Intent-to-Treat Population)
| * L'aménorrhée cumulative est définie comme l'absence de saignement pendant la durée d'un cycle de 28 jours et soutenue à la fin de l'étude. |
Études de l'initiative de santé des femmes
Le Whi a inscrit environ 27 000 femmes ménopausées principalement saines dans deux sous-études pour évaluer les risques et les avantages de la CE orale quotidienne (0,625 mg) -alone ou en combinaison avec l'AMP (2,5 mg) par rapport au placebo dans la prévention de certaines maladies chroniques. Le critère d'évaluation principal a été l'incidence des maladies coronariennes (CHD) [définies comme une mort silencieuse et de la CHD non mortelle non mortelle] avec un cancer du sein invasif comme principal résultat indésirable. Un indice global comprenait la première occurrence du cancer de l'endomètre du cancer du sein invasif sur la CHD (uniquement dans la fracture ou la mort du cancer colorectal du CE plus de la MPA. Ces sous-études n'ont pas évalué les effets de CE plus MPA ou CE-Alone sur les symptômes de la ménopause.
Whi œstrogène plus substitution progestative
La sous-étude progestative Whistrogène plus a été arrêtée tôt. Selon la règle d'arrêt prédéfinie après un suivi moyen de 5,6 ans de traitement, le risque accru de cancer du sein invasif et d'événements cardiovasculaires a dépassé les avantages spécifiés inclus dans l'indice global. Le risque excédentaire absolu des événements inclus dans l'indice mondial était de 19 pour 10000 années pour femmes.
Pour les résultats inclus dans l'indice mondial qui a atteint une signification statistique après 5,6 ans de suivi, les risques excédentaires absolus pour 10000 ans d'années dans le groupe traités avec CE Plus MPA étaient 7 autres événements CHD 8 autres coups 10 PES supplémentaires et 8 cancers du sein invasifs supplémentaires tandis que les réductions de risques absolues pour 10000 femmes étaient 6 canaux colorectaux moins et 5 moins de canaux de hip.
Les résultats de la sous-étude progestative des œstrogènes plus qui comprenaient 16608 femmes (63 ans en moyenne de 50 à 79 ans; 83,9% blancs 6,8% noirs 5,4% hispaniques 3,9% autres) sont présentés dans le tableau 7. Ces résultats reflètent les données jugées centrales après un suivi moyen de 5,6 ans.
Tableau 7. Risque relatif et absolu observé dans l'œstrogène plus la substitution progestative de WHI à une moyenne de 5,6 ansAB
| Événement | Risque relatif CE / MPA vs placebo (95% NCIc) | CE/MPA n = 8506 | Placebo n = 8102 |
| Risque absolu pour 10000 femmes - | |||
| Coronarcha events | 1,23 (0,99 »1,53 €) | 41 | 34 |
| Mi non mortel | 1,28 (1,00 en 1,63 €) | 31 | 25 |
| Coronarcha death | 1,10 (0,70 »1,75 €) | 8 | 8 |
| Tous les coups | 1,31 (1,03 »1,68) | 33 | 25 |
| Accident vasculaire cérébral | 1,44 (1,09 »1,90 €) | 26 | 18 |
| Thrombose veineuse profonded | 1,95 (1,43 - 2,67 €) | 26 | 13 |
| Embolie pulmonaire | 2.13 (1,45 € 31 €) | 18 | 8 |
| Cancer du sein invasife | 1,24 (1,01 »1,54 €) | 41 | 33 |
| Cancer colorectal | 0,61 (0,42 »0,87) | 10 | 16 |
| Cancer de l'endomètred | 0,81 (0,48 - 1,36 €) | 6 | 7 |
| Cancer du col de l'utérusd | 1,44 (0,47 »4,42) | 2 | 1 |
| Fracture de la hanche | 0,67 (0,47 »0,96) | 11 | 16 |
| Fractures vertébralesd | 0,65 (0,46 »0,92) | 11 | 17 |
| Fractures de bras / poignet inférieuresd | 0,71 (0,59 »0,85 €) | 44 | 62 |
| Fractures totalesd | 0,76 (0,69 »0,83) | 152 | 199 |
| Mortalité globalef | 1,00 (0,83 - 1,19 €) | 52 | 52 |
| Indice mondialg | 1,13 (1,02 »1,25 €) | 184 | 165 |
| aAdapté de nombreuses publications WHI. Les publications peuvent être consultées sur www.nhlbi.nih.gov/whi. bLes résultats sont basés sur des données jugées centralement. cIntervalles de confiance nominaux (IC) non ajustés pour les looks multiples et les comparaisons multiples. dNon inclus dans l'indice global. eComprend un cancer du sein métastatique et non métastatique à l'exception du cancer du sein in situ. fTous les décès, sauf par le cancer du sein ou colorectal, la CHD définie ou probable PE ou les maladies cérébrovasculaires. gUn sous-ensemble des événements a été combiné dans un indice mondial défini comme la première occurrence d'événements CHD invasifs cancer du sein AVC embolisme pulmonaire embolie colorectale cancer de la hanche ou la mort en raison d'autres causes. |
Le moment de l'initiation de l'œstrogène plus une thérapie progestatif par rapport au début de la ménopause peut affecter le profil global des avantages du risque. La sous-étude progestative Whi œstrogène plus stratifiée par l'âge a montré chez les femmes de 50 à 59 ans une tendance non significative vers une réduction du risque de mortalité globale [rapport de risque (RH) 0,69 (IC à 95% 0,44 à 1,07)].
Whi œstrogène-subdtuse
La sous-étude des œstrogènes-œstrogènes a été arrêtée tôt car un risque accru d'AVC a été observé et il a été jugé qu'aucune autre information ne serait obtenue concernant les risques et les avantages des œstrogènes alone dans les critères d'évaluation primaires prédéterminés.
Les résultats de la sous-étude des œstrogènes qui comprenaient 10739 femmes (63 ans en moyenne de 50 à 79 ans; 75,3% blancs 15,1% noirs 6,1% hispaniques 3,6% autres) après un suivi moyen de 7,1 ans sont présentés dans le tableau 8.
Tableau 8. Risque relatif et absolu observé dans la sous-étude des œstrogènesa
| Événement | Risque relatif CE vs placebo (95% NCIb) | CE n = 5310 | Placebo n = 5429 |
| Risque absolu pour 10000 années de femmes | |||
| Coronarcha eventsc | 0,95 (0,78 - 1,16 €) | 54 | 57 |
| Mi non mortelc | 0,91 (0,73 - 1,14 €) | 40 | 43 |
| Coronarcha deathc | 1,01 (0,71 »1,43 €) | 16 | 16 |
| Tous les coupsc | 1,33 (1,05 »1,68) | 45 | 33 |
| Accident vasculaire cérébralc | 1,55 (1,19 2,1 €) | 38 | 25 |
| Thrombose veineuse profondeCD | 1,47 (1,06 »2,06) | 23 | 15 |
| Embolie pulmonairec | 1,37 (0,90 »2,07) | 14 | 10 |
| Cancer du sein invasifc | 0,80 (0,62 - 1,04 €) | 28 | 34 |
| Cancer colorectale | 1,08 (0,75 »1,55 €) | 17 | 16 |
| Fracture de la hanchec | 0,65 (0,45 € 0,94) | 12 | 19 |
| Fractures vertébralesCD | 0,64 (0,44 - 0,93 €) | 11 | 18 |
| Fractures de bras / poignet inférieuresCD | 0,58 (0,47 »0,72) | 35 | 59 |
| Fractures totalesCD | 0,71 (0,64 - 0,80 €) | 144 | 197 |
| Décès en raison d'autres causessi | 1,08 (0,88- 1,32 €) | 53 | 50 |
| Mortalité globaleCD | 1,04 (0,88- 1,22 €) | 79 | 75 |
| Indice mondialg | 1,02 (0,92 - 1,13 €) | 206 | 201 |
| aAdapté de nombreuses publications WHI. Les publications peuvent être consultées sur www.nhlbi.nih.gov/whi. bCI nominal non ajusté pour les looks multiples et les comparaisons multiples. cLes résultats sont basés sur des données jugées centralement pour un suivi moyen de 7,1 ans. DNOT inclus dans l'indice global. eLes résultats sont basés sur un suivi moyen de 6,8 ans. fTous les décès, sauf par le cancer du sein ou colorectal, la CHD définie ou probable PE ou les maladies cérébrovasculaires. gUn sous-ensemble des événements a été combiné dans un indice mondial défini comme la première occurrence d'événements CHD invasifs cancer du sein AVC embolisme pulmonaire embolie colorectale cancer de la hanche ou la mort en raison d'autres causes. |
Pour les résultats inclus dans l'indice mondial qui a atteint l'importance statistique, le risque excédentaire absolu pour 10000 années de femmes dans le groupe traité avec Ce-Alone était de 12 coups supplémentaires tandis que la réduction absolue du risque pour 10000 années de femmes était de 7 fractures de la hanche de moins.9 Le risque excédentaire absolu des événements inclus dans l'indice mondial était un 5 événements non significatifs pour 10000 années pour femmes. Il n'y avait aucune différence entre les groupes en termes de mortalité toutes causes.
Aucune différence globale pour les événements de CHD primaires (IM non mortel silencieuse MI et CHD de mort) et l'incidence invasive du cancer du sein chez les femmes recevant un CE-Alone par rapport au placebo a été rapportée dans les résultats finaux en jugement centralisé de la substandie œstrogène-alone après un suivi moyen de 7,1 ans (voir le tableau 8).
Résultats jugés centralisés pour les événements d'AVC de la sous-étude des œstrogènes après un suivi moyen de 7,1 ans n'a signalé aucune différence significative dans la distribution du sous-type de l'AVC ou de la gravité, y compris les accidents vasculaires cérébraux mortels chez les femmes recevant CE-Alone par rapport au placebo. Les œstrogènes-alone ont augmenté le risque d'AVC ischémique et cet excès était présent dans tous les sous-groupes de femmes examinées.10 (Voir tableau 8).
injections d'hydroxycobalamine
Le moment de l'initiation de la thérapie œstrogénique par rapport au début de la ménopause peut affecter le profil global des avantages du risque. La sous-étude des œstrogènes stratifiée par l'âge a montré chez les femmes de 50 à 59 ans une tendance non significative vers une réduction du risque de CHD [HR 0,63 (IC à 95% 0,36 à 1,09)] et la mortalité globale [HR 0,71 (IC à 95% 0,46 à 1,11)].
Étude de la mémoire de l'initiative de santé des femmes
L'étude aux prises avec l'oestrogène plus progestatif accessoire sur WHI a inscrit 4532 femmes ménopausées principalement en bonne santé de 65 ans et plus (47% avaient 65 à 69 ans; 35 pour cent étaient de 70 à 74 ans; 18% étaient âgés de 75 ans et plus) pour évaluer les effets de la CE quotidienne (0,625 mg) plus MPA (2.5 mg) sur les incidences (0,625 mg) plus MPA (2.5 mg) sur la CE quotidienne (0,625 mg) plus MPA (2.5 mg) sur la CE quotidienne (0,625 mg) plus MPA (2.5 mg) sur la CE quotidienne (0,625 mg) plus MPA (2.5 mg) sur la CE quotidienne (0,625 mg) plus MPA (2.5 mg) sur les incidences (0,625 mg) plus MPA (2.5 mg) sur la CE quotidienne (0,625 mg) plus démence (résultat primaire) par rapport au placebo.
Après un suivi moyen de 4 ans, le risque relatif de démence probable pour CE plus MPA par rapport au placebo était de 2,05 (IC à 95% de 1,21 à 3,48). Le risque absolu de démence probable pour CE plus MPA par rapport au placebo était de 45 contre 22 cas pour 10000 années pour femmes. La démence probable telle que définie dans cette étude comprenait la démence vasculaire de la maladie d'Alzheimer (AD) (VAD) et le type mixte (ayant des caractéristiques de la MA et de la VAD). La classification la plus courante de la démence probable dans le groupe de traitement et le groupe placebo était AD. Étant donné que l'étude auxiliaire a été menée chez les femmes de 65 à 79 ans, on ne sait pas si ces résultats s'appliquent aux femmes ménopausées plus jeunes. (Voir AVERTISSEMENTS Démence probable et PRÉCAUTIONS Utilisation gériatrique )
L'étude auxiliaire auxiliaire aux œstrogènes sur WHI a inscrit 2947 femmes postménopausées de 65 ans à l'âge de 65 ans (45 pour cent était de 75 ans et âgé de 65 ans. résultat) par rapport au placebo.
Après un suivi moyen de 5,2 ans, le risque relatif de démence probable pour CE-Alone par rapport au placebo était de 1,49 (IC à 95% de 0,83 à 2,66). Le risque absolu de démence probable pour CE-Alone par rapport au placebo était de 37 contre 25 cas pour 10000 femmes pour femmes. La démence probable telle que définie dans cette étude comprenait la AD VAD et le type mixte (ayant des caractéristiques de la MA et de la VAD). La classification la plus courante de la démence probable dans le groupe de traitement et le groupe placebo était AD. Étant donné que l'étude auxiliaire a été menée chez les femmes de 65 à 79 ans, on ne sait pas si ces résultats s'appliquent aux femmes ménopausées plus jeunes. (Voir AVERTISSEMENTS Démence probable et PRÉCAUTIONS Utilisation gériatrique )
Lorsque les données des deux populations ont été regroupées comme prévu dans le protocole WHIMS, le risque relatif global signalé de démence probable était de 1,76 (IC à 95% de 1,19 à 2,60). Les différences entre les groupes sont devenues apparentes au cours de la première année de traitement. On ne sait pas si ces résultats s'appliquent aux jeunes femmes ménopausées. (Voir AVERTISSEMENTS Démence probable et PRÉCAUTIONS Utilisation gériatrique )
Références
9. Jackson Rd et al. Effets des œstrogènes équins conjugués sur le risque de fractures et de DMO chez les femmes ménopausées atteints d'hystérectomie: résultats de l'essai randomisé de l'initiative de santé des femmes. J Bone Miner Res. 2006; 21: 817-828.
10. Hendrix SL et al. Effets des œstrogènes équins conjugués sur l'AVC dans l'initiative de santé des femmes. Circulation. 2006; 113: 2425-2434.
Informations sur les patients fou Combipatch
Combipatch
(Käm-Be Pach)
(Système transdermique d'estradiol / norethindrone acétate)
Lisez ces informations sur le patient avant de commencer à utiliser combipatch et chaque fois que vous obtenez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne prennent pas la place de parler à votre fournisseur de soins de santé de vos symptômes de ménopause ou de votre traitement.
Quelles sont les informations les plus importantes que je devrais connaître sur la combipatch (une combinaison d'hormones œstrogènes et progestantes)?
- N'utilisez pas les œstrogènes avec des progestatifs pour prévenir les crises cardiaques cardiaques AVC ou démence (déclin de la fonction cérébrale).
- L'utilisation d'oestrogènes avec des progestatifs peut augmenter vos chances d'obtenir des crises cardiaques contre le cancer du sein ou des caillots sanguins.
- L'utilisation d'oestrogènes avec des progestatifs peut augmenter vos chances d'obtenir une démence en fonction d'une étude de femmes de 65 ans ou plus.
- N'utilisez pas les œstrogènes pour prévenir les crises cardiaques de maladie cardiaque AVC ou la démence.
- L'utilisation d'œstrogènes peut augmenter vos chances d'obtenir un cancer de l'utérus (utérus).
- L'utilisation d'œstrogènes peut augmenter vos chances d'obtenir un accident vasculaire cérébral ou des caillots sanguins.
- L'utilisation d'œstrogènes peut augmenter vos chances d'obtenir une démence en fonction d'une étude de femmes de 65 ans ou plus.
- Vous et votre fournisseur de soins de santé devriez parler régulièrement de savoir si vous avez toujours besoin d'un traitement avec combipatch.
Qu'est-ce que combipatch?
Combipatch is a prescription medicine patch (Transdermal Système) that contains 2 kinds of houmones estrogen et progestin.
À quoi sert combipatch?
Combipatch is used after ménopause to:
- Réduire les bouffées de chaleur modérées à sévères
Les œstrogènes sont des hormones fabriquées par les ovaires d'une femme. Les ovaires cessent normalement de fabriquer des œstrogènes lorsqu'une femme a entre 45 et 55 ans. Cette baisse des niveaux d'oestrogène corporelle provoque le changement de vie ou de ménopause (la fin des périodes menstruelles mensuelles). Parfois, les deux ovaires sont retirés lors d'une opération avant que la ménopause naturelle n'ait lieu. La baisse soudaine des niveaux d'oestrogène provoque une ménopause chirurgicale. Lorsque les niveaux d'œstrogènes commencent à laisser tomber certaines femmes, des symptômes très inconfortables tels que des sentiments de chaleur dans le cou et la poitrine ou de forts sentiments soudains de chaleur et de transpiration (bouffées de chaleur ou rinçages chauds). Chez certaines femmes, les symptômes sont doux et ils n'auront pas besoin d'utiliser les œstrogènes. Chez d'autres femmes, les symptômes peuvent être plus graves. - Traitez les changements de ménopause modérés à sévères dans et autour de votre vagin
Vous et votre fournisseur de soins de santé devriez parler régulièrement de savoir si vous avez toujours besoin d'un traitement avec combipatch pour contrôler ces problèmes. Si vous utilisez combipatch uniquement pour traiter les changements de ménopause dans et autour de votre vagin, discutez avec votre fournisseur de soins de santé pour savoir si un produit vaginal topique serait meilleur pour vous. - Traitez certaines conditions chez les femmes avant la ménopause si leurs ovaires ne font pas suffisamment d'œstrogènes naturellement.
Vous et votre fournisseur de soins de santé devriez parler régulièrement de savoir si vous avez toujours besoin d'un traitement avec combipatch.
Qui ne devrait pas utiliser combipatch?
N'utilisez pas combipatch si vous avez été supprimé votre utérus (utérus) (hystérectomie).
Combipatch contains a progestin to decrease the chance of getting cancer of the uterus. If you do not have a uterus you do not need a progestin et you should not use Combipatch.
Ne commencez pas à utiliser combipatch si vous:
- avoir des saignements vaginaux inhabituels
Les saignements vaginaux après la ménopause peuvent être un signe d'avertissement de cancer de l'utérus (utérus). Votre fournisseur de soins de santé doit vérifier tout saignement vaginal inhabituel pour découvrir la cause. - ont actuellement ou ont eu certains cancers
Les œstrogènes peuvent augmenter les chances d'obtenir certains types de cancers, y compris le cancer du sein ou de l'utérus. Si vous avez ou avez eu un cancer, parlez avec votre fournisseur de soins de santé si vous devez utiliser combipatch. - a eu un accident vasculaire cérébral ou une crise cardiaque
- ont actuellement ou ont eu des caillots sanguins
- ont actuellement ou ont eu des problèmes de foie
- ont été diagnostiqués avec un trouble de saignement
- sont allergiques à combipatch ou à l'un de ses ingrédients
Voir the list of ingredients in Combipatch at the end of this leaflet. - Je pense que tu peux être enceinte
Combipatch is not fou pregnant women. If you Je pense que tu peux être enceinte you should have a pregnancy test et know the results. Do not use Combipatch if the test result is positive et talk to your healthcare provider.
Que dois-je dire à mon fournisseur de soins de santé avant d'utiliser combipatch?
Avant d'utiliser combipatch, dites à votre fournisseur de soins de santé si vous:
- avoir des saignements vaginaux inhabituels
Les saignements vaginaux après la ménopause peuvent être un signe d'avertissement de cancer de l'utérus (utérus). Votre fournisseur de soins de santé doit vérifier tout saignement vaginal inhabituel pour découvrir la cause. - avoir d'autres conditions médicales
- Votre fournisseur de soins de santé peut devoir vous vérifier plus attentivement si vous avez certaines conditions telles que l'asthme (respiration sifflante) épilepsie (crises) diabète de la migraine Lupus angio-œdème (gonflement du visage et de la langue) ou des problèmes avec les reins thyroïdiens du foie hépatique car
- vont subir une intervention chirurgicale ou seront sur le repos au lit
Votre fournisseur de soins de santé vous fera savoir si vous devez arrêter d'utiliser combipatch. - allaitent
Les hormones de combipatch peuvent passer dans votre lait maternel.
Parlez à votre fournisseur de soins de santé de tous les médicaments que vous prenez y compris les médicaments sur ordonnance et les médicaments sans ordonnance et les suppléments à base de plantes. Certains médicaments peuvent affecter le fonctionnement de combipatch. Le combipatch peut également affecter le fonctionnement des autres médicaments. Gardez une liste de vos médicaments et montrez-le à votre fournisseur de soins de santé et à votre pharmacien lorsque vous obtenez de nouveaux médicaments.
Comment utiliser combipatch?
- Pour des instructions détaillées, consultez les instructions étape par étape pour utiliser combipatch à la fin de ces informations du patient.
- Utilisez combipatch exactement comme votre fournisseur de soins de santé vous dit de l'utiliser.
- Combipatch is fou skin use only.
- Changez votre combipatch 2 fois par semaine ou tous les 3 à 4 jours.
- Appliquez votre combipatch sur une zone sèche propre dans le bas de l'abdomen. Cette zone doit être sèche propre et exempte d'huile de poudre ou de lotion pour que votre combipatche colle à votre peau.
- Appliquez votre combipatch dans une autre zone de votre inférieur inférieur à chaque fois. N'utilisez pas le même site d'application 2 fois au cours de la même semaine.
- N'appliquez pas de combipatch sur ou près de vos seins.
- Si vous oubliez d'appliquer un nouveau combipatch, vous devez appliquer un nouveau combipatch dès que possible.
- Une fois en place, le système transdermique ne doit pas être exposé au soleil pendant des périodes prolongées.
- Vous et votre fournisseur de soins de santé devriez parler régulièrement (tous les 3 à 6 mois) de votre dose et si vous avez toujours besoin d'un traitement avec combipatch.
Comment changer combipatch?
- Lors du changement de combipatch décollez lentement le combipatch utilisé de votre peau.
- Après avoir retiré le combipatch, vous pouvez avoir une petite quantité d'adhérence (adhésif) à gauche sur votre peau. Si vous avez de l'adhésif sur votre peau après avoir retiré le combipatch, permettez à la zone de sécher pendant 15 minutes. Frottez doucement la zone collante de votre peau avec de l'huile ou de la lotion pour éliminer l'adhésif.
- Le nouveau combipatch doit être appliqué dans une zone différente de votre bas de l'abdomen. Cette zone doit être froide à sec propre et exempte d'huile de poudre ou de lotion. Le même site ne doit pas être utilisé à nouveau pendant au moins 1 semaine après le retrait de la combipatch.
Quels sont les effets secondaires possibles de combipatch?
Les effets secondaires sont regroupés par leur gravité et à quelle fréquence ils se produisent lorsque vous êtes traité.
Les effets secondaires graves mais moins courants comprennent:
- crise cardiaque
- accident vasculaire cérébral
- caillots de sang
- démence
- cancer du sein
- Cancer de la muqueuse de l'utérus (utérus)
- cancer de l'ovaire
- hypertension artérielle
- glycémie
- maladie de la vésicule biliaire
- problèmes de foie
- Changements dans vos niveaux d'hormones thyroïdiens
- Élargissement des tumeurs bénignes de l'utérus (fibromes)
- dépression
Appelez votre fournisseur de soins de santé immédiatement si vous obtenez l'un des panneaux d'avertissement suivants ou tout autre symptôme inhabituel qui vous concerne:
- Nouveaux morceaux mammaires
- saignement vaginal inhabituel
- changements de vision ou de discours
- Nouveaux maux de tête soudains
- Douleurs sévères dans votre poitrine ou les jambes avec ou sans manque de faiblesse et de fatigue
Les effets secondaires moins graves mais communs comprennent:
- mal de tête
- douleurs au sein
- Saignement vaginal irrégulier
- Crampes à l'estomac ou abdominales
- nausée et vomissement
- perte
- rétention d'eau
- vaginl yeast infection
- rougeur ou irritation au site de placement des patchs
Ce ne sont pas tous les effets secondaires possibles de combipatch. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou à votre pharmacien. Dites à votre fournisseur de soins de santé si vous avez des effets secondaires qui vous dérangent ou ne disparaissent pas.
Vous pouvez signaler les effets secondaires à Noven au 1-800-455-8070 ou à la FDA au 1-800-FDA-1088.
Que puis-je faire pour réduire mes chances d'obtenir un effet secondaire sérieux avec combipatch?
- Parlez régulièrement avec votre fournisseur de soins de santé si vous devez continuer à utiliser combipatch.
- Voir your healthcare provider right away if you get vaginl bleeding while using Combipatch.
- Passez un examen à l'examen pelvien et une mammographie (radiographie mammaire) à moins que votre fournisseur de soins de santé ne vous dise autre chose.
- Si les membres de votre famille ont eu un cancer du sein ou si vous avez déjà eu des morceaux de sein ou une mammographie anormale, vous devrez peut-être passer des examens du sein plus souvent.
- Si vous souffrez d'hypertension artérielle élevée en cholestérol (graisse dans le sang) le diabète est en surpoids ou si vous utilisez du tabac, vous pouvez avoir des chances plus élevées d'obtenir une maladie cardiaque.
- Demandez à votre professionnel de la santé des moyens de réduire vos chances d'obtenir une maladie cardiaque.
Comment dois-je stocker et jeter le combipatch utilisé?
- Conservez la combipatche au réfrigérateur à 36 ° F à 46 ° F (2 ° C à 8 ° C). Allow patch to reach room temperature bsioue application.
- Ne stockez pas combipatch en dehors de sa pochette. Les patchs utilisés contiennent toujours des œstrogènes et des progestatifs. Pour jeter le patch, pliez le côté collant du patch ensemble, placez-le dans un conteneur robuste à l'épreuve des enfants et placez ce conteneur dans la poubelle.
- Les patchs utilisés ne doivent pas être rincés dans les toilettes.
Gardez la combipatch et tous les médicaments hors de portée des enfants.
Combien de jours pour prendre la clindamycine
Général infoumation ABout the safe et sifective use of Combipatch.
Les médicaments sont parfois prescrits pour les conditions qui ne sont pas mentionnées dans les dépliants d'information des patients. N'utilisez pas de combipatch pour les conditions pour lesquelles il n'a pas été prescrit. Ne donnez pas de combipatch à d'autres personnes même si elles présentent les mêmes symptômes que vous. Cela peut leur faire du mal.
Cette brochure fournit un résumé des informations les plus importantes sur la combipatch. Si vous souhaitez plus d'informations, parlez avec votre fournisseur de soins de santé ou pharmacien. Vous pouvez demander des informations sur la combipatch écrite pour les professionnels de la santé. Vous pouvez obtenir plus d'informations en appelant le 1-800-455-8070
Quels sont les ingrédients de combipatch?
Ingrédients actifs: estradiol et acétate de norethindrone
Ingrédients inactifs: Adhésive Adhésive Adhésive Adhésive Oléique NF Povidone USP Dipropylène glycol Polyester Libérer
Instructions pour une utilisation
Combipatch
(Käm-Be Pach)
(Système transdermique d'estradiol / norethindrone acétate)
Étape 1. Choisissez les jours où vous changerez votre combipatche.
- Vous devrez changer votre patch tous les 3 à 4 jours (deux fois par semaine).
Étape 2. Retirez le combipatch de la pochette.
Figure A
- Déchirurez-vous de la poche protectrice de la fente (n'utilisez pas de ciseaux) et retirez le patch. Voir Figure A.
- La pochette ne doit pas être ouverte tant que vous n'êtes pas prêt à mettre le patch.
Étape 3. Retirez la doublure adhésive.
Figure B
- Décollez un côté de la doublure protectrice. Voir Figure B.
- Ne touchez pas la partie collante du patch avec vos doigts. Voir Figure B.
Étape 4. Placer le combipatche sur votre peau.
Figure C
Figure D
- Mettez le côté collant du patch dans le bas de l'abdomen (sous la ligne de culotte). Voir Figure C.
- Décollez le deuxième côté de la doublure protectrice. Voir Figure C.
- Appuyez fermement sur le patch en place avec votre main pendant environ 10 secondes. Voir Figure D.
Note:
- Évitez la taille car les vêtements et les ceintures peuvent entraîner le désordre du combipatche.
- N'appliquez pas le combipatch sur ou près de vos seins.
- Appliquez uniquement le combipatch sur une peau propre et exempte de toute huile ou lotion en poudre.
- Vous ne devez pas appliquer le combipatch sur la peau brûlée ou irritée blessée ou les zones avec des affections cutanées (comme les tatouages des marques de naissance ou qui est très velue).
Étape 5. Appuyez fermement sur le combipatch sur votre peau.
Figure E
- Frottez les bords du combipatche avec vos doigts pour vous assurer qu'il collera à votre peau. Voir Figure E.
Note:
- La baignade ou la douche n'affectera pas le combipatche.
- Une fois en place, le patch ne doit pas être exposé au soleil pendant des périodes prolongées.
- Si votre combipatch tombe, réappliquez-le. Si vous ne pouvez pas réappliquer le combipatch, appliquez un nouveau combipatch dans une autre zone ( Voir Figures C D et E ) et continuer à suivre votre calendrier de placement d'origine.
- Si vous arrêtez d'utiliser votre combipatch ou oubliez d'appliquer un nouveau combipatch comme prévu, vous pouvez avoir des taches ou des saignements et vos symptômes peuvent revenir.
Étape 6. Jetant votre combipatche d'occasion.
- Quand il est temps de changer votre combipatch, supprimez l'ancien combipatch avant d'en appliquer un nouveau.
- Pour jeter le patch, pliez le côté collant du patch ensemble, placez-le dans un conteneur robuste à l'épreuve des enfants et placez ce conteneur dans la poubelle. Les patchs utilisés ne doivent pas être rincés dans les toilettes.
Ces informations et instructions pour les patients pour une utilisation ont été approuvées par la Food and Drug Administration des États-Unis.