Rebif
Les Informations Présentées Sur Ce Site Ne Constituent Pas Un Avis Médical. Nous Ne Vendons Rien. L'Exactitude De La Traduction N'Est Pas Garantie. Clause De Non-Responsabilité
Résumé
Qu'est-ce que Rebif?
L'injection Rebif (interféron bêta-1a) est faite de protéines humaines et est utilisée pour traiter la rechute sclérose en plaques (MS). Rebif ne guérira pas MS; Cela ne diminuera que la fréquence des symptômes de rechute.
Quels sont les effets secondaires du Rebif?
Rebif
- urticaire
- difficulté à respirer
- gonflement de ton visage lèvres langue ou gorge
- réaction de peau sévère
- fièvre
- mal de gorge
- Burning Eyes
- douleur cutanée
- éruption cutanée rouge ou violet avec des cloques et des pelage
- Des rougeurs gonflables de douleur suintant ou des changements de peau là où l'injection a été donnée
- étourdissement
- changements inhabituels d'humeur ou de comportement
- désespoir
- anxiété
- nervosité
- irritabilité
- dépression
- Réflexions sur le suicide
- ecchymoses faciles
- saignement inhabituel
- nausée
- perte d'appétit
- fatigue
- confusion
- ecchymoses faciles or bleeding
- urine sombre
- tabourets de couleur argile
- jaunissement de votre peau ou de vos yeux ( jaunisse )
- frissons
- tousser avec du mucus
- Diarrhée sanglante
- douleur ou brûlure lorsque vous urinez
- balançoires d'humeur
- Difficulté à dormir
- fatigue
- faim
- diarrhée
- balançoires d'humeur
- Difficulté à dormir
- fatigue
- faim
- battements cardiaques
- faiblesse musculaire
- transpiration
- peau sec
- cheveux éclaircissants
- changements menstruels
- changements de poids
- Polie dans votre visage et
- Sensibilité aux températures chaudes ou froides
Obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus.
Rebif
- urticaire
- difficulté à respirer
- gonflement de ton visage lèvres langue ou gorge
- réaction de peau sévère
- fièvre
- douloureux gorge
- Burning Eyes
- douleur cutanée
- éruption cutanée rouge ou violet avec des cloques et des pelage
- Des rougeurs gonflables de douleur suintant ou des changements de peau là où l'injection a été donnée
- étourdissement
- changements inhabituels d'humeur ou de comportement
- désespoir
- anxiété
- nervosité
- irritabilité
- dépression
- Réflexions sur le suicide
- ecchymoses faciles
- saignement inhabituel
- nausée
- perte d'appétit
- fatigue
- confusion
- ecchymoses faciles or bleeding
- urine sombre
- tabourets de couleur argile
- jaunissement de votre peau ou de vos yeux (jaunisse)
- frissons
- tousser avec du mucus
- Diarrhée sanglante
- douleur ou brûlure lorsque vous urinez
- balançoires d'humeur
- Difficulté à dormir
- fatigue
- faim
- diarrhée
- balançoires d'humeur
- Difficulté à dormir
- fatigue
- faim
- battements cardiaques
- faiblesse musculaire
- transpiration
- peau sec
- cheveux éclaircissants
- changements menstruels
- changements de poids
- Polie dans votre visage et
- Sensibilité aux températures chaudes ou froides
Obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus.
Dites à votre médecin si vous avez des effets secondaires graves de Rebif, notamment:
- changements mentaux / d'humeur (par exemple, dépression pensées rares du suicide)
- changements de vision
- Changement progressif de poids
- intolérance au froid ou à la chaleur
- Augmentation de la miction
- pus ou changement de couleur de peau sur le site d'injection
- Signes d'infection (par exemple la fièvre persistante mal de gorge toux)
- ecchymoses faciles or bleeding
- rythme cardiaque rapide ou irrégulier
- Augmentation soudaine du poids
- les mains / jambes gonflées / pieds
- Douleurs abdominales sévères ou abdominales
- jaunissant les yeux ou la peau ou
- urine sombre.
Les effets secondaires courants de Rebif comprennent:
- douleur
- gonflement ou rougeur sur le site d'injection
- Symptômes pseudo-grippaux tels que:
- mal de tête
- vertiges
- fatigue
- fièvre
- frissons
- douleurs à l'estomac
- coulant ou nez encombré et
- Les douleurs musculaires peuvent se produire lorsque vous commencez pour la première fois
Ces symptômes s'améliorent généralement ou disparaissent après quelques mois d'utilisation continue de Rebif. Certains patients utilisant des médicaments d'interféron tels que Rebif deviennent déprimés ou ont des pensées suicidaires. Dites immédiatement à votre médecin si cela se produit.
Cherchez des soins médicaux ou appelez le 911 à la fois si vous avez les effets secondaires graves suivants:
- Des symptômes oculaires graves tels que la perte de vision soudaine floue du tunnel de vision de la vision de la vision des yeux ou de l'enflure ou de voir des halos autour des lumières;
- Symptômes cardiaques graves tels que les battements cardiaques rapides ou battants; flotter dans votre poitrine; essoufflement; et des étourdissements soudains, de la légèreté ou de l'évanouissement;
- Maux de tête sévères Confusion Slurred Speech Bras ou Ligne Proulitude Trouble de la merde Perte de coordination Sentiment des muscles très rigides très rigides Fièvre élevée Propice ou des tremblements.
Ce document ne contient pas tous les effets secondaires possibles et d'autres peuvent survenir. Vérifiez auprès de votre médecin des informations supplémentaires sur les effets secondaires.
Dosage pour Rebif
La dose recommandée de Rebif est de 22 mcg à 44 mcg injectée par voie sous-cutanée trois fois par semaine. Rebif est destiné à être utilisé sous la supervision d'un médecin. Les patients ne peuvent s'auto-injecter qu'après une formation appropriée.
Quelles substances ou suppléments de médicaments interagissent avec Rebif?
Le Rebif peut interagir avec d'autres médicaments. Dites à votre médecin tous les médicaments et suppléments que vous prenez. Parlez à votre médecin de la façon de boire de l'alcool en toute sécurité lors de l'utilisation de ce médicament.
Rebif pendant la grossesse et l'allaitement
Le Rebif ne doit pas être utilisé pendant la grossesse. Parlez à votre médecin si vous êtes enceinte ou pensez que vous pourriez devenir enceinte pendant le traitement. Consultez votre médecin avant l'allaitement.
Informations Complémentaires
Notre centre de médicaments sur les effets secondaires de l'injection Rebif (interféron bêta-1a) offre une vue complète des informations sur les médicaments disponibles sur les effets secondaires potentiels lors de la prise de ce médicament.
Informations sur les médicaments de la FDA
- Description de la drogue
- Indications
- Effets secondaires
- Avertissements
- Surdosage
- Pharmacologie clinique
- Guide des médicaments
Description de Rebif
Rebif (interféron bêta-1a) est une glycoprotéine purifiée 166 acides aminés avec un poids moléculaire d'environ 22500 daltons. Il est produit par la technologie d'ADN recombinant en utilisant des cellules ovaires de hamster chinois génétiquement modifiées dans lesquelles le gène bêta de l'interféron humain a été introduit. La séquence des acides aminés de Rebif est identique à celle de l'interféron humain dérivé des fibroblastes naturels bêta. L'interféron bêta et l'interféron bêta-1a (Rebif) sont glycosylés avec chacun contenant une seule fraction complexe liée à N.
Utilisation d'une norme de référence calibrée par rapport à la norme Beta Interferon Beta de l'Organisation mondiale de la santé (deuxième norme internationale pour les fibroblastes humains interféron GB 23 902 531) Rebif a une activité spécifique d'environ 270 millions d'unités internationales (MIU) de antiviral Activité par mg d'interféron bêta-1a in vitro Effet cytopathique Bio-Assay en utilisant les cellules de souhait et le virus de la stomatite vésiculaire. REBIF 8,8 MCG 22 MCG et 44 MCG contient environ 2,4 millions d'unités internationales 6 millions d'unités internationales ou 12 millions d'unités internationales respectivement d'activité antivirale en utilisant cette méthode.
Le Rebif (interféron bêta-1a) est formulé comme une solution stérile dans une seringue préreffilée ou un auto-injecteur de Rebif Rebidose destiné à l'injection sous-cutanée (SC). Chaque 0,5 ml (0,5 cc) de Rebif contient 22 mcg ou 44 mcg d'interféron bêta-1a 2 mg ou 4 mg d'albumine (humain) 27,3 mg de mannitol 0,4 mg d'acétate de sodium et d'eau pour l'injection. Chaque 0,2 ml (0,2 cc) de Rebif contient 8,8 mcg d'interféron bêta-1a 0,8 mg d'albumine (humain) 10,9 mg de mannitol 0,16 mg d'acétate de sodium et d'eau pour l'injection.
Utilisations pour Rebif
Rebif est indiqué pour le traitement des formes rechutes de sclérose en plaques (SEP) pour inclure une maladie de réduction du syndrome cliniquement isolé et une maladie progressive secondaire active chez l'adulte.
Effets secondaires de Seroquel xr 50mg
Dosage pour Rebif
Dossing Information
La dose recommandée de Rebif est soit 22 mcg ou 44 mcg injectée par voie sous-cutanée trois fois par semaine. Rebif devrait être administré si possible en même temps (de préférence en fin d'après-midi ou en soirée) les trois mêmes jours (par exemple le lundi mercredi et vendredi) au moins 48 heures d'intervalle chaque semaine.
Généralement, les patients doivent être démarrés à 20% de la dose prescrite trois fois par semaine et ont augmenté sur une période de 4 semaines jusqu'à la dose ciblée soit 22 mcg trois fois par semaine (voir tableau 1) ou 44 mcg trois fois par semaine (voir tableau 2). Les patients ont prescrit une dose ciblée de 22 mcg trois fois par semaine devraient utiliser les seringues préremplies pour le titrage.
Un pack de titrage contenant 6 doses de 8,8 mcg (0,2 ml) et 6 doses de 22 mcg (0,5 ml) est disponible pour une utilisation pendant la période de titrage dans les seringues préfilées Rebif et les auto-injecteurs Rebif Rebidose.
Tableau 1: Calendrier de titrage pour une dose prescrite de 22 mcg *
| Semaine d'utilisation | Dose | Seringue à utiliser | Quantité de seringue |
| Titre de la semaine 1 | 4.4 MCG | Syringe 8.8 MCG | Utiliser la moitié de la seringue |
| Titre de la semaine 2 | 4.4 MCG | Syringe 8.8 MCG | Utiliser la moitié de la seringue |
| Titre de la semaine 3 | 11 MCG | Syringe 22 MCG | Utiliser la moitié de la seringue |
| Titre de la semaine 4 | 11 MCG | Syringe 22 MCG | Utiliser la moitié de la seringue |
| Semaine 5 et après | 22 MCG | Syringe 22 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| * Utilisez uniquement des seringues préremplies et non des auto-injecteurs pour titrer à la dose prescrite de 22 MCG |
Tableau 2: Calendrier de titrage pour une dose prescrite de 44 MCG **
| Semaine d'utilisation | Dose | Seringue ou auto-injecteur à utiliser | Quantité de seringue or autoinjector |
| Titre de la semaine 1 | 8,8 MCG | Syringe 8.8 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Titre de la semaine 2 | 8,8 MCG | Syringe 8.8 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Titre de la semaine 3 | 22 MCG | Syringe 22 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Titre de la semaine 4 | 22 MCG | Syringe 22 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Semaine 5 et après | 44 MCG | 44 MCG syringe or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| ** Des seringues ou auto-injecteurs préfabillés peuvent être utilisés pour titrer la dose prescrite de 44 MCG |
Une diminution des numéros sanguins périphériques ou des tests de fonction hépatique élevés peuvent nécessiter une réduction de la dose ou un arrêt de l'administration Rebif jusqu'à ce que la toxicité soit résolue [voir Avertissements et précautions et Effets indésirables ].
Instructions d'administration importantes
Rebif est destiné à être utilisé sous la direction et la supervision d'un médecin. Il est recommandé que les médecins ou le personnel médical qualifié entraînent des patients à la bonne technique d'auto-administration des injections sous-cutanées en utilisant la seringue pré-remplie ou le dispositif d'injection approuvé pour une utilisation avec Rebif. La profondeur d'injection de l'auto-injecteur Rebif Rebidose est fixée à 8 mm; Le fournisseur de soins de santé doit déterminer la technique d'injection.
L'injection initiale doit être effectuée sous la supervision d'un fournisseur de soins de santé approprié.
Des instructions appropriées pour l'auto-injection ou l'injection par une autre personne doivent être fournies au patient ou à son soignant, y compris un examen minutieux du Guide des médicaments Rebif et des instructions d'auto-injecteur de Rebif Rebidose pour une utilisation qui accompagne le produit. Les utilisateurs doivent faire preuve de compétence dans tous les aspects de l'injection avant une utilisation indépendante. Si un patient doit s'auto-administrer Rebif, la capacité physique et cognitive de ce patient à s'auto-administrer et à éliminer correctement des seringues préremplies ou les auto-injecteurs Rebifs Rebidose doivent être évalués. Les patients atteints de déficits neurologiques graves ne doivent pas être injetés à l'auto-administration sans l'aide d'un soignant qualifié.
Conseiller les patients et les soignants à:
- Inspectez visuellement le Rebif pour les particules et la décoloration avant l'administration
- Utilisez une technique aseptique lors de l'administration de Rebif
- faire tourner le site d'injection à chaque dose pour minimiser la probabilité de réactions sévères du site d'injection, y compris la nécrose ou l'infection localisée [voir Avertissements et précautions ]
- Utilisez un conteneur résistant à la crevaison pour une élimination sûre des aiguilles utilisées et des auto-injecteurs Rebif Rebidose
- Ne réutilisez pas les seringues à aiguilles ou les auto-injecteurs Rebif Rebidose
Prémédication pour les symptômes pseudo-grippaux
L'utilisation concomitante d'analgésiques et / ou d'antipyrétiques peut aider à améliorer les symptômes pseudo-grippaux associés à l'utilisation du Rebif les jours de traitement.
Comment fourni
Formes et forces posologiques- Injection: 8,8 mcg par 0,2 ml dans une seringue préfabillée à dose unique graduée
- Injection: 22 mcg par 0,5 ml dans une seringue pré-remplie à dose monochée graduée
- Injection: 44 mcg par 0,5 ml dans une seringue préfabillée à dose unique graduée
- Injection: 8,8 mcg par 0,2 ml dans un auto-injecteur Rebif Rebif à dose unique
- Injection: 22 mcg par 0,5 ml dans un auto-injecteur Rebif Rebif préfabillé à dose
- Injection: 44 mcg par 0,5 ml dans un auto-injecteur Rebif Rebif à dose unique
Stockage et manipulation
Rebif est fourni comme une solution stérile ne contenant aucun conservateur disponible dans les présentations de package suivantes:
Seringues préremplies
Rebif (interféron bêta -1a) pack de titres NDC 44087-8822-1
- Six seringues préfabillées Rebif 8,8 MCG et six seringues préfabillées Rebif 22 MCG
Rebif (interféron bêta -1a) 22 MCG Séringe prérempli
Douze seringues pré-remplies de 22 MCG NDC 44087-0022-3
Rebif (interféron bêta -1a) 44 seringue préreadis MCG
Douze seringues pré-remplies de Rebif 44 MCG NDC 44087-0044-3
Rebif Rebidose Autoinjectors
Rebif Rebidose (interféron bêta-1a) pack de titres NDC 44087-0188-1
- Six auto-injecteurs Rebif Rebidose 8.8 MCG avec boutons d'injecteur à chaux et six boutons Rebif Rebidose 22 mcg avec des boutons d'injecteur jaune.
Rebif Rebidose (interféron bêta-1a) 22 MCG auto-injecteur
Douze auto-injecteurs Rebif Rebidose 22 MCG avec boutons d'injecteur jaune NDC 44087-3322-1
Rebif Rebidose (interféron bêta-1a) 44 auto-injecteur MCG
Douze auto-injecteurs Rebif Rebidose 44 MCG avec des boutons d'injecteur vert tualaire NDC 44087-3344-1
Rebif should be stored refrigerated between 36°F to 46°F (2°C to 8°C). DO NOT FREEZE. If needed Rebif may be stored between 36°F to 77°F (2°C to 25°C) for up to 30 days et away from heat et light but refrigeration is preferred.
N'utilisez pas au-delà de la date d'expiration imprimée sur des packages. Rebif ne contient aucun conservateur. Chaque seringue préreffilée et auto-injecteur Rebif Rebidose est destinée à une seule dose. Des portions inutilisées doivent être jetées.
Fabriqué par EMD Serono Inc. Rockland MA 02370 Licence américaine
Effets secondaires pour Rebif
Les effets indésirables suivants sont discutés plus en détail dans la section des avertissements et précautions de l'étiquette:
- Dépression et suicide [voir Avertissements et précautions ]
- Blessure hépatique [voir Avertissements et précautions ]
- Anaphylaxie et autres réactions allergiques [voir Avertissements et précautions ]
- Réactions du site d'injection, y compris la nécrose [voir Avertissements et précautions ]
- Diminution des numéros sanguins périphériques [voir Avertissements et précautions ]
- Microangiopathie thrombotique [voir Avertissements et précautions ]
- Hypertension artérielle pulmonaire [voir Avertissements et précautions ]
- Convulsions [voir Avertissements et précautions ]
- Tests de laboratoire [voir Avertissements et précautions ]
Expérience d'essai clinique
Étant donné que les essais cliniques sont menés dans des conditions de réaction indésirables très variables observées dans les essais cliniques de Rebif ne peuvent pas être directement comparées aux taux dans les essais cliniques d'autres médicaments et peuvent ne pas refléter les taux observés dans la pratique.
Un total de 712 patients atteints de sclérose en plaques rémittentes (RRMS) dans deux essais cliniques contrôlés ont pris le Rebif (22 mcg ou 44 mcg donné trois fois par semaine) [voir Études cliniques ]. Ages ranged from 18 to 55 years. Nearly three-fourths of the patients were female et more than 90% were Caucasian largely reflecting the general demographics of the population of patients with sclérose en plaques.
Les effets indésirables les plus couramment rapportés étaient les troubles du site d'injection Symptômes de type grippe (Maux de tête Fatigue Fièvre Rigors La douleur thoracique Douleur de dos Myalgie) Douleur abdominale Dépression Élévation des enzymes hépatiques et des anomalies hématologiques. Les réactions indésirables les plus fréquemment rapportées entraînant une intervention clinique (par exemple, l'arrêt de l'ajustement du Rebif dans la posologie ou la nécessité de médicaments concomitants pour traiter une réaction indésirable étaient les troubles du site d'injection des symptômes de type grippe et l'élévation des enzymes hépatiques [voir le site Avertissements et précautions ].
L'étude 1 était une étude contrôlée par un placebo de 2 ans chez les patients atteints de SRRM traités par Rebif 22 MCG (n = 189) 44 MCG (n = 184) ou placebo (n = 187). Le tableau 3 énumère les effets indésirables et les anomalies de laboratoire qui se sont produites à une incidence qui était au moins 2% de plus dans l'un ou l'autre groupe traité par Rebif que celle observée dans le groupe placebo.
Tableau 3: Réactions indésirables et anomalies de laboratoire dans l'étude 1
| Système corporel Terme préféré | Placebo tiw (n = 187)% | Rebif 22 MCG tiw (n = 189)% | Rebif 44 MCG tiw (n = 184)% |
| Le corps dans son ensemble | |||
| Symptômes de la grippe | 51 | 56 | 59 |
| Mal de tête | 63 | 65 | 70 |
| Fatigue | 36 | 33 | 41 |
| Fièvre | 16 | 25 | 28 |
| Rigueurs | 5 | 6 | 13 |
| Douleur thoracique | 5 | 6 | 8 |
| Malaise | 1 | 4 | 5 |
| Troubles du site d'injection | |||
| Réaction du site d'injection | 39 | 89 | 92 |
| Nécrose du site d'injection | 0 | 1 | 3 |
| Troubles du système nerveux | |||
| Hypertension | 5 | 7 | 6 |
| Coordination anormale | 2 | 5 | 4 |
| Convulsions | 2 | 5 | 4 |
| Somnolence | 1 | 4 | 5 |
| Troubles endocriniens | |||
| Trouble thyroïdien | 3 | 4 | 6 |
| Troubles du système gastro-intestinal | |||
| Douleurs abdominales | 17 | 22 | 20 |
| Bouche sèche | 1 | 1 | 5 |
| Troubles du système hépatique et biliaire | |||
| SGPT a augmenté | 4 | 20 | 27 |
| SGOT a augmenté | 4 | 10 | 17 |
| Bilirubinémie | 1 | 3 | 2 |
| Troubles du système musculo-squelettique | |||
| Myalgie | 20 | 25 | 25 |
| Maux de dos | 20 | 23 | 25 |
| Douleur squelettique | 10 | 15 | 10 |
| Troubles hématologiques | |||
| Leucopénie | 14 | 28 | 36 |
| Lymphadénopathie | 8 | 11 | 12 |
| Thrombocytopénie | 2 | 2 | 8 |
| Anémie | 3 | 3 | 5 |
| Troubles de la peau | |||
| Érythémateux téméraire | 3 | 7 | 5 |
| Éruption cutanée | 2 | 5 | 4 |
| Hyperhidrose | 2 | 4 | 4 |
| Troubles du système urinaire | |||
| Fréquence de miction | 4 | 2 | 7 |
| Incontinence urinaire | 2 | 4 | 2 |
| Troubles de la vision | |||
| Vision anormale | 7 | 7 | 13 |
| Xérophtalmie | 0 | 3 | 1 |
Les effets indésirables de l'étude 2 a un an à contrôle actif (vs interféron bêta-1a 30 mcg une fois par injection intramusculaire hebdomadaire n = 338), y compris 339 patients atteints de SEP traités par Rebif étaient généralement similaires à ceux de l'étude 1 en tenant compte de la disparité des durées d'étude.
Immunogénicité
L'anaphylaxie et d'autres réactions allergiques ont été observées avec l'utilisation de Rebif [voir Avertissements et précautions ]. As with all therapeutic proteins there is a potential for immunogenicity. In Study 1 the presence of neutralizing antibodies (NAb) to Rebif was determined by collecting et analyzing serum pre-study et at 6 month time intervals during the 2 years of the clinical trial. Serum NAb were detected in 59/189 (31%) et 45/184 (24%) of Rebif-treated patients at the 22 MCG et 44 MCG three times per week doses respectively at one or more times during the study. The data reflect the percentage of patients whose test results were considered positive for antibodies to Rebif using an antiviral cytopathic effect assay et are highly dependent on the sensitivity et specificity of the assay. Additionally the observed incidence of NAb positivity in an assay may be influenced by several factors including sample hetling timing of sample collection concomitant medications et underlying disease. For these reasons comparison of the incidence of antibodies to Rebif with the incidence of antibodies to other products may be misleading.
Expérience de commercialisation de la poste
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Rebif. Étant donné que ces réactions sont rapportées volontairement d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale à l'exposition au médicament.
Troubles auto-immunes: Induit lupus hépatite auto-immune érythémateuse
Troubles oculaires: Troubles vasculaires rétiniens (c'est-à-dire les taches de coton de rétinopathie ou obstruction de l'artère ou de la veine rétinienne)
Troubles thoraciques et médiastinaux respiratoires: Hypertension artérielle pulmonaire
Troubles de la peau et des tissus sous-cutanés: Erythème multiforme Syndrome de Stevens-Johnson
Troubles du système sanguin et lymphatique: Anémie hémolytique
Interactions médicamenteuses pour Rebif
Aucune information fournie
Avertissements pour Rebif
Inclus dans le cadre du PRÉCAUTIONS section.
Précautions pour Rebif
Dépression et suicide
Rebif (interféron bêta-1a) should be used with caution in patients with dépression a condition that is common in people with sclérose en plaques. Depression suicidal ideation et suicide attempts have been reported to occur with increased frequency in patients receiving interferon compounds including Rebif. In addition there have been postmarketing reports of suicide in patients treated with Rebif. Patients should be advised to report immediately any symptoms of dépression et/or suicidal ideation to the prescribing physician. If a patient develops dépression cessation of treatment with Rebif should be considered.
Blessure hépatique
Des lésions hépatiques graves, y compris certains cas d'insuffisance hépatique, nécessitant une transplantation hépatique, ont été rapportées rarement chez les patients prenant Rebif. Les symptômes de la dysfonction hépatique ont commencé de un à six mois après l'initiation du Rebif. Si jaunisse ou d'autres symptômes de dysfonctionnement hépatique semblent que le traitement avec le REBIF devrait être interrompu immédiatement en raison du potentiel de progression rapide vers une insuffisance hépatique.
L'élévation asymptomatique des transaminases hépatiques (en particulier le SGPT) est courante avec la thérapie par interféron [voir Effets indésirables ]. Le REBIF doit être initié avec prudence chez les patients atteints d'une abus d'alcool de maladie du foie active a augmenté le SGPT sérique (> 2,5 fois ULN) ou des antécédents d'une maladie hépatique importante. Le risque potentiel de Rebif utilisé en combinaison avec des produits hépatotoxiques connus doit également être pris en compte avant l'administration Rebif ou lors de l'ajout de nouveaux agents au régime de patients déjà sous Rebif. La réduction de la dose de Rebif doit être envisagée si le SGPT dépasse 5 fois la limite supérieure de la normale. La dose peut être progressivement réescalade lorsque les niveaux enzymatiques se sont normalisés [voir Avertissements et précautions et Posologie et administration ].
Anaphylaxie et autres réactions allergiques
L'anaphylaxie a été signalée comme une complication rare de l'utilisation du Rebif. D'autres réactions allergiques ont inclus une éruption cutanée et une urticaire et ont varié de légers à sévère sans une relation claire avec la dose ou la durée d'exposition. Plusieurs réactions allergiques dont certaines sont graves se sont produites après une utilisation prolongée. Arrêtez le Rebif si l'anaphylaxie se produit.
Réaction du site d'injections Including Necrosis
Les réactions du site d'injection, y compris la nécrose du site d'injection, peuvent se produire avec l'utilisation de produits bêta d'interféron, y compris le Rebif. Dans les essais cliniques contrôlés, les réactions du site d'injection se sont produites plus fréquemment chez les patients traités par Rebif (92% dans le groupe 44 MCG et 89% dans le groupe 22 MCG) que chez les patients traités par placebo (39%) et à une fréquence plus élevée chez les patients traités par Rebif (83%) que chez les patients traités par Avonex (28%). La nécrose du site d'injection s'est également produite plus fréquemment chez les patients traités par Rebif (3% dans le groupe 44 MCG et 1% dans le groupe 22 MCG) que chez les patients traités par placebo (0) pendant les deux années de traitement.
Les réactions du site d'injection, notamment le site d'injection, l'abcès de la cellulite de l'œdème érythème et de la nécrose ont été signalées dans le cadre du marché postal. Certains se sont produits plus de 2 ans après le début du Rebif. La nécrose s'est produite sur des sites d'injection unique et multiples. Certains cas de nécrose du site d'injection ont nécessité un traitement avec des antibiotiques intraveineux et une intervention chirurgicale (débridement et greffe cutanée). Certains cas d'abcès du site d'injection et de cellulite ont nécessité un traitement par hospitalisation pour le drainage chirurgical et les antibiotiques intraveineux.
La compréhension et l'utilisation des techniques et procédures d'auto-injection aseptique doivent être évaluées périodiquement, en particulier si la nécrose du site d'injection s'est produite. Les patients doivent être informés de l'importance des sites rotatifs d'injection à chaque dose et de ne pas réutiliser des seringues. Les patients doivent être invités à injecter une zone qui est enflammée erythémateuse érythémateuse ou a d'autres signes d'infection. Ces panneaux doivent être signalés immédiatement à un professionnel de la santé. Si plusieurs lésions se produisent, changent de site d'injection ou interrompre le traitement jusqu'à la guérison.
Diminution des numéros sanguins périphériques
Une diminution de la numération sanguine périphérique dans toutes les lignées cellulaires, y compris la pancytopénie, a été signalée chez les patients traités par Rebif. Dans les essais cliniques contrôlés, la leucopénie s'est produite à une fréquence plus élevée chez les patients traités par Rebif (36% dans 44 MCG et 28% dans le groupe 22 MCG) que chez les patients traités par placebo (14%) et à une fréquence plus élevée chez les patients traités par Rebif (6%) par rapport aux patients traités par Avonex (<1%). Thrombocytopénie et anemia occurred more frequently in 44 MCG Rebif-treated patients (8% et 5% respectively) than in placebo-treated patients (2% et 3% respectively). In a pooled analysis of 7 placebo controlled trials with Rebif doses of 22 MCG or 44 MCG the rate of pancytopenia (in subjects with normal baseline values who developed laboratory values less than the lower limit of normal for all 3 hematology parameters simultaneously) was higher in the total Rebif group (5.5 per 1000 subject-year) than in the placebo group (1.2 per 1000 subject-year). Patients should be monitored for symptoms or signs of decreased blood counts. Monitoring of complete blood et differential white blood cell counts is also recommended [see Posologie et administration et Avertissements et précautions ].
Microangiopathie thrombotique
Cas de microangiopathie thrombotique (TMA) purpura thrombotique thrombocytopénique et hemolytic uremic syndrome some fatal have been reported with interferon beta products including Rebif. Cases have been reported several weeks to years after starting interferon beta products. Discontinue Rebif if clinical symptoms et laboratory findings consistent with TMA occur et manage as clinically indicated.
Hypertension artérielle pulmonaire
Des cas d'hypertension artérielle pulmonaire (HAP) ont été signalés avec des produits bêta d'interféron, notamment Rebif. La HAP s'est produite chez les patients traités avec des produits bêta d'interféron en l'absence d'autres facteurs contributifs. De nombreux cas signalés ont nécessité une hospitalisation, y compris un cas avec l'interféron bêta dans lequel le patient a subi une greffe pulmonaire. La HAP s'est développée à divers moments après avoir lancé une thérapie avec des produits bêta d'interféron et peut se produire plusieurs années après le début du traitement.
Les patients qui développent des symptômes inexpliqués (par exemple la dyspnée nouvelle ou l'augmentation de la fatigue) doivent être évalués pour la HAP. Si des étiologies alternatives ont été exclues et qu'un diagnostic de HAP est confirmé, interrompre le traitement et gérer comme indiqué cliniquement.
Crises
La prudence doit être exercée lors de l'administration de Rebif aux patients atteints de troubles de crise préexistants. Les crises ont été temporellement associées à l'utilisation d'interférons bêta, notamment le Rebif dans les essais cliniques et dans les rapports de commercialisation de la post-commercialisation.
Tests de laboratoire
En plus des tests de laboratoire, normalement nécessaires pour surveiller les patients atteints de la nombre de cellules sanguines de sclérose en plaques et des tests de la fonction hépatique, sont recommandés à intervalles réguliers (1 3 et 6 mois) après l'introduction du thérapie Rebif, puis périodiquement par la suite en l'absence de symptômes cliniques. Les patients atteints de myélosuppression peuvent nécessiter une surveillance plus intensive du nombre complet de cellules sanguines avec des dénombrements différentiels et plaquettaires [voir Posologie et administration UN Avertissements et précautions ]. New or worsening thyroid abnormalities have developed in some patients treated with Rebif. Thyroid function tests are recommended every 6 months in patients with a history of thyroid dysfunction or as clinically indicated.
Informations de conseil des patients
Voir l'étiquetage des patients approuvé par la FDA ( Guide des médicaments ).
Informez les patients de la disponibilité d'un guide de médicaments et demandez-leur de lire le guide de médicaments avant de prendre Rebif. Demandez aux patients de prendre le Rebif uniquement comme prescrit.
Dépression et suicide
Conseillent les patients que la dépression des idées suicidaires et du suicide ont été signalés lors de l'utilisation de Rebif. Informer les patients des symptômes de la dépression et des idées suicidaires et de demander aux patients de signaler immédiatement l'un de ces symptômes à leur fournisseur de soins de santé [voir Avertissements et précautions ].
Blessure hépatique
Conseillez les patients selon lesquels une lésion hépatique sévère, y compris une insuffisance hépatique, a été signalée avec l'utilisation de Rebif. Éduquer les patients sur les symptômes des blessures hépatiques et demander aux patients de les signaler immédiatement à leur fournisseur de soins de santé [voir Avertissements et précautions ].
Anaphylaxie et autres réactions allergiques
Informer les patients des symptômes des réactions allergiques et de l'anaphylaxie et demandez aux patients de consulter des soins médicaux immédiats si ces symptômes se produisent [voir Avertissements et précautions ].
Réaction du site d'injections Including Necrosis
Conseiller les patients que les réactions du site d'injection se produisent chez la plupart des patients traités par Rebif et que la nécrose du site d'injection peut se produire [voir Avertissements et précautions ]. Instruct patients to promptly report any break in the skin which may be associated with blue-black discoloration swelling or drainage of fluid from the injection site prior to continuing their Rebif therapy.
Pour minimiser la probabilité de réactions du site d'injection, informer les patients de l'importance des sites d'injection rotatifs à chaque dose et l'utilisation de la technique d'injection aseptique [voir Posologie et administration ]. Advise patients not to re-use needles or syringes et instruct patients on safe disposal procedures. Provide appropriate instruction for self-injection of Rebif et Rebif Rebidose including careful review of the Rebif Guide des médicaments.
Diminution des numéros sanguins périphériques
Informer les patients qu'ils peuvent développer une baisse de leurs numéros sanguins périphériques, y compris leur nombre de sang blancs, les numéros de sang rouge et les plaquettes et que leur nombre de sang sera vérifié pendant le traitement avec Rebif. Informer les patients qu'ils peuvent être plus susceptibles d'obtenir une anémie des infections ou d'être à risque de saignement et qu'ils devraient contacter leur fournisseur de soins de santé s'ils développent des symptômes de ces effets indésirables [voir Avertissements et précautions ].
Hypertension artérielle pulmonaire
Informez les patients que l'HAP s'est produit chez les patients traités avec des produits bêta d'interféron, notamment Rebif. Demandez aux patients de signaler rapidement de nouveaux symptômes tels que la fatigue nouvelle ou l'augmentation ou l'essoufflement à leur fournisseur de soins de santé [voir Avertissements et précautions ].
Crises
Demandez aux patients de signaler immédiatement les crises à leur fournisseur de soins de santé [voir Avertissements et précautions ].
Symptômes pseudo-grippaux
Informer les patients que les symptômes pseudo-grippaux sont courants après le début du traitement avec le Rebif. Informer les patients que l'utilisation concomitante d'analgésiques et / ou d'antipyrétiques peut aider à réduire les symptômes pseudo-grippaux les jours de traitement [voir Posologie et administration ].
où acheter l'extrait de Tongkat Ali
Grossesse
Conseiller aux patients de notifier leur fournisseur de soins de santé s'ils tombent enceintes pendant le traitement ou prévoient de devenir enceintes [voir Utiliser dans des populations spécifiques ].
Toxicologie non cliniqueCarcinogenèse Mutagenèse A trouble de la fertilitéCancérogenèse
Cancérogenèse
Rebif has not been tested for carcinogenic potential in animals.
Mutagenèse
L'interféron bêta était négatif dans un essai de mutation inverse bactérienne in vitro (AMES) et un test cytogénétique in vitro dans les lymphocytes humains en présence et l'absence d'activation métabolique.
Altération de la fertilité
Dans des études de singes cynomolgus normalement cyclistes, des injections sous-cutanées quotidiennes d'interféron bêta pendant six mois à des doses allant jusqu'à 9 fois la dose humaine hebdomadaire recommandée (sur la base de la surface du corps), aucun effet n'a été observé sur le cycle menstruel ou les taux d'estradiol sérique. Chez les singes masculins, les mêmes doses d'interféron bêta n'ont eu aucun effet indésirable démontrable sur la morphologie ou la fonction de motilité du nombre de spermatozoïdes.
Utiliser dans des populations spécifiquesGrossesseRésumé des risques
Résumé des risques
Les données d'une grande étude de cohorte basée sur la population ainsi que d'autres études publiées au cours de plusieurs décennies n'ont pas identifié de risque associé aux médicaments de malformations congénitales importantes avec l'utilisation de l'interféron bêta au début de la grossesse. Les résultats concernant un risque potentiel de faible poids à la naissance ou de fausse couche avec l'utilisation de l'interféron bêta pendant la grossesse ont été incohérents (voir Données ). It is unclear whether as a class of products administration of interferon beta therapies to pregnant animals at doses greater than those used clinically results in an increased rate of abortion. The potential for Rebif to have adverse effects on embryofetal development has not been fully assessed in animals [see Données ].
Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est respectivement de 2% à 4% et 15% à 20%. Le risque de fond de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnue.
Données
Données humaines
La majorité des études d'observation signalant des grossesses exposées aux produits bêta d'interféron n'a pas identifié d'association entre l'utilisation de produits bêta d'interféron en début de grossesse et un risque accru de malformations congénitales majeures.
Dans une étude de cohorte basée sur la population menée en Finlande et en Suède, des données ont été collectées à partir de 1996 en 2014 en Finlande et à partir de 2005 2014 en Suède sur 2831 résultats de grossesse de femmes atteintes de SEP. 797 grossesses étaient chez des femmes exposées à l'interféron bêta uniquement. Aucune preuve n'a été trouvée d'un risque accru de malformations congénitales majeures chez les femmes atteintes de SEP exposées à des produits bêta d'interféron par rapport aux femmes atteintes de SEP qui n'étaient pas exposées à toute thérapie non stéroïdienne pour la SEP (n = 1647) au sein de l'étude. Aucun risque accru n'a été observé pour les fausses couches et les grossesses extraordinaires, mais il y avait des limites à l'obtention d'une capture complète des données pour ces résultats, ce qui rend l'interprétation des résultats plus difficile.
Deux petites études de cohorte qui ont examiné les grossesses exposées aux produits bêta d'interféron (sans différencier les sous-types de produits bêta d'interféron) ont suggéré qu'une diminution du poids moyen à la naissance peut être associée à l'exposition bêta de l'interféron pendant la grossesse, mais cette constatation n'a pas été confirmée dans des études observationnelles plus importantes. Deux petites études ont observé une prévalence accrue de fausse couche, bien que la constatation n'ait été que statistiquement significative dans une étude. La plupart des études ont inscrit des patients plus tard pendant la grossesse, ce qui a rendu difficile la détermination du véritable pourcentage de fausses couches. Dans une petite étude de cohorte, un risque significativement accru de naissance prématurée après une exposition bêta à l'interféron pendant la grossesse a été observé.
Données sur les animaux
Dans une étude dans les singes de Cynomolgus enceintes, l'interféron bêta a été administré quotidiennement (doses intramusculaires environ 1 2 et 7 fois la dose humaine cumulée maximale recommandée basée sur la surface du corps) soit tout au long de la période d'organogenèse, soit plus tard dans la grossesse (jour de la gestation 90 à terme). Aucun effet indésirable sur le développement embryofétal n'a été observé; Cependant, la possibilité d'effets indésirables ne peut être exclue en raison du petit nombre d'animaux testés (six par groupe de dose à chaque période de développement).
LactationRésumé des risques
La littérature publiée limitée a décrit la présence de produits d'interféron bêta-1a dans le lait maternel à de faibles niveaux. Il n'y a pas de données sur les effets de l'interféron bêta-1a sur la production de lait. Par conséquent, les avantages du développement et de la santé de l'allaitement doivent être pris en considération avec le besoin clinique de la mère de la mère et tout effet indésirable potentiel sur l'enfant allaité de Rebif ou de l'état maternel sous-jacent.
Usage pédiatrique
La sécurité et l'efficacité des patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les études cliniques de Rebif n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente qui commence généralement à l'extrémité inférieure de la plage de dosage reflétant la plus grande fréquence de diminution de la fonction rénale ou cardiaque hépatique et de maladie concomitante ou autre médicament.
Informations sur la surdose pour Rebif
Aucune information fournie
Contre-indications pour Rebif
Rebif is contraindicated in patients with a history of hypersensitivity to natural or recombinant interferon beta human albumin or any other component of the formulation.
Pharmacologie clinique for Rebif
Mécanisme d'action
Le (s) mécanisme (s) par lequel Rebif (interféron bêta-1a) exerce ses effets thérapeutiques chez les patients atteints de sclérose en plaques est inconnu.
Pharmacodynamique
Les relations entre les taux sériques d'interféron bêta-1a et les activités pharmacodynamiques mesurables aux mécanismes par lesquelles Rebif exerce ses effets dans la sclérose en plaques est inconnue. Aucun effet lié au genre sur les paramètres pharmacodynamiques n'a été observé.
Pharmacocinétique
La pharmacocinétique de Rebif (interféron bêta-1a) chez les personnes atteintes de sclérose en plaques n'a pas été évaluée. Chez des sujets sains, une injection sous-cutanée (SC) unique de 60 mcg de Rebif (formulation liquide) a entraîné une concentration sérique maximale (CMAX) de 5,1 ± 1,7 UI / ml (moyenne ± ET) avec un temps médian de concentration sérique maximale (Tmax) de 16 heures. La demi-vie d'élimination sérique (T½) était de 69 ± 37 heures et la superficie sous la concentration sérique en fonction de la courbe temporelle (AUC) de zéro à 96 heures était de 294 ± 81 UI H / ml. Après tous les deux jours, des injections de SC chez des sujets sains, une augmentation de l'ASC d'environ 240% a été observée, ce qui suggère que l'accumulation d'interféron bêta-1a se produit après l'administration répétée. Le dégagement total est d'environ 33 à 55 l / heure. Il n'y a eu aucun effet lié au genre observé sur les paramètres pharmacocinétiques. La pharmacocinétique du Rebif chez les patients pédiatriques et gériatriques ou les patients atteints d'insuffisance rénale ou hépatique n'ont pas été établies.
Études cliniques
Deux études multicentriques ont évalué l'innocuité et l'efficacité du REBIF chez les patients atteints de sclérose en plaques rémittentes en remise.
L'étude 1 a été une étude randomisée contrôlée par un placebo en double aveugle chez les patients atteints de sclérose en plaques pendant au moins un an des scores de l'échelle de statut d'invalidité élargie de Kurtzke (EDSS) allant de 0 à 5 et au moins 2 exacerbations aiguës au cours des 2 années précédentes. Les patients atteints de formes progressives chroniques de sclérose en plaques ont été exclues de l'étude. Les patients ont reçu des injections sous-cutanées de placebo (n = 187) Rebif 22 mcg (n = 189) ou de Rebif 44 mcg (n = 184) administré trois fois par semaine pendant deux ans. Les doses d'agents de l'étude ont été progressivement augmentées à leurs doses cibles au cours des 4 à 8 premières semaines pour chaque patient de l'étude [voir Posologie et administration ].
Le critère d'évaluation de l'efficacité principale était le nombre d'exacerbations cliniques. De nombreux critères d'évaluation de l'efficacité secondaire ont également été évalués et ont inclus les effets des paramètres liés à l'exacerbation du traitement sur la progression de l'invalidité et des paramètres liés à l'imagerie par résonance magnétique (IRM). La progression de l'invalidité a été définie comme une augmentation du score EDSS d'au moins un point soutenu pendant au moins 3 mois. Les examens neurologiques ont été effectués tous les 3 mois pendant les exacerbations suspectées et coïncidant avec les examens de l'IRM. Tous les patients ont subi des scans IRM pondérés en T2 de densité de protons (PD / T2) au départ et tous les 6 mois. Un sous-ensemble de 198 patients a subi des scanneaux Mont-MMR pondérés en Pd / T2 et T1, en T2, en T1, pendant les 9 premiers mois. Sur les 560 patients inscrits 533 (95%) ont fourni 2 ans de données et 502 (90%) ont reçu 2 ans d'agent d'étude.
Les résultats de l'étude sont présentés dans le tableau 4 et la figure 1. Le Rebif à des doses de 22 mcg et 44 mcg administrés trois fois par semaine a considérablement réduit le nombre d'exacerbations par patient par rapport au placebo. Les différences entre les groupes 22 MCG et 44 MCG n'étaient pas significatives (p> 0,05).
Tableau 4: Points de terminaison cliniques et IRM de l'étude 1
| Placebo n = 187 | Rebif 22 MCG n = 189 | Rebif 44 MCG n = 184 | |
| Lié à l'exacerbation | |||
| Nombre moyen d'exacerbations par patient sur 2 ans12 (Pourcentage de réduction) | 2.56 | 1,82 ** (29%) | 1,73 *** (32%) |
| Pourcentage (%) des patients sans exacerbation à 2 ans3 | 15% | 25% * | 32% *** |
| Délai médian pour d'abord l'exacerbation (mois)14 | 4.5 | 7.6 ** | 9 6 *** |
| IRM | n = 172 | n = 171 | n = 171 |
| Pourcentage médian (%) Changement de la zone de lésion IRM PD-T2 à 2 ans5 | 11,0% | -1,2% *** | -3,8% *** |
| Nombre médian de lésions actives par patient par scan (PD / T2; 6 mois)5 | 2.25 | 0,75 *** | 0,5 *** |
| * P<0.05 compared to placebo ** P<0.001 compared to placebo *** p<0.0001 compared to placebo (1) Analyse en intention de traiter (2) Modèle de régression de Poisson ajusté pour le centre et le temps à l'étude (3) Régression logistique ajustée pour le centre. Les patients perdus de suivi avant une exacerbation ont été exclus de cette analyse. (L'analyse comprenait 185 183 et 184 patients pendant trois fois par semaine Placebo 22 MCG Rebif et 44 MCG Rebif respectivement). (4) Modèle de risque proportionnel Cox ajusté pour le centre (5) ANOVA sur les rangs ajusté pour le centre. Les patients atteints de scans manquants ont été exclus de cette analyse. |
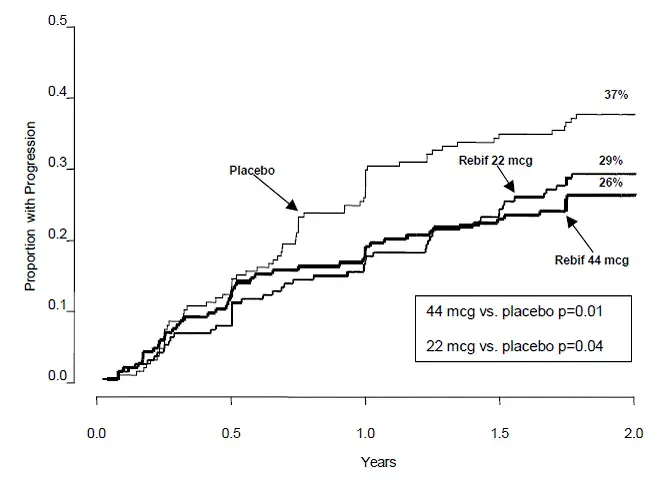
Le délai de début de la progression de l'invalidité soutenue pendant trois mois a été significativement plus long chez les patients traités par Rebif que chez les patients traités par placebo. Les estimations de Kaplan-Meier des proportions de patients souffrant d'invalidité soutenue sont représentées dans la figure 1.
Figure 1: Proportions de patients présentant une progression soutenue d'invalidité
 |
L'étude 2 était une étude randomisée à un comparateur actif à l'évaluateur ouvert randomisé. Les patients atteints de sclérose en plaques rémittentes avec des scores EDSS allant de 0 à 5,5 et au moins 2 exacerbations au cours des 2 années précédentes ont été éligibles à l'inclusion. Les patients atteints de formes progressives chroniques de sclérose en plaques ont été exclues de l'étude. Les patients ont été randomisés en traitement avec trois fois par semaine, des injections sous-cutanées de Rebif 44 MCG (n = 339) ou une fois par injections intramusculaires hebdomadaires de 30 mcg Avonex (n = 338). La durée de l'étude était de 48 semaines.
Le critère d'évaluation de l'efficacité principale était la proportion de patients qui sont restés sans exacerbation à 24 semaines. Le critère d'évaluation secondaire principal était le nombre moyen par patient par balayage des lésions IRM actives uniques combinées pendant 24 semaines définies comme toute lésion qui était T1 active ou T2 active. Des examens neurologiques ont été effectués tous les trois mois par un neurologue aveugle à l'attribution de traitement. Des visites de patients ont été effectuées mensuelles et des contacts téléphoniques au milieu du mois ont été effectués pour se renseigner sur les exacerbations potentielles. Si une exacerbation était suspectée, le patient a été évalué avec un examen neurologique. Les examens d'IRM ont été effectués mensuellement et analysés de manière aveugle au traitement.
Les patients traités par Rebif 44 MCG trois fois par semaine étaient plus susceptibles de rester sans rechute à 24 et 48 semaines que les patients traités avec Avonex 30 mcg une fois par semaine (tableau 5). Cette étude ne soutient aucune conclusion concernant les effets sur l'accumulation de handicap physique.
Tableau 5: Résultats cliniques et IRM de l'étude 2
| Rebif 44 MCG | Avonex 30 mcg | Différence absolue | Risque de rechute sur Rebif par rapport à AVONEX | |
| Rechutes | N = 339 | N = 338 | ||
| Proportion de patients sans rechute à 24 semaines1 | 75% * | 63% | 12% (95% IC: 5% 19%) | 0.68 (IC à 95%: 0,54 0,86) |
| Proportion de patients sans rechute à 48 semaines | 62% ** | 52% | 10% (95% là-bas: 2% 17%) | 0.81 (IC à 95%: 0,68 0,96) |
| IRM (through 24 weeks) | N = 325 | N = 325 | ||
| Médiane du nombre moyen de lésions IRM uniques combinées par patient par scan2 (25e 75e centiles) | 0,17 * (0,00 0,67) | 0.33 (0,00 1,25) | ||
| * P <0.001 (Rebif compared to AVONEX) ** P = 0.009 (Rebif compared to AVONEX) (1) Modèle de régression logistique ajusté pour le traitement et l'intention du centre pour traiter l'analyse (2) modèle ANCOVA non paramétrique ajusté pour le traitement et le centre avec des lésions uniques combinées comme la covariable unique |
Informations sur les patients pour Rebif
Rebif
(interféron bêta-1a) Injection pour une utilisation sous-cutanée
Lisez ce guide de médicaments avant de commencer à utiliser Rebif et chaque fois que vous obtenez une recharge. Il peut y avoir de nouvelles informations. Les informations ne prennent pas la place de parler avec votre fournisseur de soins de santé de votre état de santé ou de votre traitement.
Quelles sont les informations les plus importantes que je devrais connaître sur Rebif?
Rebif can cause serious side effects. Dites immédiatement votre professionnel de la santé si vous présentez l'un des symptômes énumérés ci-dessous tout en prenant Rebif.
1. Problèmes de santé comportementale, y compris la dépression et les pensées suicidaires. Vous pouvez avoir des problèmes d'humeur, notamment:
- dépression (feeling hopeless or feeling bad about yourself)
- Pensées de vous blesser ou de se suicider
2. Problèmes hépatiques ou aggravation des problèmes hépatiques, y compris l'insuffisance hépatique. Les symptômes peuvent inclure:
- nausée
- jaunissement de votre peau ou de la partie blanche de votre œil
- perte d'appétit
- fatigue
- Saignement plus facilement que la normale
- Urine de couleur foncée et pâle
- confusion stools
- envie de dormir
Au cours de votre traitement avec Rebif, vous devrez voir régulièrement votre fournisseur de soins de santé et passer des tests sanguins réguliers pour vérifier les effets secondaires.
3. Réactions allergiques et cutanées graves. Les symptômes peuvent inclure:
- démangeaison
- gonflement de ton visage les yeux lèvres langue ou gorge
- difficulté à respirer
- anxiété
- se sentir faible
- Les poussées éruptions cutanées dans la bouche ou les cloques et les pelures de la peau
4. Problèmes du site d'injection. Rebif may cause redness douleur démangeaison or swelling at the place where your injection was given. Call your healthcare provider right away if an injection site becomes swollen et douleurful or the area looks infected. You may have a skin infection or an area of severe skin damage (necrosis) requiring treatment by a healthcare provider.
Qu'est-ce que Rebif?
Rebif is a prescription medicine used to treat relapsing forms of sclérose en plaques to include clinically isolated syndrome relapsing-remitting disease et active secondary progressive disease in adults. It is a form of protein called beta interferon that is produced in the body.
On ne sait pas si le Rebif est sûr et efficace chez les enfants.
Qui ne devrait pas prendre Rebif?
Ne prenez pas Rebif si vous:
- sont allergiques à l'albumine humaine bêta de l'interféron ou à l'un des ingrédients de Rebif. Voir la fin de ce guide de médicaments pour une liste complète des ingrédients dans Rebif.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre Rebif?
Avant de prendre Rebif, dites à votre fournisseur de soins de santé si vous avez ou avez eu l'une des conditions suivantes:
- maladie mentale, y compris la dépression et le comportement suicidaire
- problèmes de foie
- Problèmes de saignement ou caillots sanguins
- faible nombre de cellules sanguines
- Saisies (épilepsie)
- Problèmes de thyroïde
- boire de l'alcool
- Vous êtes enceinte ou prévoyez de devenir enceinte. On ne sait pas si Rebif peut nuire à votre bébé à naître.
- Vous allaitez ou prévoyez d'allaiter. Rebif peut passer dans votre lait maternel. Parlez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé si vous prenez Rebif.
Parlez à votre fournisseur de soins de santé de tous les médicaments que vous prenez y compris les médicaments sur ordonnance et en vente libre des vitamines et des suppléments à base de plantes.
Rebif et other medicines may affect each other causing side effects.
Demandez à votre fournisseur de soins de santé ou à votre pharmacien une liste de ces médicaments si vous n'êtes pas sûr.
Connaissez les médicaments que vous prenez. Gardez une liste d'entre eux pour montrer votre fournisseur de soins de santé et votre pharmacien lorsque vous obtenez un nouveau médicament.
Comment dois-je utiliser Rebif?
- Voir les instructions pour une utilisation à la fin de ce guide de médicaments sur la façon de préparer et de donner une injection de Rebif à l'aide d'une seringue préreffilée. Pour l'auto-injecteur Rebif Rebidose, lisez les instructions d'utilisation qui sont livrées avec l'auto-injecteur Rebif Rebidose.
- Votre fournisseur de soins de santé devrait vous montrer comment préparer et mesurer votre dose de Rebif et comment injecter votre Rebif avant de l'utiliser pour la première fois.
- Rebif is given by injection under the skin (subcutaneous injection) on the same 3 days a week for example Monday Wednesday et Friday.
- Vos injections doivent être séparées d'au moins 48 heures. Prenez-les à la même heure chaque jour.
- Injecter Rebif exactement comme vous le dit votre fournisseur de soins de santé.
- Votre fournisseur de soins de santé vous dira la quantité de Rebif à injecter et peut modifier la dose en fonction de la façon dont votre corps réagit. N'injectez pas plus que votre prestataire de soins de santé ne vous le dit.
- Ne pas Changez votre dose à moins que votre fournisseur de soins de santé ne vous dise.
- Modifiez (tournez) votre site d'injection que vous choisissez à chaque injection. Cela aidera à réduire les chances que vous ayez une réaction du site d'injection.
- Ne pas Injectez le Rebif dans une zone du corps où la peau est irritée à rougissement infecté ou marqué de quelque manière que ce soit.
- Rebif comes as a:
- Sérengence prérempli (Rebif)
- Auto-injecteur prérempli à usage unique (auto-injecteur Rebif Rebidose) Votre fournisseur de soins de santé décidera lequel vous convient le mieux. Utilisez toujours une nouvelle seringue préfilée non ouverte de l'auto-injecteur Rebif ou Rebif Rebidose pour chaque injection. Ne réutilisez pas les seringues préremplies ou les auto-injecteurs Rebif Rebidose.
Quels sont les effets secondaires possibles de Rebif?
Rebif may cause serious side effects including:
- Vous voyez quelles sont les informations les plus importantes que je devrais connaître sur Rebif?
- Problèmes de sang. Rebif can affect your bone marrow et cause low red et white blood cell et platelet counts. In some people these blood cell counts may fall to dangerously low levels. If your blood cell counts become very low you can get infections et problems with bleeding et bruising. Your healthcare provider may ask you to have regular blood tests to check for blood problems.
- Hypertension artérielle pulmonaire. L'hypertension artérielle pulmonaire peut se produire avec des produits bêta d'interféron, notamment Rebif. Les symptômes peuvent inclure une fatigue nouvelle ou croissante ou un essoufflement. Contactez immédiatement votre fournisseur de soins de santé si vous développez ces symptômes.
- Crises. Certaines personnes ont eu des crises tout en prenant Rebif.
Les effets secondaires les plus courants du Rebif comprennent:
- symptômes pseudo-grippaux. Vous pouvez avoir des symptômes pseudo-grippaux lorsque vous commencez à prendre Rebif pour la première fois. Vous pouvez être en mesure de gérer ces symptômes pseudo-grippaux en prenant des réducteurs de douleur en vente libre et de fièvre. Pour de nombreuses personnes, ces symptômes diminuent ou disparaissent avec le temps. Les symptômes peuvent inclure:
- maux de muscle
- fièvre
- fatigue
- frissons
- douleurs à l'estomac
- Changement des tests sanguins du foie
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles du Rebif. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou à votre pharmacien.
Appelez votre médecin pour des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je stocker Rebif?
- Conservez Rebif dans le réfrigérateur entre 36 ° F et 46 ° F (2 ° C à 8 ° C).
- Ne pas Freeze Rebif.
- Si vous ne pouvez pas réfrigérer votre Rebif, vous pouvez stocker votre Rebif à des températures supérieures à 36 ° F et en dessous de 77 ° F (2 ° C à 25 ° C) pendant 30 jours.
- Éloignez le Rebif de la chaleur et de la lumière.
Gardez le Rebif et tous les médicaments hors de portée des enfants.
Informations générales sur l'utilisation sûre et efficace du Rebif
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide de médicaments. N'utilisez pas Rebif pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas de Rebif à d'autres personnes même s'ils présentent les mêmes symptômes que vous. Cela peut leur faire du mal.
Ce guide de médicaments résume les informations les plus importantes sur Rebif. Si vous souhaitez plus d'informations, parlez avec votre fournisseur de soins de santé. Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien pour des informations sur Rebif qui sont écrits pour les professionnels de la santé.
Pour plus d'informations, accédez ou appelez sans frais le 1-877-447âww.rebif.com 3243.
Quels sont les ingrédients de Rebif?
Ingrédient actif: interféron bêta-1a
Ingrédients inactifs: Albumine (humain) Mannitol Sodium Acétate Eau pour injection
Ce guide de médicaments a été approuvé par la Food and Drug Administration des États-Unis.
Extrait de graines de châtaignier à cheval
Instructions pour une utilisation
Rebif
(Re-bif) (interféron bêta-1a) (in-ter-feer-on beta-one-Ã ¢)
Lisez et suivez les instructions d'utilisation qui sont livrées avec votre seringue préfilée Rebif avant de commencer à l'utiliser et chaque fois que vous obtenez une recharge. Avant d'utiliser pour la première fois une seringue préfilée Rebif, assurez-vous que votre fournisseur de soins de santé vous montre la bonne façon de l'utiliser.
Important: Pour l'auto-injecteur Rebif Rebidose, lisez les instructions d'utilisation qui sont livrées avec l'auto-injecteur Rebif Rebidose.
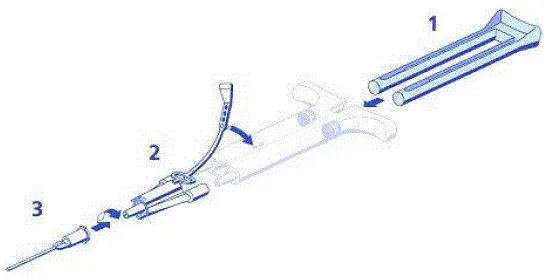
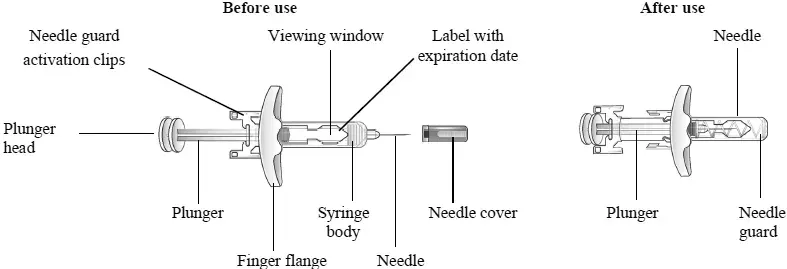
Parties de votre seringue préfilée Rebif (voir figure A).
Figure A
 |
Fournitures nécessaires pour une injection Rebif (voir figure B):
- Rebif prefilled syringe
- Tampon d'alcool ou boules de coton et alcool à friction
- petite bande de bandage adhésive si vous le souhaitez
- Récipient de sécurité résistant à la perforation pour l'élimination des seringues utilisées. Voir l'élimination de votre section d'aiguilles et de seringues à l'étape 4 de l'IFU.
- savon antibactérien
- Une douleur ou de la fièvre en vente libre réduisant la médecine si votre fournisseur de soins de santé a recommandé de prendre cela avant en même temps ou après vous donner un Rebif pour aider à réduire les frissons de fièvre transpirant et les maux musculaires (symptômes pseudo-grippaux) qui peuvent se produire.
Figure B
 |
Calendrier de titrage (dosage)
Lors du début du traitement avec Rebif, votre fournisseur de soins de santé peut prescrire la dose de 22 MCG ou 44 MCG de Rebif. Vous devriez progressivement augmenter la dose sur 4 semaines à partir de 20% de la dose prescrite pour la demi-dose de 2 premières semaines pour les 2 dernières semaines (semaines 3 et 4), puis la dose complète prescrite par votre fournisseur de soins de santé.
Si votre dose prescrite est de 22 mcg de Rebif, un pack de titration Rebif contenant 6 seringues préremplies avec 8,8 mcg et 6 seringues préremplies avec 22 mcg doit vous être prescrite pour une utilisation pendant la période de départ de 4 semaines. Le tableau 1 explique le montant à injecter en utilisant les seringues du pack de titrage Rebif pour augmenter progressivement à 22 mcg.
Tableau 1: Calendrier de titrage pour une dose prescrite de 22 mcg *
| Semaine d'utilisation | Seringue à utiliser | Quantité de seringue |
| Titre de la semaine 1 | Syringe 8.8 MCG | Utiliser la moitié de la seringue |
| Titre de la semaine 2 | Syringe 8.8 MCG | Utiliser la moitié de la seringue |
| Titre de la semaine 3 | Syringe 22 MCG | Utiliser la moitié de la seringue |
| Titre de la semaine 4 | Syringe 22 MCG | Utiliser la moitié de la seringue |
| Semaine 5 et sur | Syringe 22 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| * Seules les seringues préremplies peuvent être utilisées pour titrer à la dose prescrite de 22 MCG |
Si votre dose prescrite est de 44 mcg, vous pouvez être prescrit soit un pack de titrage Rebif (décrit ci-dessus) ou un pack de titrage Rebif Rebidose contenant 6 auto-injecteurs avec 8,8 mcg et 6 auto-injecteurs avec 22 mcg pour une utilisation pendant la période de titrage de 4 semaines. Le tableau 2 explique le montant à injecter à l'aide du pack de titrage Rebif ou du pack de titrage Rebif Rebidose pour passer progressivement à 44 mcg.
Tableau 2: Calendrier de titrage pour une dose prescrite de 44 MCG **
| Semaine d'utilisation | Seringue ou auto-injecteur à utiliser | Quantité de seringue or autoinjector |
| Titre de la semaine 1 | Syringe 8.8 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Titre de la semaine 2 | Syringe 8.8 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Titre de la semaine 3 | Syringe 22 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Titre de la semaine 4 | Syringe 22 MCG or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| Semaine 5 et sur | 44 MCG syringe or autoinjector | Utilisez une seringue complète ou une auto-injecteur |
| ** Des seringues ou auto-injecteurs préfacés peuvent être utilisés pour titrer à 44 MCG dose prescrite |
Étape 1. Préparation de votre injection de Rebif
- Vérifiez la date d'expiration. Ne pas use if the medication is expired. La date d'expiration est imprimée sur l'emballage et le carton de seringue en plastique de seringue.
- Retirez votre seringue Rebif du réfrigérateur au moins 30 minutes avant de planifier de l'utiliser afin qu'elle puisse se réchauffer à température ambiante. Ne pas chauffer ou micro-ondes le médicament.
- Assurez-vous que la dose soit 8,8 mcg 22 mcg ou 44 mcg décrite sur le carton est la même que la dose prescrite par votre fournisseur de soins de santé.
- Retirez la seringue Rebif de l'emballage en plastique. Gardez l'aiguille coiffée.
- Regardez attentivement le contenu de la seringue. Le liquide doit être clair à légèrement jaune. Ne pas use if the liquid is cloudy discolored or contains particles. Utilisez une seringue différente.
Étape 2. Choisissez et préparez votre site d'injection
- Les meilleurs sites pour vous donner une injection sont les zones avec une couche de graisse entre la peau et les muscles comme votre cuisse la surface extérieure du haut du bras votre estomac ou vos fesses.
- Ne pas Utilisez la zone près de votre tour de taille ou à moins de 2 pouces de votre nombril. Si vous êtes très mince, utilisez uniquement la cuisse ou la surface extérieure du bras pour l'injection.
- Utilisez un site différent chaque fois que vous injectez comme l'estomac de la hanche de la cuisse ou le haut du bras (voir figure C).
Figure C
 |
- Ne pas Injectez le Rebif dans une zone de votre corps où la peau est irritée à rougir infecté ou anormal.
- Lavez-vous soigneusement les mains avec du savon antibactérien avant de se préparer à injecter le médicament.
- Nettoyez le site d'injection avec un tampon d'alcool ou une boule de coton avec de l'alcool à frotter à l'aide d'un mouvement circulaire. Pour éviter les picoter, vous devez laisser sécher votre peau avant d'injecter le Rebif.
Étape 3. Injectez votre Rebif
- Retirez le capuchon d'aiguille de l'aiguille de seringue.
- Si votre fournisseur de soins de santé vous a dit d'utiliser moins que la dose complète de 0,5 ml, poussez lentement le piston jusqu'à ce que la quantité de médicaments laisse dans la seringue soit le montant que le fournisseur de soins de santé vous a dit d'utiliser.
- Utilisez votre pouce et votre index pour pincer un coussin de peau entourant le site d'injection nettoyé (voir figure D). Tenez la seringue comme un crayon avec votre autre main.
Figure D
 |
- Tout en pinçant la peau, insérez rapidement l'aiguille comme une fléchette à environ un angle de 90 degrés (juste sous la peau) dans le coussin de tissu comme indiqué (voir figure E).
Figure E
 |
- Une fois que l'aiguille est en retirez la main que vous avez utilisée pour pincer votre peau et injecter le médicament en utilisant une poussée lente stable sur le piston jusqu'à ce que tout le médicament soit injecté et que la seringue soit vide (voir la figure F).
Figure F
 |
- Retirez l'aiguille et appliquez une pression douce sur le site d'injection avec une boule de coton sec ou une gaze stérile. L'application d'une compresse froide ou d'un pack de glace sur le site d'injection après l'injection peut aider à réduire les réactions cutanées locales.
- Mettez une petite bande de bandage adhésive sur le site d'injection si vous le souhaitez.
- Gardez un enregistrement de la date et de l'emplacement de chaque injection.
- Après 2 heures, vérifiez le site d'injection pour le gonflement ou la tendresse rouge. Si vous avez une réaction cutanée et que cela ne s'éclaircit pas dans quelques jours, appelez votre fournisseur de soins de santé.
Étape 4. Éliminer vos aiguilles et seringues
- Mettez vos seringues et auto-injecteurs d'aiguilles d'occasion, y compris le Rebif dans un conteneur de barres d'artisanat apparenté à FDA immédiatement après utilisation. Ne pas throw away (dispose of) any syringes or autoinjectors in your household trash.
Si vous ne disposez pas d'un conteneur d'élimination des objets tranchants approuvé par la FDA, vous pouvez utiliser un conteneur domestique qui est:
- fait d'un plastique robuste
- fermé avec un couvercle résistant aux crevaisons
- droit et stable pendant l'utilisation
- résistant à la fuite et
- correctement étiqueté pour avertir des déchets dangereux à l'intérieur du récipient.
- Lorsque votre conteneur d'élimination des objets tranchants est presque plein, vous devrez suivre vos directives communautaires pour la bonne façon de disposer de votre conteneur d'élimination des objets tranchants. Il peut y avoir des lois étatiques ou locales sur la façon dont vous devez jeter les auto-injecteurs et les aiguilles de seringue utilisées. Pour plus d'informations sur l'élimination des objets de reculations sûrs et pour des informations spécifiques sur l'élimination des objets tranchants dans l'État dans lesquelles vous vivez sur le site Web de la FDA à: https://www.fda.gov/safesharpsdispososition.
- Ne pas dispose of your used sharps disposal container in your household trash unless your community guidelines permit this. Ne pas recycle your used sharps disposal container.
Ce guide de médicaments a été approuvé par la Food and Drug Administration des États-Unis.